乳状液的组成及油滴粒径对β-胡萝卜素生物接近度的影响
张金迪,樊金玲*,杨 睿,朱文学,孙晓菲
(河南科技大学食品与生物工程学院,河南 洛阳 471003)
β-胡萝卜素是一种广泛存在于水果和蔬菜中的脂溶性营养成分[1],是人体VA的主要来源,具有抗癌、预防心血管疾病等多种功能,可防止老化和衰老引起的多种退化性疾病[2-3]。β-胡萝卜素的生物利用过程包括:从食品基质中释放至消化液→在小肠内形成脂质胶束→被小肠黏膜细胞吸收→被转运至门脉及淋巴循环及在肝脏中转化为VA或被储存4个步骤[4]。在体外实验中,常用β-胡萝卜素从食品基质中释放到胃肠道随后被包被在脂质微粒中程度——即“生物接近度”来评价食物中β-胡萝卜素的生物利用率。食物中的β-胡萝卜素在人体内的利用率较低[5],原因可能与β-胡萝卜素在食物基质中被包被、水溶性差以及化学不稳定性等有关[6]。因此,制备高生物利用率的β-胡萝卜素功能性食品和膳食补充剂具有广阔的市场前景。
采用高压均质技术制备乳状液作为β-胡萝卜素的载体,克服了其不溶于水及易被氧化等缺点,可有效提高其生物利用率[7-8]。许多因素影响乳状液中β-胡萝卜素的生物利用率,如油滴粒径、脂肪含量和性质、β-胡萝卜素浓度及乳化剂的类型等。Wang Pan[9]、Salvia-Trujillo[10]和Yi Jiang[11]等的研究表明,β-胡萝卜素的生物接近度随乳状液中油滴粒径的减小而增大。Salvia-Trujillo[12]和McClements[13]等报道了β-胡萝卜素的生物接近度随乳状液中油相含量的升高而增大;但是也有研究发现:均质处理前在胡萝卜泥中加入油脂(5%橄榄油)对β-胡萝卜素的生物接近度无显著影响[14]。Qian Cheng等[6]的研究表明载体油类型影响乳状液中β-胡萝卜素的生物接近度,油相分别为长链脂肪酸(玉米油)、中链脂肪酸(Miglyol 812)和不被消化的风味油(橙油)时,β-胡萝卜素的生物接近度逐渐降低(分别为66%、2%、0%)。Wang Pan等[9]的研究表明油相中β-胡萝卜素的含量在0.025%~0.050%范围内时,其胶束化率逐渐降低,但当β-胡萝卜素的含量继续增加时,其胶束化率没有明显变化。Liu Yuwei等[15]的研究表明不同乳化剂(司盘-20、乳清分离蛋白、可溶性大豆多糖)影响乳状液的物理性质、微观结构,进而影响β-胡萝卜素的生物接近度,其生物接近度大小顺序为:乳清分离蛋白>司盘-20>可溶性大豆多糖。
本实验以胶束化率为指标、采用静态体外消化法研究吐温-20作为乳化剂制备的乳状液中β-胡萝卜素的生物接近度,着重探讨β-胡萝卜素的胶束化过程、均质压力和次数、β-胡萝卜素质量分数和油相含量对乳状液中β-胡萝卜素生物接近度的影响规律及可能机制。以期为乳状液形式的β-胡萝卜素膳食补充剂和强化剂的开发和研制提供理论依据。
1 材料与方法
1.1 材料与试剂
全反式β-胡萝卜素(产品号:101335477,纯度≥98%)美国Sigma公司。
吐温-20(分析纯) 上海山浦化工有限公司;正己烷、丙酮、无水乙醇均为国产分析纯 天津德恩化学试剂厂;胃蛋白酶、胰酶、胆盐均为生化级 美国Sigma公司;大豆油(食品级) 中粮食品营销有限公司。
1.2 仪器与设备
GYB50-6S高压均质机 上海东华高压均质机厂;QYC-2102C恒温培养摇床 上海福玛实验设备有限公司;FA1004分析天平 上海上平仪器公司;TGL-18C高速台式离心机 上海安亭科学仪器厂;NPW-12水浴氮吹仪 合肥艾本科学仪器有限公司;36X生物显微镜上海巴拓仪器有限公司;PHS-3C型pH计 上海越平科学仪器有限公司。
1.3 方法
1.3.1 全反式β-胡萝卜素样品定性分析
采用高效液相色谱法(high performance liquid chromatography,HPLC)对全反式β-胡萝卜素样品进行定性分析。
HPLC条件:色谱柱:YMC C30(4.6 mm×250 mm,5 μm);柱温:25℃;流速:1 mL/min;进样量:10 μL;流动相A:甲醇,流动相B:甲基叔丁基醚。洗脱条件:0~10 min 50% A。检测器波长范围:190~550 nm;检测波长:450 nm。
1.3.2 β-胡萝卜素乳状液的制备
油相制备:将质量分数0.2%的β-胡萝卜素和大豆油混合,超声波处理5 min,低于50℃加热搅拌5 min,使β-胡萝卜素完全溶解于大豆油中。
水相制备:10.0 mmol/L磷酸盐缓冲液(pH 7.0)。
将5%(质量分数,下同)的油相、1.5%的吐温-20和93.5%的水相混合,1 000 r/min剪切5 min,高压均质机20 MPa均质1次,得到β-胡萝卜素乳状液。
为研究油相含量对β-胡萝卜素生物接近度的影响,乳状液中油相含量分别选择1%、2%、4%、5%、7%、9%、10%、12%、15%、18%、20%。为研究β-胡萝卜素浓度对生物接近度的影响,分别制备β-胡萝卜素质量分数为2、5、10、15、20、30 mg/100 g的乳状液。
1.3.3 体外消化法
该方法参考文献[16-18]并做适当修改。
胃消化法:称取5 g β-胡萝卜素乳状液置于150 mL锥形瓶中,加入10 mL电解质溶液(50 mmol/L NaCl、14 mmol/L KCl、3.5 mmol/L KH2PO4、10 mmol/L CaCl2•2H2O、3.6 mmol/L MgCl2•6H2O),1 mol/L HCl调节pH值至2.0,加入2 mL胃蛋白酶液(50.25 mg/mL,胃蛋白酶溶于0.1 mol/L HCl)保鲜膜封口放入摇床,于37℃、95 r/min消化1 h。
肠消化法:取出锥形瓶,用1 mol/L NaHCO3调节pH值至6.90±0.01,加入9 mL胆盐-胰酶液(31.13 mg/mL、5 mg/mL;胆盐、胰酶溶于0.1 mol/L NaHCO3),封口放入摇床,于37℃、95 r/min消化2 h。
1.3.4 生物接近度(胶束化率)的测定
上述消化过程结束后,于5 000×g离心10 min得到上清液,上清液过0.22 μm有机滤膜得到胶束(用于分析β-胡萝卜素可能被小肠吸收的程度——胶束化率)。
胶束中β-胡萝卜素的萃取:避光条件下,在胶束中加入等体积萃取剂,轻微振荡,静置分层;反复萃取至无色,合并萃取液;用氮吹仪吹干后复溶,待测。
β-胡萝卜素质量浓度的测定:采用紫外-可见分光光度计于450 nm波长处定量测定待测样品中β-胡萝卜素的质量浓度。通过下式计算β-胡萝卜素的胶束化率。
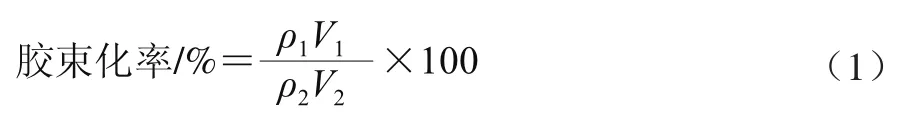
式中:ρ1为胶束中β-胡萝卜素的质量浓度/(μg/mL);ρ2为乳状液中β-胡萝卜素的质量浓度/(μg/mL);V1为胶束体积/mL;V2为乳状液体积/mL。
肠消化不同时间乳状液中β-胡萝卜素的相对胶束化率按照下式计算。
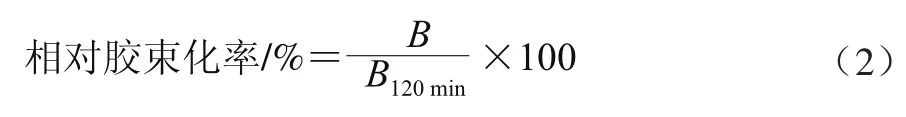
式中:B为肠消化不同时间乳状液中β-胡萝卜素的胶束化率/%;B120min为肠消化120 min时乳状液中β-胡萝卜素的胶束化率/%。
1.3.5 粒度分析
用光学显微镜(放大16×40倍)观察β-胡萝卜素乳状液以及胃消化前后、肠消化前后消化液的微观结构。显微图片由Canon IXUS 125 HS相机拍摄。油滴粒径通过图像处理软件Adobe Photoshop CS5测定[19]。油滴粒径dn由式(3)计算得出,平均粒径-d由式(4)计算得出,体积百分比由式(5)计算得出。

式中:dn’为通过显微图片测得的油滴粒径/mm;16×40为显微镜的放大倍数;1 000为μm与mm间的换算倍数。
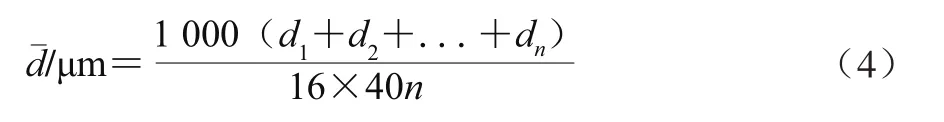
式中:n为显微图片中油滴个数。
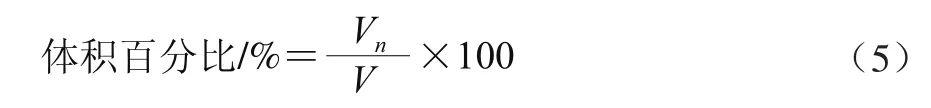
式中:Vn为粒径为dn油滴的体积和/μm3;V为所有油滴的总体积/μm3。
1.4 数据统计分析
所有实验重复3次。用DPS 3.01数据处理软件,对实验结果进行0.01水平上的单因素试验统计分析。
2 结果与分析
2.1 全反式β-胡萝卜素HPLC分析结果
图1为全反式β-胡萝卜素标准品的HPLC图和全波长扫描光谱图。可知本标准品不含有其他异构体。
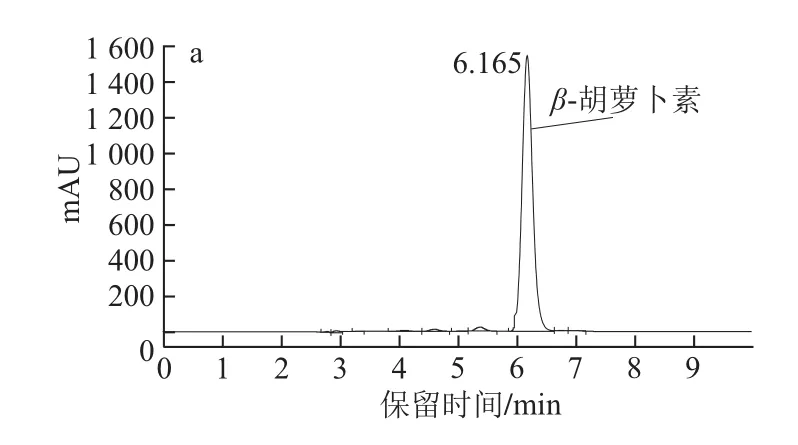
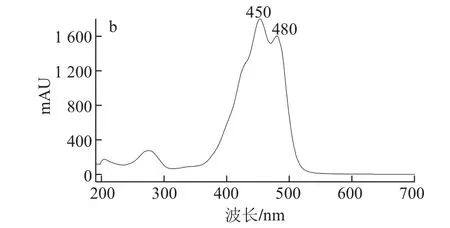
图1 全反式β-胡萝卜素的HPLC图(450 nm)(a)及全波长扫描光谱图(b)Fig.1 HPLC chromatogram (at 450 nm) (a) and UV absorption spectrum (b) of all-trans-β-carotene
2.2 体外消化体系中β-胡萝卜素的胶束化过程
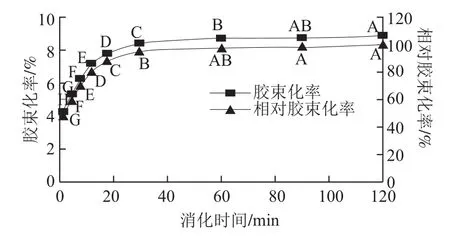
图2 乳状液中β-胡萝卜素在不同消化时间的胶束化率和相对胶束化率Fig.2 Ratio and relative ratio of β-carotene transferred from the emulsion to a micellar phase at different digestion times
图2为乳状液中β-胡萝卜素经肠消化不同时间(2、5、8、12、18、30、60、90、120 min)的胶束化率和对应得到的相对胶束化率。可知在肠消化初始阶段的0~12 min内,β-胡萝卜素的胶束化率增长很快:如肠消化2 min时,β-胡萝卜素的胶束化率和相对胶束化率分别为4.26%、47.7%;肠消化12 min时,β-胡萝卜素的胶束化率和相对胶束化率分别已经达到7.12%、79.8%;肠消化12~30 min阶段,β-胡萝卜素的胶束化率增长变缓,相对胶束化率由79.8%增加至94.4%;30 min之后无明显变化。β-胡萝卜素的胶束化过程与脂肪水解过程密切相关;脂肪在胰脂肪酶的作用下生成的脂肪酸,与胆盐等共同形成胶束,大油滴同时变成小油滴,位于油滴中的
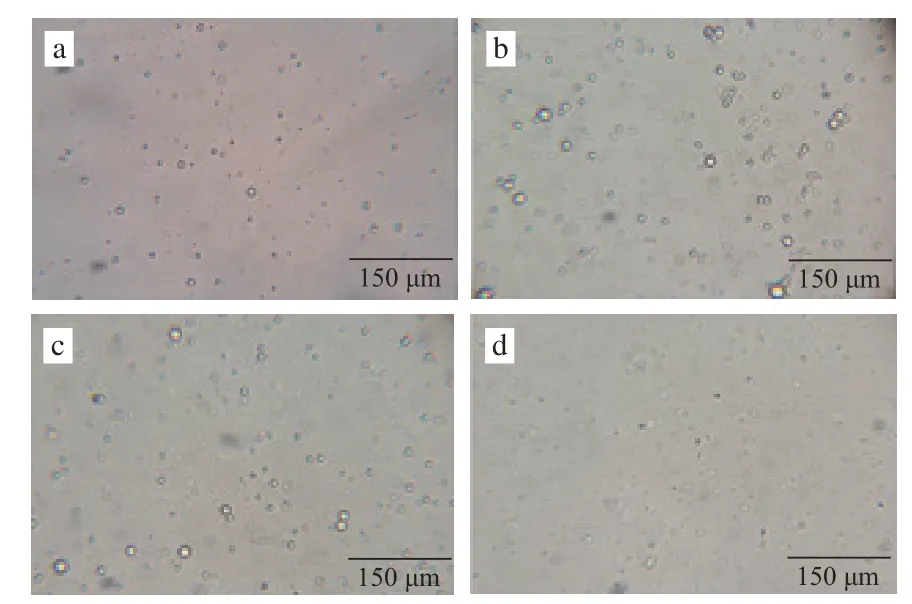
图3 胃肠消化过程中乳状液微观结构的变化Fig.3 Microstructural changes of the emulsion during gastrointestinal digestion
β-胡萝卜素迁移至胶束中进而被吸收。实验观察了胃消化前后、肠消化前后消化液中分散相(即油滴)的微观结构变化(消化液用pH 7.0的磷酸盐缓冲液稀释5倍)。如图3所示,胃消化后部分油滴发生明显的聚集现象,Salvia-Trujillo等[10]的研究也发现了相似的现象。这一现象可能和消化液pH值的变化以及机械振荡有关。一方面,胃液的酸性环境可引起油滴的絮凝或聚结,另一方面,模拟胃消化过程中的蠕动所采用的振荡则有利于油滴的分散,油滴聚结速率和分散速率相对平衡时,乳状液中液滴的大小也相对恒定[10,20]。在肠消化阶段起始时(即肠消化前),油滴聚集现象减弱;这可能与加入胆盐-胰酶液对消化液稀释作用、溶液成分和pH值的变化有关[21]。消化液浓度的减小减弱了油滴间疏水相互作用,离子强度和pH值的变化改变了液滴之间的静电相互作用,从而破坏了油滴的聚合[10]。肠消化结束后的显微观察图中基本看不到油滴,说明大粒径油滴已经被脂肪酶水解。Amyoony[20]的研究也表明,肠消化时脂肪分解速率最快在前4 min,30 min时脂肪分解率基本达到最大值。脂肪的变化过程与本研究中β-胡萝卜素胶束化率的变化过程相吻合,从一定程度上说明了脂肪水解与β-胡萝卜素胶束化过程的相关性,而肠消化前30 min是脂肪水解和β-胡萝卜素胶束化过程的重要阶段。
2.3 均质压力和次数对乳状液中β-胡萝卜素生物接近度的影响
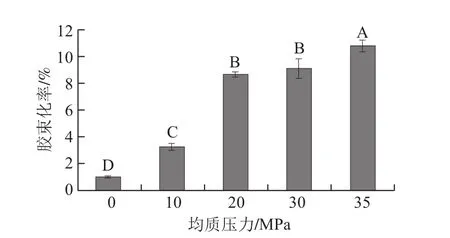
图4 不同均质压力对乳状液中β-胡萝卜素生物接近度的影响Fig.4 Effect of different homogenization pressures on the bioaccessibility of β-carotene incorporated in emulsions
研究不同均质压力(0、10、20、30、35 MPa)对乳状液中β-胡萝卜素生物接近度的影响,结果如图4所示。β-胡萝卜素生物接近度随均质压力的升高而增大,除均质压力为20、30 MPa之间的差异不显著外,其余均达到显著水平。如未经均质处理的样品中β-胡萝卜素的胶束化率仅为0.98%,均质压力为10、20、35 MPa时,胶束化率分别增加至3.23%、8.71%和10.87%,约是未均质样品的3.3、8.9、11倍。
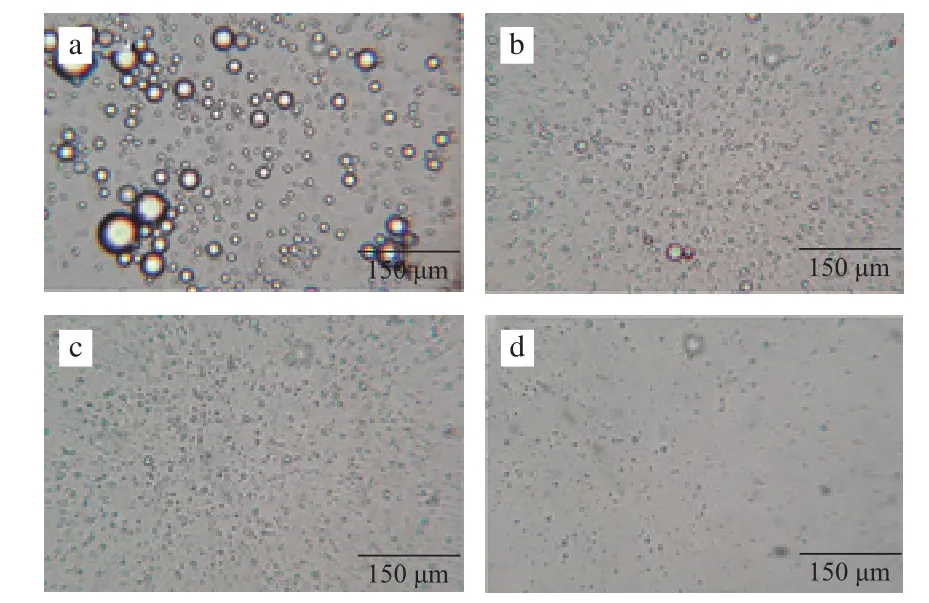
图5 不同均质压力下β-胡萝卜素乳状液的微观结构Fig.5 Microstructures of β-carotene emulsions homogenized at 10, 20,30 and 35 MPa
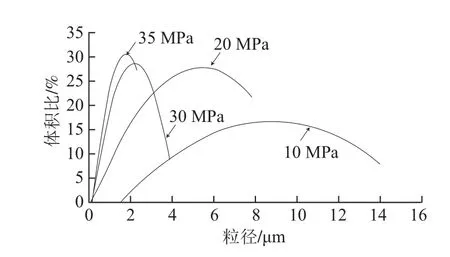
图6 不同均质压力下β-胡萝卜素乳状液的粒度分布Fig.6 Particle size distribution of β-carotene emulsions homogenized at 10, 20, 30 and 35 MPa
图5为不同均质压力下β-胡萝卜素乳状液的显微图片,图6为其对应的粒度分布情况。随着均质压力的增大,乳状液中油滴的平均粒径减小,粒径分布范围也越来越窄。如10 MPa时,乳状液中油滴粒径范围约为1.56~14.06 µm,平均粒径约为4.28 µm;均质压力为20、30、35 MPa时,乳状液中油滴粒径范围分别约为 0.39~7.81、0.16~3.91、0.16~2.34 µm,油滴平均粒径分别减小至1.60、0.86、0.44 µm,乳状液中油滴的平均粒径和胶束化率的关系如图7所示,油滴的平均粒径与胶束化率呈线性负相关,即胶束化率随油滴平均粒径的减小而增大。
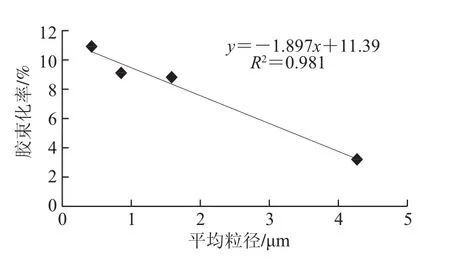
图7 油滴平均粒径和胶束化率的关系Fig.7 Relationship between average oil droplet size and the ratio of β-carotene incorporated into micelles
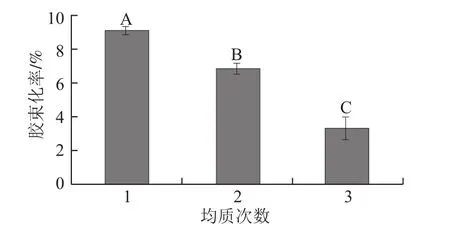
β-胡萝卜素生物接近度的影响Fig.8 Effect of different homogenization cycles on the bioaccessibility of β-carotene incorporated in emulsions图8 不同均质次数对乳状液中
研究不同均质次数(1、2、3次)对乳状液中β-胡萝卜素生物接近度的影响,结果如图8所示。随着均质次数的增加,β-胡萝卜素的胶束化率显著降低:20 MPa均质1次的胶束化率分别约为2次的1.3倍,3次的2.7倍。高压均质过程中大油滴被剪切为小油滴,一方面使脂肪与消化酶之间作用的表面积增大[13],更多的油滴被水解为脂肪酸,从而形成更多的胶束;另一方面,由于油滴粒径的减小,也使得β-胡萝卜素从油滴中转移至胶束中的迁移半径减小,迁移阻力随之减小;β-胡萝卜素的胶束化率也因此得到提高。Wang Pan[9]和Salvia-Trujillo[10]等也报道了β-胡萝卜素的生物接近度随油滴粒径的减小而增加,这与本实验中均质压力对β-胡萝卜素生物接近度影响的研究结果一致。但是本实验同时发现,在同一均质压力条件下,增加均质次数同样可使油滴粒径减小,而β-胡萝卜素的胶束化率却意外地显著降低,说明除油滴粒径外的其他因素影响了β-胡萝卜素的胶束化率。随着均质次数增加,乳状液形成过程中分散液滴表面形成的界面膜强度的紧密程度增大[22],β-胡萝卜素难以从油滴中释放转移至胶束中。
2.4 油相含量对乳状液中β-胡萝卜素生物接近度的影响
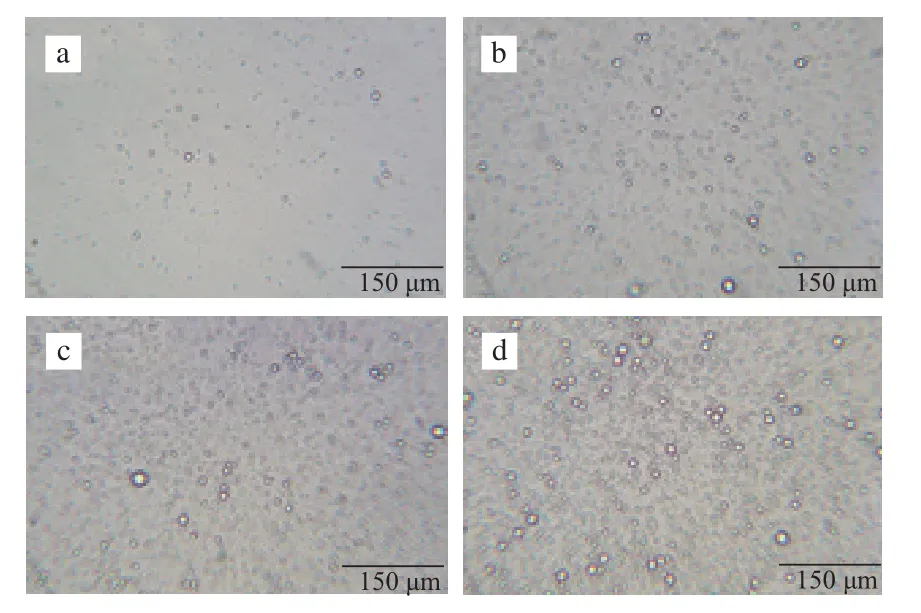
图9 不同油相含量乳状液的微观结构Fig.9 Microstructures of emulsions containing different oil contents
图9为不同油相含量(5%、10%、15%、20%)乳状液的显微图片(用pH 7.0的磷酸盐缓冲液稀释5倍)。随着油相含量的增加,乳状液中油滴越来越多,分布越来越密集,但油滴的平均粒径差别不大,约为1.60 µm。
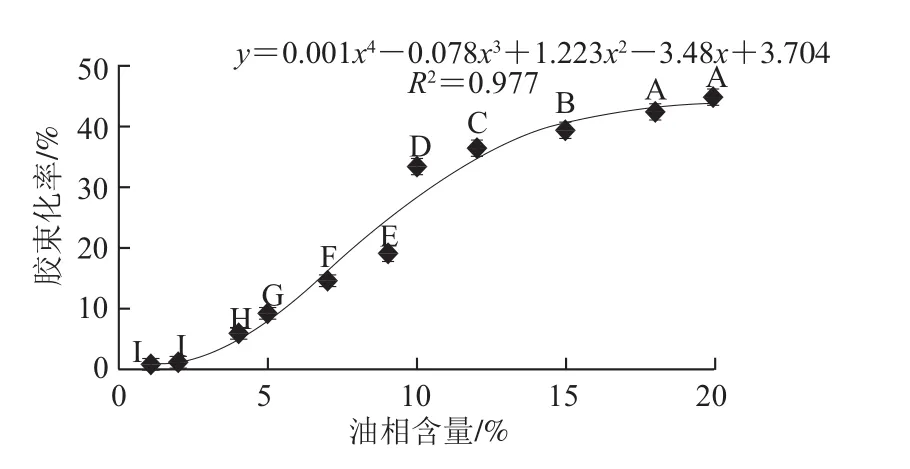
β-胡萝卜素生物接近度的影响Fig.10 Effects of different oil contents on the bioaccessibility of β-carotene incorporated in emulsions图10 不同油相含量对乳状液中
不同油相含量对乳状液中β-胡萝卜素的胶束化率影响如图10所示。β-胡萝卜素的胶束化率随着油相含量的增加呈“S”型增长趋势。当油相含量小于2%时,β-胡萝卜素的胶束化率增长缓慢;当油相含量为2%~18%时,β-胡萝卜素的胶束化率增长较快;而当油相含量大于18%时,β-胡萝卜素的胶束化率不再继续增长,维持在一较高的水平(42.51%)。当油相含量在一定范围内时,随着其含量增大,更多的油脂被脂肪酶消化形成脂肪酸,参与胶束的形成,因此β-胡萝卜素的胶束化率随之上升。由于消化体系中脂肪酶和胆盐的浓度是一定的,限制了其对更多脂肪水解和胶束形成的影响,因此,当油相含量增大至某一水平以上时,β-胡萝卜素的胶束化率不再随之变化,而是维持在一个较高的水平。
诸多研究者报道了油相含量对β-胡萝卜素生物接近度的影响,但结论却有较大差异。Salvia-Trujillo等[12]的研究表明乳状液中油相含量增加4倍(1%~4%)时,β-胡萝卜素的生物接近度增加了6倍(14%~84%);Hornero-Méndez等[23]研究也发现添加5%的油可以提高类胡萝卜素的胶束化率。但Svelander[24]的研究表明油的存在和类胡萝卜素的生物接近度没有明显的相关性;Knockaert等[14]的研究发现,均质处理前在胡萝卜泥中加入油脂(5%橄榄油)对β-胡萝卜素的生物接近度无显著影响。本实验结果则表明油相含量对β-胡萝卜素生物接近度的影响与油相含量的范围有关。如实验所获得的“S”型曲线的前段和后段,即油相含量较低(1%~2%)或较高(18%~20%)时,对β-胡萝卜素生物接近度影响不显著,而在“S”型曲线的中段,β-胡萝卜素生物接近度随油相含量的增加而显著增大。这一结果部分解释了前人研究结论在表面上相互矛盾的原因。
2.5 乳状液中β-胡萝卜素质量分数对其生物接近度的影响
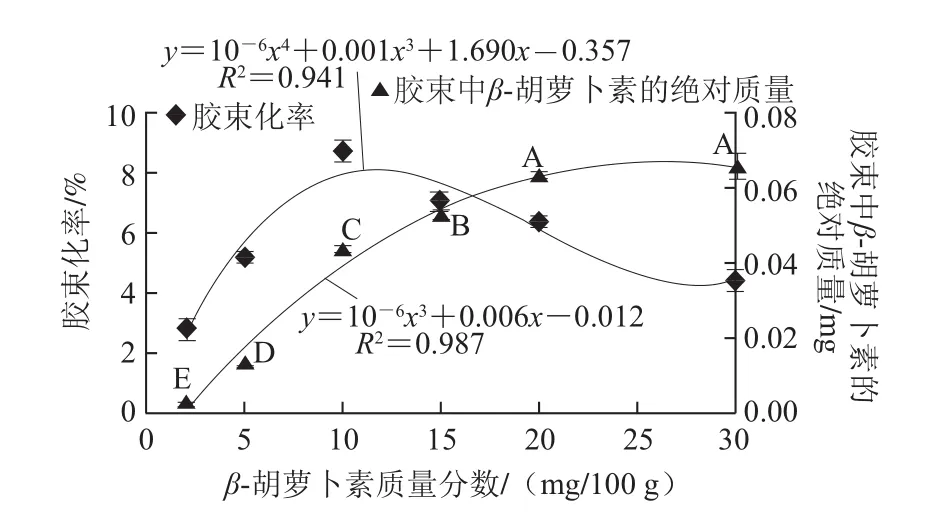
图11 β-胡萝卜素质量分数对乳状液中β-胡萝卜素生物接近度的影响Fig.1 Effect of β-carotene concentration on the bioaccessibility of β-carotene incorporated in emulsions
研究乳状液中β-胡萝卜素质量分数对其生物接近度的影响,结果如图11所示。随着乳状液中β-胡萝卜素质量分数的升高,其胶束化率先上升后下降,而胶束中β-胡萝卜素的绝对质量则呈先上升而后进入平台期的变化趋势。由于体系中油相和胆盐含量是一定的,形成胶束的最大能力也是一定的,从而使胶束包被β-胡萝卜素的能力也相应地存在一个饱和值。β-胡萝卜素在消化液中可能以4种形式存在:包被于胶束中、溶于油滴、附于可溶性聚合物中或呈不溶状态[25]。本实验发现,消化液经离心后的沉淀部分有些是橘黄色,部分油相被水解成脂肪酸,溶于其中的β-胡萝卜素在消化液中呈不溶状态,经离心沉淀出来。
3 结 论
在一定范围内,β-胡萝卜素的胶束化率与乳状液中油滴平均粒径线性负相关;β-胡萝卜素的生物接近度随油相含量增加而增加,达到一定值时趋于饱和;乳状液中β-胡萝卜素的胶束化率随其质量分数的增加先上升后降低,而胶束中β-胡萝卜素的绝对质量则呈先上升而后进入平台期的变化趋势。
[1]JOHNSON E J.The role of carotenoids in human health[J].Nutrition in Clinical Care, 2002, 5(2): 56-65.
[2]RAO A V, RAO L G.Carotenoids and human health[J].Pharmacological Research, 2007, 55(3): 207-216.
[3]KEY T J.Fruit and vegetables and cancer risk[J].British Journal of Cancer, 2011, 104: 6-11.
[4]HOF K H, WEST C E, WESTSTRATE J A, et al.Dietary factors that affect the bioavailability of carotenoids[J].The Journal of Nutrition,2000, 130(3): 503-506.
[5]FERNÁNDEZ-GARCÍA E, CARVAJAL-LÉRIDA I, JARÉNGALÁN M, et al.Carotenoids bioavailability from foods: from plant pigments to efficient biological activities[J].Food Research International, 2012, 46: 438-450.
[6]QIAN Cheng, DECKER E A, XIAO Hang, et al.Nanoemulsion delivery systems: influence of carrier oil on β-carotene bioaccessibility[J].Food Chemistry, 2012, 135(3): 1440-1447.
[7]ACOSTA E.Bioavailability of nanoparticles in nutrient and nutraceutical delivery[J].Current Opinion in Colloid & Interface Science, 2009, 14(1): 3-15.
[8]McCLEMENTS D J.Edible nanoemulsions: fabrication, properties,and functional performance[J].Soft Matter, 2011, 7(6): 2297-2316.
[9]WANG Pan, LIU Haijie, MEI Xueying, et al.Preliminary study into the factors modulating β-carotene micelle formation in dispersions using an in vitro digestion model[J].Food Hydrocolloids, 2012, 26(2):427-433.
[10]SALVIA-TRUJILLO L, QIAN Cheng, MARTIN-BELLOSO O,et al.Influence of particle size on lipid digestion and β-carotene bioaccessibility in emulsions and nanoemulsions[J].Food Chemistry,2013, 141: 1472-1480.
[11]YI Jiang, LI Yue, ZHONG Fang, et al.The physicochemical stability and in vitro bioaccessibility of beta-carotene in oil-in-water sodium caseinate emulsions[J].Food Hydrocolloids, 2014, 35: 19-27.
[12]SALVIA-TRUJILLO L, QIAN Cheng, MARTIN-BELLOSO O, et al.Modulating β-carotene bioaccessibility by controlling oil composition and concentration in edible nanoemulsions[J].Food Chemistry, 2013,139(1/4): 878-884.
[13]McCLEMENTS D J, DECKER E A, PARK Y.Controlling lipid bioavailability through physicochemical and structural approaches[J].Critical Reviews in Food Science and Nutrition, 2009, 49(1): 48-67.
[14]KNOCKAERT G, LEMMENS L, BUGGENHOUT V S, et al.Changes in β-carotene bioaccessibility and concentration during processing of carrot puree[J].Food Chemistry, 2012, 133(1): 60-67.
[15]LIU Yuwei, HOU Zhanqun, LEI Fei, et al.Investigation into the bioaccessibility and microstructure changes of β-carotene emulsions during in vitro digestion[J].Innovative Food Science & Emerging Technologies, 2012, 15: 86-95.
[16]VERRIJSSEN T, CARDINAELS R, MOLDENAERS P, et al.The effect of soluble fibers in emulsions on the carotenoid bioaccessibility[C]//InsideFood Symposium, Leuven, Belgium, April, 2013: 9-12.
[17]BENGTSSON A, ALMINGER M L, SVANBERG U.in vitro bioaccessibility of β-carotene from heat-processed orange-fleshed sweet potato[J].Journal of Agricultural and Food Chemistry, 2009,57(20): 9693-9698.
[18]SCHWEIGGERT R M, MEZGER D, SCHIMPF F, et al.Influence of chromoplast morphology on carotenoid bioaccessibility of carrot,mango, papaya, and tomato[J].Food Chemistry, 2012, 135(4):2736-2742.
[19]杨蓉生, 刀筱芳, 杨发龙.用图像处理软件PhotoShop进行显微测量[J].实验室研究与探索, 2007, 26(3): 56-57.
[20]AMYOONY J.The influence of guar gum on lipid emulsion digestion and beta-carotene bioaccessibility[D].Guelph: University of Guelph,2014: 39-40; 48.
[21]DICKINSON E.Hydrocolloids at interfaces and the influence on the properties of dispersed systems[J].Food Hydrocolloids, 2003, 17(1):25-39.
[22]袁媛, 毛立科, 高彦祥.Tween系列乳化剂对β-胡萝卜素纳米乳液粒径及稳定性的影响[J].食品科学, 2008, 29(5): 181-186.
[23]HOMERO-MÉNDEZ D, MINGUEZ-MOSQUERA M I.Bioaccessibility of carotenes from carrots: effect of cooking and addition of oil[J].Innovative Food Science & Emerging Technologies,2007, 8(3): 407-412.
[24]SVELANDER C.in vitro bioaccessibility of carotenes: influence of microstructure in tomato and carrot as modified by processing[D].Gothenburg: Chalmers University of Technology, 2011: 47.
[25]PALAFOX-CARLOS H, AYALA-ZAVALA J F, GONZALEZAGUILAR G A.The role of dietary fiber in the bioaccessibility and bioavailability of fruit and vegetable antioxidants[J].Journal of Food Science, 2011, 76(1): R6-R15.

