长双歧杆菌BBMN68微胶囊的制备及其应用性评价
杨剀舟,刘 云,杨立芳,冷小京*
(中国农业大学食品科学与营养工程学院,北京 100083)
双歧杆菌作为益生菌的一种,原产于人体肠道内,对人体具有重要的生理和保健功能[1]。双歧杆菌是生长在pH 4.5~8.5之间严格厌氧的革兰氏阳性细菌,在生产加工处理和通过胃肠道的过程中,会造成菌体数量的大量减少。双歧杆菌必须保证一定的摄入量才能在人体肠道中定殖并发挥其功能,瑞士和国际乳联标准化委员会规定益生菌产品中双歧杆菌的活菌数要大于106CFU/g或106CFU/mL[2]。因此,为双歧杆菌提供有效的物理屏障保护以抵御不利环境是十分必要的[3-4]。
微胶囊包埋技术作为一种新型多壁材物理包埋技术,在双歧杆菌加工和贮藏过程中能够有效提高其生存能力和稳定性[5-7],同时可实现其在胃肠道中的精准缓释[8]。挤压法因其制备过程温和、对活性芯材损伤小、制作简单、成本较低等特点,被广泛应用[9]。
海藻酸钠作为一种天然多糖,因其良好的水溶性和生物相容性以及无毒等特性广泛应用于微胶囊技术中,海藻酸盐聚合物的凝胶化是通过古洛糖醛酸的羧酸根阴离子与钙离子之间的交联形成的[10]。然而,海藻酸钠在高酸性和氧气环境下不能有效地保护双歧杆菌,因此需要选择适当的壁材与其进行复合。乳清分离蛋白与海藻酸钠复配作为双歧杆菌微胶囊壁材,当pH值低于乳清蛋白的等电点时,乳清蛋白的静电荷为正,与带负电荷的海藻酸钠多糖产生静电相互作用,从而形成牢固的微胶囊膜结构,可对双歧杆菌提供一定程度的保护作用[11-12]。
长双歧杆菌BBMN68筛选于广西巴马长寿老人的粪便,为了最大程度解决其对氧气和氢离子耐受性差的问题,本研究在以海藻酸钠和乳清蛋白作为壁材的基础上,采用在包埋体系中加入VE以阻隔氢离子,以及在氮气环境中操作以阻隔氧气的方法制备湿微胶囊,同时为了增加微胶囊应用,将上述湿微胶囊制备成冻干微胶囊,对微胶囊包埋保护效果进行评价,以期为双歧杆菌的包埋保护和开发应用奠定基础。
1 材料与方法
1.1 菌种、培养基与材料
长双歧杆菌BBMN68(Bifidobacterium longum BBMN68,中国科学科院微生物研究所菌种保藏中心,保藏号:CGMCC2265),分离自广西巴马长寿老人的粪便。
MRS液体培养基、MRS固体琼脂培养基(包含琼脂15 g/L)、MRS选择性培养基(包含0.3%丙酸钠和0.2%氯化锂[13]) 北京奥博星生物技术有限公司。
海藻酸钠(alginate,AL,食品级) 青岛丽珠海洋化工厂;乳清分离蛋白(whey protein isolate,WPI)、聚甘油蓖麻醇酯(polyglycerol esters of interesterified ricinoleic acid,PGPR,食品级) 美国Davisco公司;VE、胃蛋白酶、胰酶 美国Sigma公司;杯状酸奶 北京三元食品有限公司。
1.2 仪器与设备
PHS-25CW精密酸度计 意大利哈纳科仪公司;BBS-DDC超净工作台 济南鑫贝西生物技术有限公司;UV mini-1240紫外-可见分光光度计 日本Shimadzu公司;HWS-270恒温恒湿培养箱 宁波市科技园区新江南仪器有限公司;LGJ-12真空冷冻干燥机 北京博医康实验仪器有限公司。
1.3 方法
1.3.1 溶液的配制
固化液:配制质量分数3%的CaCl2溶液,用1 mol/L HCl调节pH值为6.5,121℃高压灭菌20 min。
稀释液[14]:Na2HPO4•12H2O 6.0 g、KH2PO44.5 g、吐温-80 1 mL、半胱氨酸盐酸盐0.5 g,加去离子水定容至1 L,搅拌使之充分溶解,加琼脂0.5 g,加热煮沸1~2 min以溶解琼脂,放置至室温,调pH 6.8,分装。121℃高压灭菌20 min。
解囊液[15]:Na2HPO4•12H2O 35.8 g,柠檬酸10.5 g,加去离子水定容至1 L,搅拌使之充分溶解,调pH 7.25,分装。121℃高压灭菌20 min。
模拟胃液[16]:取0.1 mol/L稀HCl溶液16.4 mL,加无菌水约800 mL及胃蛋白酶10 g,搅拌均匀后加无菌水定容至1 000 mL,调节pH值为1.2,过0.22 μm滤膜除菌备用。
模拟肠液[16]:称取KH2PO46.8 g,加无菌水约500 mL搅拌溶解,称取胰酶10 g,加适量无菌水使之溶解,两液混合后,加无菌水定容至1 000 mL,调节pH值为7.4,过0.22 μm滤膜备用。
1.3.2 菌体的培养
将长双歧杆菌B B M N 6 8按0.1%的量接种于10 mL MRS液体培养基中,37℃恒温培养12 h,活化2~3次后,再按0.1%的量接种于250 mL MRS液体培养基中,37℃恒温培养15 h,4 500 r/min离心15 min收获菌体,0.9%生理盐水洗涤,4 500 r/min离心15 min,再洗涤两次即收获菌体。
1.3.3 壁材的制备
分别配制质量分数2%和4%的AL溶液[17-19],室温条件下磁力搅拌2 h后,于4℃环境下静置过夜,以确保完全溶解水合,备用。
配制质量分数6%的WPI溶液[20],室温下磁力搅拌2 h后,于4℃环境下静置过夜,以确保完全溶解水合,次日平衡至室温,用1 mol/L NaOH溶液调节其pH 8.0后,在80℃条件下水浴加热30 min使其充分变性,迅速冷却至室温,得到变性乳清分离蛋白溶液,与4% AL溶液等质量混合均匀。
壁材溶液在沸水浴中加热30 min灭菌,磁力搅拌冷却至室温,备用。
1.3.4 微胶囊的制备
制备5种湿润微胶囊(命名为1~5号),以未包埋的菌体作为对照。具体制备方法如下:
1号:2% AL溶液与菌体混合→搅拌均匀→用2 mL注射器将混合液滴入3% CaCl2溶液中→固化30 min[17]→0.9%生理盐水洗涤3次→1号微胶囊。
2号:6% WPI溶液与4% AL溶液等质量混合→加入菌体混合均匀→用2 mL注射器将混合液滴入3% CaCl2溶液中→固化30 min→0.9%生理盐水洗涤3次→2号微胶囊。
3号:制备方法与2号相同,制备过程中向壁材与芯材混合液中连续充入无菌氮气。
4号:将菌体加入VE油(含8% PGPR)中并快速搅拌→初乳状液(水/油,W/O)→将初乳状液加入6% WPI溶液与4% AL溶液等质量混合液中并快速搅拌→双乳状液(水/油/水,W/O/W)→用2 mL注射器将双乳状液滴入3% CaCl2溶液中→固化30 min→0.9%生理盐水洗涤3次→4号微胶囊[21]。
5号:制备方法与4号相同,制备过程中向壁材与芯材混合液中连续充入无菌氮气。
菌体加入量:微胶囊含活菌数为109~1010CFU/g,双乳状液中内水相-油相-外水相质量比约为10∶10∶100。实验所用溶液、器具等均于121℃高压灭菌20 min,所有操作在超净台内进行。
将上述制备的5种湿润微胶囊于-20℃预冻12 h,然后放入真空冷冻干燥机于-60℃冷冻干燥48 h,得到冻干微胶囊,分装在铝箔纸中,抽真空密封包装,存放于-20℃备用,分别命名为1’~5’号。
1.3.5 微胶囊包埋活菌计数[22]
称取湿微胶囊样品1 g(冻干微胶囊为0.1 g),置于9 mL解囊液中,37℃、150 r/min振荡溶解,待其完全溶解后,梯度稀释,选取合适的稀释度(使活菌数在30~300 CFU/g范围内),采用亨盖特计数法进行滚管计数。
1.3.6 微胶囊包埋率测定
称取湿微胶囊样品1 g,分散于50 mL稀释液中,37℃恒温水浴振荡,处理30 min。取稀释液活菌计数,按照公式(1)计算微胶囊包埋率。

式中:C1为所测稀释液中的活菌数/(CFU/g);C0为起始添加的活菌数/(CFU/g)。
1.3.7 微胶囊在酸奶中的稳定性测定
将湿润微胶囊约1 g加入市售杯状酸奶中,密封,4℃冰箱放置。分别在0、2、5、10、15、21 d取出一杯,用0.9%生理盐水冲洗微胶囊,准确称取1 g,进行双歧杆菌选择性计数,检测存活菌数。同时以加入109~1010CFU/g未包埋菌体的酸奶作对照。
1.3.8 贮藏加速实验[23]
经典恒温加速实验的理论依据是Arrhenius指数定律,式(2)为Arrhenius方程。

式中:k为失活速率常数/min;k0为前因子(又称频率因子)/min;Ea为表观活化能/(J/mol);T为绝对温度/K;R为气体常数(8.314 4 J/(mol•K))。
将公式(2)取对数,即得到公式(3)。

准确称取冻干胶囊0.1 g,分装在铂纸袋中,抽真空密封包装。放置于60、55、50、45℃恒温恒湿培养箱中,分别在0、1、2、3、4 h取出一袋,进行活菌计数。记测得的活菌数为C1,初始微胶囊中活菌数为C0。求出各温度条件下保存不同时间后的相对活性Cr(Cr=C1/C0)。以lgCr对时间t进行回归分析,得出各温度条件下微胶囊的失活速率常数k,将lnk对1/T×103进行回归分析,得到Arrhenius方程。根据Arrhenius方程可以求出室温25℃(T=298.15 K)时的失活速率常数k25℃,假设双歧杆菌数量由108CFU/g 降低到106CFU/g,即lgCr=lg(C/C0)=-2,根据t=lgCr/k25℃,求出25℃条件下微胶囊的贮藏时间/h。
1.3.9 耐胃酸实验
称取湿微胶囊样品l g(冻干微胶囊加入量为0.1 g),置于9 mL模拟胃液中,于37℃恒温贮藏,分别于0、l、2 h后取出1 管,用0.9%生理盐水冲洗,进行活菌计数。同时以109~1010CFU/g未包埋菌体加入模拟胃液作对照。
1.3.10 肠道释放性实验
称取湿微胶囊样品l g(冻干微胶囊加入量为0.1 g),置于9 mL模拟肠液中,于37℃、150 r/min振荡培养。分别于0、1、2、3、4、5、6 h取出1 管,直接吸取模拟肠液,测定其在600 nm波长处的吸光度。
2 结果与分析
2.1 微胶囊形态及粒径

图1 不同湿微胶囊成型效果Fig.1 Wet microcapsules
如图1所示,5种湿微胶囊成型效果好,呈均匀球形。1号微胶囊为亮白色,微透明。2号和3号微胶囊由于加了乳清蛋白而呈乳白色,透明度比1号差。4号和5号微胶囊由于加了VE,颜色为米黄色,不透明。2号和3号、4号和5号只是制备环境不同,形态相差不大。用数显千分尺测量微胶囊颗粒的直径,5种微胶囊粒径分布均匀,差别不大,大约为2.4 mm。

图2 冻干微胶囊成型效果Fig.2 Freeze-dried microcapsules
如图2所示,湿微胶囊冻干后仍为球体,表面粗糙不平滑。冻干后微胶囊粒径减小,其中1’号冻干微胶囊的粒径减少最为明显,这是由于单纯海藻酸钠作为壁材微胶囊具有多孔性,强度不够,冻干过程会影响其结构[24];4’、5’号冻干微胶囊粒径约为2.15 mm,比2’、3’号冻干微胶囊大0.25 mm左右,这是由于4’、5’号冻干微胶囊双乳化体系中含有油相VE,冻干时不会挥发而留在微胶囊内部,同时对于稳定微胶囊的空间结构也起到一定作用,因此二者的粒径相对较大。
2.2 微胶囊包埋率
包埋率是评价微胶囊包埋效果的重要指标,如图3所示,5种微胶囊的包埋率均在95%以上,不同壁材组成对微胶囊包埋率的影响不大(P>0.05),这与刘茜等[22]采用2%海藻酸钠包埋干酪乳杆菌的效果一致(包埋率95.80%)。海藻酸钠是生物大分子,当海藻酸钠与钙离子接触形成海藻酸钙时,羧酸根阴离子与钙离子之间交联结合成“蛋盒”式结构,最终形成三维网络状的凝胶[22],在微胶囊表面形成一层致密的保护膜,增加了微胶囊的强度[24],使芯材较多地保留在微胶囊中,所以微胶囊对益生菌的包埋率较高,实验中添加的耐酸耐氧材料如乳清分离蛋白、VE等并未对包埋效果产生显著影响[25]。
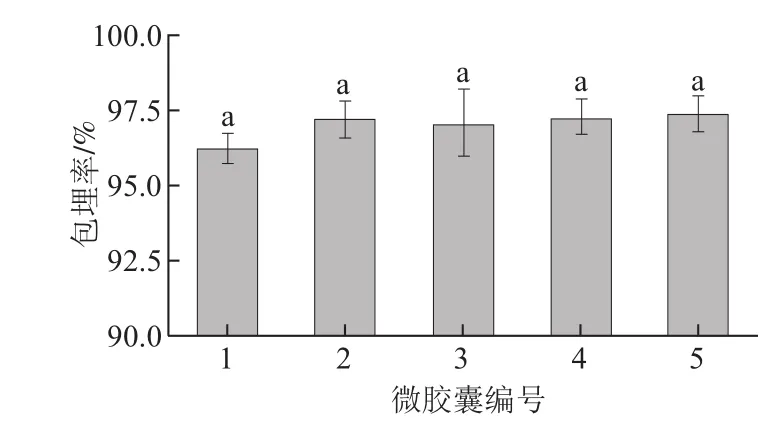
图3 不同微胶囊的包埋率Fig.3 The encapsulation efficiency of microcapsules
2.3 微胶囊在酸奶中的稳定性

图4 贮藏期间微胶囊在酸奶中活菌数的变化Fig.4 Ssurvivability curve of BBMN68 microcapsules in yogurt
由图4可知,将未包埋和经微胶囊包埋的菌体添加到酸奶中,在酸奶的保质期(4℃,21 d)内,活菌数均呈现下降趋势。其中,添加未包埋双歧杆菌的酸奶中在第21天已无活菌检出。相比未包埋菌体,1号微胶囊中活菌数略高,在第21天活菌数下降至103CFU/g以下,2号和3号微胶囊分别约为104CFU/g和105CFU/g,高出1号约两个数量级,4号和5号微胶囊接近107CFU/g ,高于1号4个数量级,这主要是由于1号微胶囊单纯以海藻酸钠为壁材,制备的微胶囊中钙离子会与酸奶中乳酸菌发酵生成的乳酸、醋酸等物质螯合,从而破坏海藻酸钙壁材的稳定性,使氢离子进入微胶囊内部,造成双歧杆菌的急剧死亡[26];2号和3号微胶囊采用乳清蛋白和海藻酸钠复合作为壁材,在酸奶pH 4.5的条件下,乳清蛋白带正电荷,海藻酸钠带负电荷,乳清蛋白与海藻酸钠可以以静电相互作用结合形成紧密的壁材,从而抵消钙离子被酸根螯合所带来的负面影响,仍可起到较好的保护作用[11-12],其中3号微胶囊的包埋率略高于2号,可能与制备过程采用氮气环境,使微胶囊内部残留空气较少有关;4号和5号微胶囊先采用VE对双歧杆菌进行保护,然后再采用双乳化技术对芯材进行包埋,VE可以实现对氧气和氢离子的双重隔绝,显著提高双歧杆菌的存活率,并且VE的保护效果要明显优于氮气环境。此外,4号和5号微胶囊在酸奶保质期内,活菌数保持在106CFU/g以上,符合GB/T 21732—2008《含乳饮料》[27]的规定,同时两者活菌数并无显著差异,为了简化制备工艺,可采用4号微胶囊添加至酸奶中。市场上酸奶饮品中乳酸菌的添加形式多为菌体的直接添加,在酸奶中直接添加长双歧杆菌BBMN68时,在保质期内活菌数下降较快,经微胶囊包埋可以提高其存活效果,并增强了其应用效果。
2.4 贮藏加速实验结果
由于1’号微胶囊经过冻干后每克微胶囊的活菌数小于106CFU,而其他冻干微胶囊活菌数均达到108CFU以上,因此只对2’、3’、4’和5’号冻干微胶囊进行贮藏加速实验。
由贮藏加速实验得到的数据计算冻干微胶囊在不同温度下的失活常数k,将lnk对1/T×103进行回归分析可以到斜率和截距,如图5所示,得到Arrhenius方程列于表1。

图5 lnk对1/T×103进行回归分析Fig.5 Regression analysis of lnk against 1/T × 103
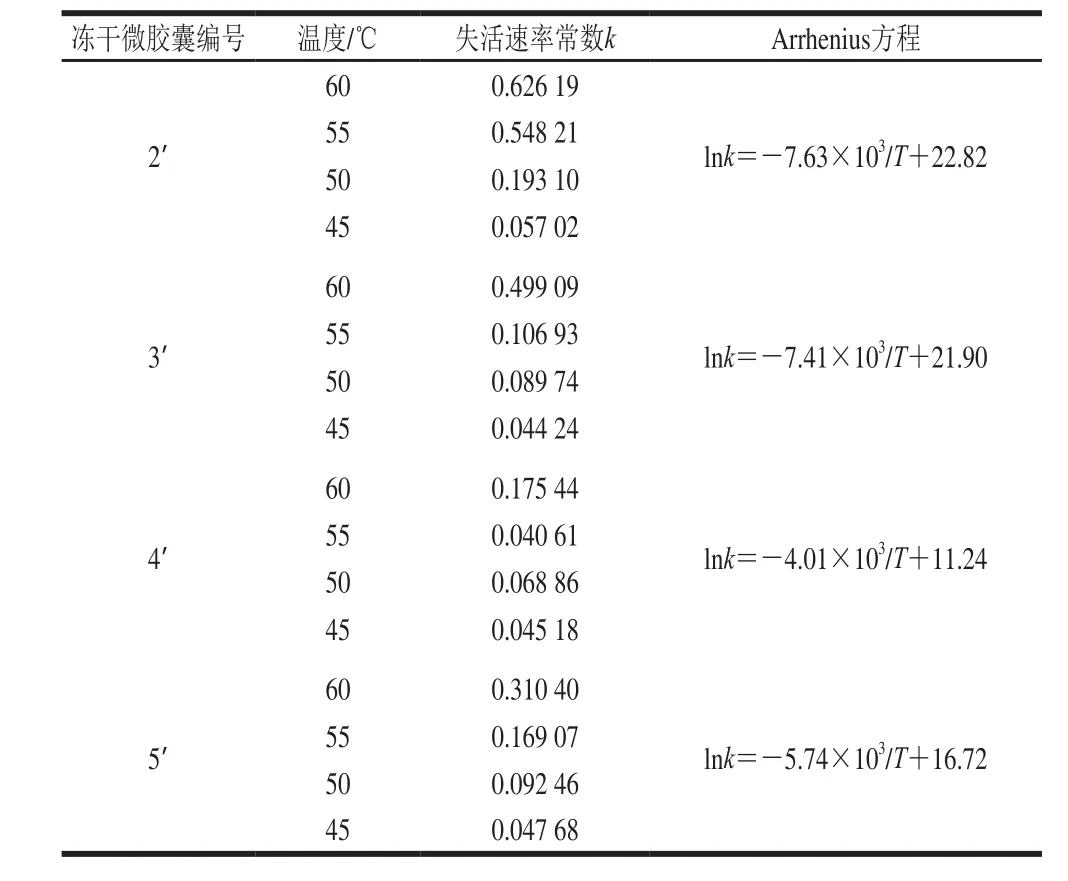
表1 冻干微胶囊在不同温度条件下的失活速率常数Table1 Deactivation constants of freeze-dried microcapsules at different temperatures
4种冻干微胶囊的贮藏时间如表2所示,3’号冻干微胶囊贮藏期最长,为75 d,4’号冻干微胶囊贮藏期最短,仅为14 d。这里得到了与湿微胶囊相反的结果,氮气环境下制备的微胶囊冻干后的理论贮藏期要明显优于加入VE制备的微胶囊冻干后的理论贮藏期。这主要是由于冻干微胶囊中的双歧杆菌在贮藏期内遵循细菌饥饿存活原理[28],即双歧杆菌在干燥形式下长期处于饥饿状态时,可进入一种不能生长繁殖,但仍然存活的特殊存在形式,使菌体不仅能忍受饥饿的环境,对外界不利因素的抵抗力也增强,同时采用微胶囊化技术可以使双歧杆菌表面包上一层保护膜,令其与外界环境隔离,增强了对外界不利环境的抵抗力,因此双歧杆菌在干燥状态下仍然可以存活。然而含有VE的微胶囊在冻干过程中,油相VE阻止了内水相中水分的挥发,导致冻干后微胶囊中水分含量依然很高,处于饥饿存活状态下的双歧杆菌在高水分活度环境中开始复苏并进行代谢活动,从而加速了双歧杆菌的脱水死亡[29-30],使得双歧杆菌含量下降。

表2 室温25℃条件下冻干微胶囊的贮藏期Table2 Storage life of freeze-dried microcapsules at 25℃
由贮藏加速实验可知,3’号冻干胶囊贮藏期最长,因此选用3’号冻干微胶囊进行后续的耐胃酸和肠溶实验评价。
2.5 模拟胃肠实验
为了解双歧杆菌微胶囊在实际人体应用中的效果,采用模拟胃肠实验对上述5种湿润微胶囊和3’号冻干微胶囊进行评价。
2.5.1 耐胃酸实验结果

图6 微胶囊和菌体在模拟胃液中活菌数的变化Fig.6 Survivability curves of encapsuled and non-encapsuled BBMN68 in simulated gastric juice
如图6所示,随着处理时间的延长,菌体在模拟胃液中的存活数逐渐降低。经过模拟胃液处理2.0 h后,未包埋菌体全部死亡,表明了高浓度的氢离子对于双歧杆菌具有强烈的破坏性。1号微胶囊由于采用单纯海藻酸钠为壁材,耐胃酸能力有限,在模拟胃液中处理2 h后,活菌数下降至105CFU/g。2~5号微胶囊在模拟胃液中处理2.0 h后活菌数仍达到107CFU/g,然而在处理前期1.0 h时,4号和5号微胶囊的活菌数要比2号和3号微胶囊高出将近1个数量级,这是由于处理前期进入外水相的氢离子并未能全部穿透油相VE膜,从而对双歧杆菌起到了较好的保护作用,而随着处理时间的延长,穿透过油相VE膜的氢离子逐渐增加,因此活菌数也逐渐下降。食物在胃肠道内的消化时间大约在2 h左右,因此上述2~5号4种微胶囊都能满足良好保护和运载的要求(1号湿微胶囊在酸奶(pH 6.0)中的稳定性实验是为了说明模拟实际产品环境中的保护效果,在8 d左右仍能符合国家乳制品乳酸菌标准;而模拟胃液实验是为了验证在实际人体胃肠系统中的保护效果,在胃液(pH 2.0)中1 h活菌数仍能保持在106CFU/g以上,两者从不同层面说明壁材的保护效果,并提供实际应用参考)。
然而与湿微胶囊相比,冻干后微胶囊(3’号)的耐胃酸能力明显降低,在模拟胃液中处理1 h后活菌数下降了3.5个数量级,2 h后活菌数下降至103CFU/g。
2.5.2 肠道释放性实验结果

图7 在模拟肠液中包埋双歧杆菌的溶出Fig.7 Dissolution of encapsuled BBMN68 in simulated intestinal fluid
由图7可知,5种湿微胶囊在模拟肠液中处理的前1 h,模拟肠液的吸光度迅速上升,1~2 h略有上升,2 h后,吸光度基本稳定,说明大部分湿微胶囊在肠液中2 h即可完全崩解释放双歧杆菌。3’号冻干微胶囊在模拟肠液中处理3 h吸光度达到最大,3 h后,吸光度不再发生明显变化,说明冻干微胶囊在肠液中需要3 h可以完全崩解释放,由于冻干微胶囊在肠溶过程中需经历吸水阶段,所以其完全崩解需要更长的时间。
从结果推论,长双歧杆菌BBMN68微胶囊在模拟肠液中处理3 h后可以完全溶解,具有肠溶效果,大部分双歧杆菌得到释放。
3 结 论
以海藻酸钠和乳清分离蛋白为壁材,添加VE形成乳状液,采用挤压法制备长双歧杆菌BBMN68微胶囊,大大提高了其在酸奶制品中的存活率,同时冻干微胶囊也具有良好的贮存效果。应用于酸奶的湿微胶囊制备工艺为:10% VE、3% WPI和2% AL形成双乳状液;冻干微胶囊的制备工艺为:3% WPI和2% AL在氮气环境中制备。通过上述工艺制备的双歧杆菌微胶囊产品,不仅可以良好地解决实际生产中双歧杆菌在奶制品中的应用问题,提高实际菌体存活率,同时也提供了一种新型有效的补充肠道益生菌的形式,提高了益生菌的应用价值。
[1]吕锡斌, 何腊平, 张汝娇, 等.双歧杆菌生理功能研究进展[J].食品工业科技, 2013, 34(16): 353-358.
[2]SHIN H S, LEE J H, PESTKA J J, et al.Viability of bifidobacteria in commercial dairy products during refrigerated storage[J].Journal of Food Protection, 2000, 63(3): 327-331.
[3]ZOU Qiang, LIU Xiaoming, ZHAO Jianxin, et al.Microencapsulation of Bifidobacterium bifidum F-35 in whey protein-based microcapsules by transglutaminase-induced gelation[J].Journal of Food Science,2012, 77(5): 270-277.
[4]PIMENTEL-GONZÁLEZ D J, CAMPOS-MONTIEL R G, LOBATOCALLEROS C, et al.Encapsulation of Lactobacillus rhamnosus in double emulsion formulated with sweet whey as emulsifier and survival in simulated gastrointestinal conditions[J].Food Research International, 2013, 42(2): 292-297.
[5]KAILASAPATHY K.Survival of free and encapsulated probiotic bacteria and their effect on the sensory properties of yoghurt[J].LWTFood Science and Technology, 2006, 39(10): 1221-1227.
[6]HOMAYOUNI A, AZIZI A, EHSANI M R, et al.Effect of microencapsulation and resistant starch on the probiotic survival and sensory properties of synbiotic ice cream[J].Food Chemistry, 2008,111(1): 50-55.
[7]BRINQUES G B, ZÁCHIA AYUB M A.Effect of microencapsulation on survival of Lactobacillus plantarum in simulated gastrointestinal conditions, refrigeration, and yogurt[J].Journal of Food Engineering,2011, 103(2): 123-128.
[8]SUN Wenrong, GRIFFITHS M W.Survival of bifidobacteria in yogurt and simulated gastric juice following immobilization in gellan-xanthan beads[J].International Journal of Food Microbiology, 2000, 61(1): 17-25.
[9]LISERRE A M, RE M I, FRANCO B.Microencapsulation of Bifidobacterium animalis subsp.lactis in modified alginate-chitosan beads and evaluation of survival in simulated gastrointestinal conditions[J].Food Biotechnology, 2007, 21(1): 1-16.
[10]LEE J S, CHA D S, PARK H J.Survival of freeze-dried Lactobacillus bulgaricus KFRI 673 in chitosan-coated calcium alginate microparticles[J].Journal of Agricultural and Food Chemistry, 2004,52(24): 7300-7305.
[11]HARNSILAWAT T, PONGSAWATMANIT R, MCCLEMENTS D J.Characterization of β-lactoglobulin-sodium alginate interactions in aqueous solutions: a calorimetry, light scattering, electrophoretic mobility and solubility study[J].Food Hydrocolloids, 2006, 20(5):577-585.
[12]GUÉRIN D, VUILLEMARD J C, SUBIRADE M.Protection of bifidobacteria encapsulated in polysaccharide-protein gel beads against gastric juice and bile[J].Journal of Food Protection, 2003, 66(11):2076-2084.
[13]CASTEELE S V, VANHEUVERZWIJN T, RUYSSEN T, et al.Evaluation of culture media for selective enumeration of probiotic strains of lactobacilli and bifidobacteria in combination with yoghurt or cheese starters[J].International Dairy Journal, 2006,16(12): 1470-1476.
[14]孟祥晨.双歧杆菌生理功能特性及其应用的研究[D].哈尔滨: 东北农业大学, 2002: 21.
[15]LEFÈVRE T, SUBIRADE M.Molecular differences in the formation and structure of fine-stranded and particulate β-lactoglobulin gels[J].Biopolymers, 2000, 54(7): 578-586.
[16]李宁.双歧杆菌微胶囊制备工艺及功能特性的研究[D].保定: 河北农业大学, 2007: 14.
[17]CHANDRAMOULI V, KAILASAPATHY K, PEIRIS P, et al.An improved method of microencapsulation and its evaluation to protect Lactobacillus spp.in simulated gastric conditions[J].Journal of Microbiological Methods, 2004, 56(1): 27-35.
[18]TSEN J H, HUANG H Y, LIN Y P, et al.Freezing resistance improvement of Lactobacillus reuteri by using cell immobilization[J].Journal of Microbiological Methods, 2007, 70(3): 561-564.
[19]MA Yongsheng, PACAN J C, WANG Qi, et al.Enhanced alginate microspheres as means of oral delivery of bacteriophage for reducing Staphylococcus aureus intestinal carriage[J].Food Hydrocolloids,2012, 26(2): 434-440.
[20]RAJAM R, KARTHIK P, PARTHASARATHI S, et al.Effect of whey protein-alginate wall systems on survival of microencapsulated Lactobacillus plantarum in simulated gastrointestinal conditions[J].Journal of Functional Foods, 2012, 4(4): 891-898.
[21]SHIMA M, MORITA Y, YAMASHITA M, et al.Protection of Lactobacillus acidophilus from the low pH of a model gastric juice by incorporation in a W/O/W emulsion[J].Food Hydrocolloids, 2006,20(8): 1164-1169.
[22]刘茜, 张娟, 陈坚.喷雾冷凝法制备高性能乳酸菌微胶囊[J].应用与环境生物学报, 2012, 18(5): 824-830.
[23]许燕滨, 谢光炎, 杨汝德, 等.双歧杆菌微胶囊热稳定性研究[J].广东工业大学学报, 2001, 18(4): 86-89.
[24]吕利军, 季海峰, 张董燕.植物乳杆菌微胶囊化的研究[J].中国畜牧兽医, 2008, 35(12): 20-23.
[25]SU Ran, ZHU Xiaoli, FAN Daidi, et al.Encapsulation of probiotic Bifidobacterium longum BIOMA 5920 with alginate-human-like collagen and evaluation of survival in simulated gastrointestinal conditions[J].International Journal of Biological Macromolecules,2011, 49(5): 979-984.
[26]刘瑛华, 赵进宝, 吕秀芳.微胶囊包埋技术在益生菌制品中的应用[J].食品与机械, 2004, 20(2): 58-60.
[27]GB/T 21732—2008 含乳饮料[S].
[28]OLIVER J D.The viable but nonculturable state in bacteria[J].Journal of Microbiology, 2005, 43(1): 93-100.
[29]NYSTROM T, FLÄRDH K, KJELLEBERG S.Responses to multiplenutrient starvation in marine Vibrio sp.strain CCUG 15956[J].Journal of Bacteriology, 1990, 172(12): 7085-7097.
[30]阳晖.肠溶性嗜酸乳杆菌微胶囊制备方法及特性研究[D].杨凌: 西北农林科技大学, 2006: 46.

