表皮生长因子膜对皮肤切口愈合的影响研究
赵 丽 梁晓龙 李 创 牛家慧 张彩乔
瘢痕是创伤愈合的一种产物,其形成是组织损伤修复的一个正常过程。多年来人们一直在探寻一条能快速恢复组织原有的结构和功能,减少瘢痕形成的途径。研究表明,表皮生长因子(epidermal growth factor,EGF)对伤口愈合具有促进作用,而其中的透明质酸(hyaluronic acid,HA)含量的提高可使瘢痕形成减少。为此,本研究根据EGF理化性质,做成表皮生长因子膜,旨在探讨外源性EGF的应用在伤口愈合中所起的作用、EGF膜促进皮肤切口的愈合以及减少瘢痕的作用机制,为获取临床抑制瘢痕的新思路提供依据。
1 材料与方法
1.1 实验动物
选取由河北医科大学实验动物中心供给的36只4月龄雄性健康的SD大鼠(医动字第04057号),体质量为350~400 g,采用随机分组法将其分为治疗组和对照组,每组18只,分别在同一环境、同一食物分笼饲养,自由饮食。
1.2 仪器与试剂
MDF-382型超低温冰箱(日本三洋公司);OLYMPUS AX-60型多功能照相显微镜(日本);表皮生长因子(上海大江股份有限公司生物制药公司)。
1.3 表皮生长因子膜的制备
分析天平称量表皮生长因子、聚乙烯醇。采用无菌生理盐水在超净实验台内,制取聚乙烯醇溶液,完全溶解后置入表皮生长因子,玻璃棒搅拌成均匀凝胶,平铺于玻璃板上,低温干燥箱干燥后制备成表皮生长因子膜,切割成长5.5 cm×1.0 cm的膜,移入无菌储槽备用,同样制备聚乙烯醇空白膜。
1.4 样本收集方法
对两组大鼠背部剪毛,脱毛。第2 d腹腔注射2%戊巴比妥钠4~5 mg/100 g,有效麻醉后,消毒铺无菌巾,以大鼠背部脊柱正中为中心旁开1 cm处,两侧各预备一条长约5 cm的纵切口,深达肌层,缝合。治疗组伤口用无菌生理盐水浸湿表皮生长因子膜外敷,对照组伤口用无菌生理盐水浸湿聚乙烯醇空白膜外敷,包扎;两组均每日换膜1次,共14 d,分别于术后3 d、5 d、7 d、9 d、14 d及21 d时随机各取3只实验动物,6个切口,以切口为中轴分别取距切口两侧0.5 cm的标本,标本包含全层皮肤及皮下组织,制取后断颈方法处死大鼠。全层皮肤标本用10%甲醛溶液固定备组织学检查。
1.5 光学显微镜观察
经10%甲醛固定的标本,石蜡包埋,制备成6 μm切片,采用常规苏木精-伊红(hematoxylin eosin,HE)染色法染色,使用光学显微镜观察。
1.6 HA免疫组化染色
石蜡切片常规脱蜡至水,3%H2O2室温下孵育5~10 min,以消除内源性过氧化物酶的活性。蒸馏水冲洗,磷酸盐缓冲液(phosphate buffer solution,PBS)浸泡5 min,0.1 mol枸橼酸缓冲液(pH值6.0)行抗原修复,温度保持在98 ℃,20 min。滴加按1∶75比例稀释的透明质酸结合蛋白(hyaluronate binding protein,HABP)在4 ℃条件下孵育过夜。使用PBS冲洗3次,每次5 min。标本滴加1∶1000稀释的辣根过氧化物酶标记的链霉卵白素(PBS稀释),置于37 ℃温箱湿盒内孵育30 min后用PBS冲洗3次,每次5 min。滴加DAB显色剂显色5 min。自来水充分冲洗,苏木精复染细胞核,常规脱水后封片,进行组织学观察。阴性对照不加抗体,其余步骤同上。
结果判定标准:强阳性(棕黄色);阳性(黄色);弱阳性(浅黄色);阴性(不显色)。采用平均阳性染色面积百分比(average positive staining area percentage,APSAP)法,光学显微镜下按等距抽样原则每张切片随机挑选10个视野,以阳性面积为测量指标。
1.7 统计学方法
采用SPSS 16.0统计软件对各组阳性面积率进行单因素方差分析和多个样本均数的比较,两组比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 大体观察
术后第3 d对照组部分伤口有血迹,结痂,创周红肿;治疗组伤口清洁,渗出少,表皮愈合倾向明显。术后第5 d对照组伤口缝线处反应较重;治疗组伤口清洁,渗出少,表皮愈合倾向明显。术后第7 d对照组可见少许伤口处仍有血痂,较重缝线反应;治疗组伤口愈合良好,表面清洁干净,部分缝线脱落。术后第9 d、14 d及21 d对照组伤口愈合良好,肉眼可见明显的愈合线;治疗组伤口愈合情况良好,未见明显的愈合线。
2.2 HE染色观察
(1)术后第3 d光学显微镜下观察。术后第3 d对照组切口两侧表皮完整性差,可见炎性渗出物及成纤维细胞,真皮层裂隙较大;治疗组表皮层愈合,棘细胞层增生,真皮层少部分愈合,成纤维细胞较多(如图1、图2所示)。
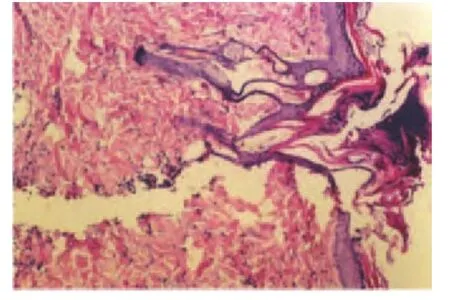
图1 对照组术后第3 d表皮未愈合(×100)
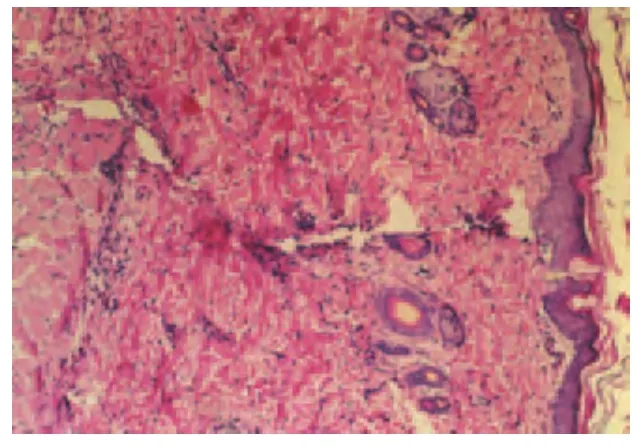
图2 治疗组术后第3 d表皮愈合(×100)
(2)术后第5 d光学显微镜下观察。术后第5 d对照组仍可见裂隙、增生的成纤维细胞,炎细胞浸润,表皮层愈合,角化层形成,棘细胞层增生,真皮少部分愈合;治疗组表皮已经愈合,真皮层基本愈合,可见较多增生的成纤维细胞。术后第7 d治疗组、对照组的表皮层均已愈合,但对照组真皮未完全愈合,成纤维细胞成分层聚集排列;治疗组真皮层基本愈合,成纤维细胞胞体较对照组小,较规则疏松排列。术后第9 d对照组表皮呈凹陷,胶原纤维较粗,按一定方向排列;治疗组表皮较平坦,胶原纤维排列接近正常组织。术后第14 d和21 d对照组角化明显,胶原纤维垂直于切口,致密束状排列;治疗组角化不如对照组明显,表皮层较平接近正常,胶原纤维疏松排列(如图 3、图4所示)。

图3 对照组术后第14 d瘢痕粗大(×100)

图4 治疗组术后第14 d瘢痕纤细(×100)
2.3 HA免疫组化染色观察
(1)术后第3 d光学显微镜下观察。术后第3 d对照组在皮肤表皮层HA染色不显色,真皮层显浅黄色;治疗组表皮层和真皮层染色均显示黄色。
(2)术后第5 d光学显微镜下观察。术后第5 d对照组表皮层HA染色不显色,真皮层呈浅黄色;治疗组表皮层呈浅黄色,真皮层显棕黄色(如图5、图6所示)。
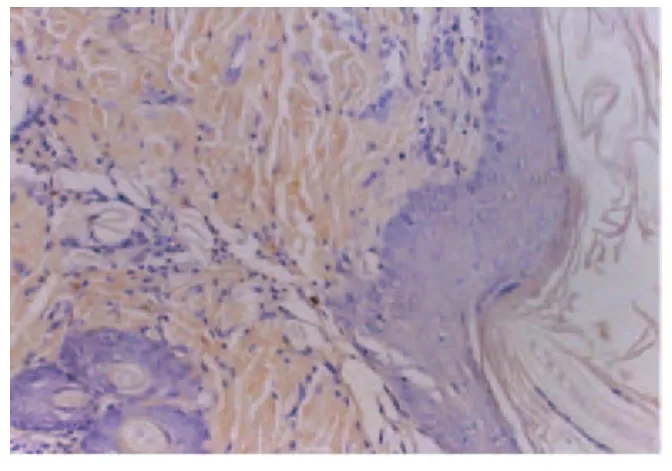
图5 对照组术后第5 d表皮层HA的表达呈阴性真皮层弱阳性(×200)
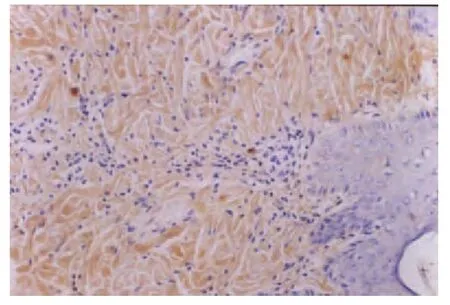
图6 治疗组术后第5 d表皮层HA的表达呈弱阳性真皮层强阳性(×200)
(3)术后第7 d和第9 d对照组表皮层上层HA染色不显色,基底层和真皮染黄色;治疗组表皮层染色由浅黄色转为不显色,真皮层染色为黄色。伤口两侧HA免疫组化染色图像分析结果显示,两组治疗3 d、5 d、7 d和9 d后治疗组中HA的分布面积显著高于对照组,其差异有统计学意义(t=5.8959,t=6.0212,t=6.8839,t=7.3367;P<0.05)(见表1)。
3 讨论
伤口的快速无瘢痕愈合一直是外科医生积极追求的目标,1971年,Burrington[1]首先提出“无瘢痕愈合”概念,认为高浓度的HA是无瘢痕愈合的主要原因,但是文献报道,外用HA的使用具有延迟伤口愈合和减少瘢痕形成的双重作用[2]。而含有HA和EGF的细胞支架则可明显促进多种组织如皮肤、角膜和胃肠道的创伤愈合[3-4]。
EGF是由53个氨基酸残基构成的单链多肽,具有促进细胞的迁移、分裂及合成间质蛋白的能力,从而促进各类受损创面的愈合[5]。研究表明,EGF与EGF受体(EGFR)的结合是其发挥生物学作用的必要条件[6-7]。伤口中外源性EGF的加入可以加速细胞产生透明质酸合成酶2和酶3,有利于表皮层的增殖和细胞分化[8-9]。同时该酶对HA的合成有利[10]。有研究证实,EGF可诱导上皮角化细胞形成3~5倍HA外衣[11]。伤口中迁移的表皮基底细胞表面标志物CD44是HA在表皮基底细胞层的主要受体,HA与CD44结合可以加速基底细胞的迁移、增殖及分化。研究认为,EGF可以加速细胞表面CD44的表达,促进HA在细胞表明的粘附[12]。HA可通过聚集水分制造“离子通道”优先迁移途径,可以延缓生长因子的分解,促进细胞的迁移,从而有利于促进伤口恢复[13]。表皮的再生过程并不仅仅是在基底层一个平面展开,外源性EGF的加入使得单位时间内修复的面积与深度增加,形成明显的修复效应[14]。
在正常成人皮肤可见EGF于外毛根鞘细胞、皮脂腺外层细胞,汗腺细胞轻度表达,表皮基底层呈轻到中度表达,EGF的表达在创伤皮肤初期稍低于正常皮肤表达,创伤第5 d时观测EGF的表达上升[15]。因此,本研究在创伤早期外用EGF膜,以观察其对伤口愈合的影响。本研究采用EGF聚乙烯醇膜,避免了内源性酶对EGF的降解,可以持续的维持创面EGF含量。术后第3 d时,表皮层对照组未愈合而治疗组完全愈合,表明外源性EGF的应用可以快速渗透入组织,提高伤口中EGF的水平,并促进损伤的早期迅速愈合。术后第9 d、14 d及21 d,对照组可见到明显的愈合线,而治疗组的愈合线不明显,表明外源性EGF的应用与无瘢痕愈合密切关联。免疫组化染色结果证实,术后第3 d对照组在皮肤表皮层HA染色阴性,真皮层弱阳性;治疗组表皮层和真皮层染色均显示阳性。术后第5 d对照组表皮层HA染色阴性,真皮层弱阳性;治疗组表皮层弱阳性,真皮层强阳性。术后第7 d和9 d对照组表皮层上层HA染色阴性,基底层和真皮层阳性;治疗组表皮层染色由弱阳性转为阴性,真皮层染色阳性。对照组表皮层HA免疫组化染色在第3 d、5 d、7 d、9 d均为阴性,真皮层染色在第3 d、5 d弱阳性,在第7 d和9 d渐变为阳性;治疗组表皮层HA免疫组化染色在第3 d、5 d、7 d及9 d由阳性逐渐转为弱阳性和阴性,真皮层基本上保持阳性和强阳性。伤口两侧HA免疫组化染色图像分析结果表明,术后不同时间点治疗组HA免疫组化阳性面积率均显著高于对照组。本研究显示,治疗组在表皮层和真皮层HA的表达显著高于对照组,表明EGF膜可释放EGF并促进皮肤合成HA,有利于伤口的快速无瘢痕愈合。

表1 两组SD大鼠术后不同时间点HA免疫组化阳性面积率比较(%)
4 结语
本研究结果证实,创伤早期应用外源性EGF聚乙烯醇膜,可以提高伤口中EGF的浓度,从而促进伤口的迅速愈合;同时EGF还可以刺激创伤组织中HA的合成,而伤口中高浓度的HA可减少组织愈合过程中瘢痕的形成。本次研究未能将聚乙烯醇膜中EGF的含量进行分级比较,故有待在进一步的实验中找到聚乙烯醇膜中EGF的最适浓度,将其为临床应用奠定良好的基础。
[1]Burrington JD.Wound healing in the fetal lamb[J].J Pediatr Surg,1971,6(5):523-528.
[2]Bettinger DA,Mast B,Gore D.Hyaluronic acid impedes reepithelialization of skin graft donor sites[J].J Burn Care Rehabil,1996,17(4):302-304.
[3]Wu Z,Tang Y,Fang H.Decellularized scaffolds containing hyaluronic acid and EGF for promoting the recovery of skin wounds[J].J Mater Sci Mater Med,2015,26(1):5322.
[4]Schultz G,Rotatori DS,Clark W.EGF and TGF-a in wound healing and repair[J].J Cell Biochem,1991,45(4):346-352.
[5]Hom DB,Maisel RH.Angiogenic growth factors:their effects and potential in soft tissue wound healing[J].Ann Otol Rhinol Laryngol,1992,101(4):349-354.
[6]Matsumoto Y1, Kuroyanagi Y.Development of a wound dressing composed of hyaluronic acid sponge containing arginine and epidermal growth factor[J].J Biomater Sci Polym Ed,2010,21(6):715-726.
[7]刘毅,陈璧,胡大海,等.深IIo烧伤创面愈合过程中EGF/EGFR的表达[J].第四军医大学学报,1999,20(5):457-459.
[8]付小兵,孙晓庆,孙同柱,等.表皮细胞生长因子治疗创面出现的干细胞岛现象[J].中华医学杂志,2001,81(12):733-736.
[9]Shimizu N,Ishida D,Yamamoto A,et al.Development of a functional wound dressing composed of hyaluronic acid spongy sheet containing bioactive components:evaluation of wound healing potential in animal tests[J].J Biomater Sci Polym Ed,2014,25(12):1278-1291.
[10]Carpenter G,Cohen S.Epidermal growth factor[J].Ann Rev Biochem,1979,48:193-216.
[11]Pienimaki JP,Rilla K,Fulop C,et al.Epidermal growth factor activates hyaluronan synthase 2 in epidermal keratinocytes and increases pericellular and intracellular hyaluronan[J].J Biol Chem,2001,276(23):20428-20435.
[12]Zhang M,Wang MH,Singh RK,et al.Epidermal growth factor induces CD44 gene expression throug a novel regulatory element in mouse fibroblasts[J].J Biol Chem,1997,272(22):14139-14146
[13]Pasonen-Seppanen S,Karvinen S,Torronen K,et al.EGF upregulates,whereas TGF-beta downregulates, the hyaluronan synthases Has2 and Has3 in organotypic keratinocyte cultures:correlations with epidermal proliferation and differentiation[J].J Invest Dermatol,2003,120(6):1038-1044.
[14]Berry S M,Green MH,Amiel D.Hyaluronan:A potential carrier for growth factors for the healing of ligamentous tissues[J].Wound Rep Reg,1997,5(1):133-115.
[15]Ono I.Roles of cytokines in wound healing processes[J].Nippon Geka Gakkai Zasshi,1999,100:522-528.