尼美舒利对豚鼠心乳头肌动作电位和收缩力的影响
吴建萍 胡 燕 金满文 刘玲华 刘海霞
1.湖北中医药高等专科学校药理教研室,湖北荆州 434020;2.华中科技大学同济医学院药理系,湖北武汉 430030
尼美舒利(Nimesulide,Nim)化学名为4-硝基-2-苯氧基甲磺酰苯胺是磺酰苯胺的衍生物,是一种选择性抑制环氧化酶(COX-2)的非甾体抗炎药,最新的研究表明尼美舒利还有抗氧化、抑制增殖、诱导细胞调亡、抑制血管生成等作用,对肿瘤有一定的预防和治疗作用[1-2]。目前,非甾体抗炎药(NSAIDs)是全球处方量最大的药物之一,在内、外、妇、儿科使用广泛。尼美舒利因其独特的药理作用机制曾被认为是一种有良好发展前景的胃肠道反应少、安全性好的非甾体抗炎药。近期国内外关于COX-2抑制剂引起心血管不良反应的事件时有报道[3-5],但有关COX-2抑制剂对心肌电生理的影响鲜有报道。本研究采用标准玻璃微电极技术、同步记录收缩力的方法,比较分析Nim和吡那地尔(Pinacidil,Pin)对豚鼠心乳头肌收缩力和细胞动作电位的影响。
1 材料与方法
1.1 动物及模型制作
选取华中科技大学同济医学院实验动物学部提供的符合实验标准的普通级健康豚鼠54只(合格证号:00005907),体质量(300±50)g,雌雄不限,室内动物房分笼饲养,统一饲料,自由采食和饮水。实验随机分为6个组:溶剂对照组,即DMSO组(Dimethyl sulphoxide,二甲基亚砜)、Pin 1 μmol/L 组、Pin 10 μmol/L 组,Nim 1 μmol/L 组、Nim 3 μmol/L 组、Nim 10 μmol/L 组,每组均为9只。
1.2 主要试剂和仪器
Tyrode液成分:NaCl 137 mmol/L,CaCl21.8 mmol/L,KCl 5.4 mmol/L,NaHCO311.9 mmol/L,MgCl21.05 mmol/L,葡萄糖溶液 5.5 mmol/L,NaH2PO40.42 mmol/L。pH:7.2~7.4。实验前新鲜配制Tyrode液1000 mL:首先在容器中加入约600 mL的双蒸水,将容器置于磁力搅拌器上持续搅拌。分别称取葡萄糖溶液和NaHCO3各1.0 g,将其陆续加入持续搅拌的容器中。准确量取储存液Ⅰ40 mL、储存液Ⅱ10 mL、储存液Ⅲ10 mL,分别依次缓慢加入容器中,加双蒸水定容至1 L。配成的营养液一般保存24 h。Nim、Pin购于SIGMA公司(纯度≥99%),用DMSO配成储备液,DMSO在浴槽中的终浓度控制在0.1%以内。仪器及设备离体心肌玻璃浴槽装置采用超级恒温器(HSS-1B型)、程控电刺激器(YC2)、WD-1型微电极拉制仪、微电极放大器、输入记录系统 (RM6240C型多道生理信号采集处理系统)为成都仪器厂产品。
1.3 实验方法
豚鼠心室乳头肌标本的制备[6]:将各组的豚鼠击昏致死,经颈总动脉放血后,迅速取出的心脏,置入经95%O2+5%CO2混合气体饱和的Tyrode液中。分离右心室乳头肌,两端用3-0丝线结扎后水平放入1 mL的恒温浴槽中,一端套在张力换能器的小钩上,另一端固定在标本池中的站柱上。温度控制在(37±1)℃,用30mL氧饱和的Tyrode液持续表面灌流,流速4 mL/min。给予标本0.5 g的前负荷,以波宽3 ms,频率1 Hz,110%~150%阈电压的刺激驱动标本,记录乳头肌的收缩力,平衡30 min后进行实验,分别用不同浓度的Nim(1、3、10 μmol/L)和 Pin(1、10 μmol/L)进行灌流其间换液1次。Nim 10 μmol/L组在给药后再用无药Tyrode液进行冲洗,观察APD恢复时间。
动作电位时程 (action potential duration,APD)的记录用有芯毛细管在WD-1型微电极拉制仪进一步拉制成玻璃微电极,电极电阻约为10 MΩ,用3 mol/L的KCl溶液充灌。将充灌好的微电极固定在三维操纵器上,插入铂金丝引导电极。电极入水后调零,缓慢插入电极,直至引出稳定的APD。APD信号经微电极放大器输入记录系统。在引出稳定的APD图形30 min后加药,观察30 min,每5 min记录1次。同时记录各组豚鼠心肌张力及0相最大速度(Vmax)。
1.4 统计学方法
采用SPSS 17.0统计学软件进行数据分析,计量资料数据用均数±标准差(±s)表示,两组间比较采用t检验;计数资料用率表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 Nim、Pin对豚鼠APD和收缩力的影响
Pin 10 μm 组的 APD20、APD50、APD90较 DMSO 组明显降低,差异均有统计学意义(P<0.05);Nim 3 μm组、Nim 10 μm组与DMSO组相比明显降低,差异均有高度统计学意义(P<0.01)。Nim、Pin对豚鼠收缩力和Vmax均无明显变化(P>0.05)。结果提示,Nim 3 μmol/L、Nim 10 μmol/L和Pin 10 μmol/L可显著缩短豚鼠心乳头肌细胞 APD20、APD50、APD90的时间, 而对 Vmax和收缩力均无明显影响。见表1、图1。
2.2 Nim对豚鼠心乳头状肌APD缩短的作用可逆
豚鼠心乳头状肌在给予Nim 10 μmol/L后,用无药的Tyrode液进行了冲洗,冲洗结果显示,APD缩短的各指标经过冲洗120 min后,基本恢复到给药前水平。这表明了Nim对豚鼠心乳头状肌APD缩短的这一作用是可逆的,是可以洗脱的。见图2。
表1 Nim、Pin对豚鼠 APD、收缩力和 Vmax的影响(±s)
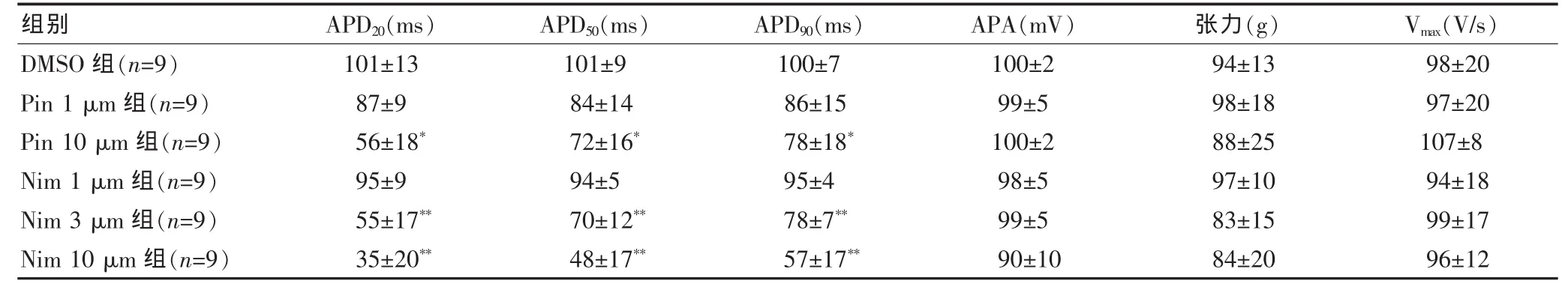
表1 Nim、Pin对豚鼠 APD、收缩力和 Vmax的影响(±s)
注:与 DMSO 组比较,*P<0.05;与 DMSO 组比较,**P<0.01;DMSO:溶液对照;Nim:尼美舒利;Pin:吡那地尔;APD:动作电位时程;APD20:动作电位复极20%;APD50:动作电位复极50%;APD90:动作电位复极90%;APA:动作电位幅度;Vmax:0相最大上升速度
DMSO 组(n=9)Pin 1 μm 组(n=9)Pin 10 μm 组(n=9)Nim 1 μm 组(n=9)Nim 3 μm 组(n=9)Nim 10 μm 组(n=9)101±13 87±9 56±18*95±9 55±17**35±20**101±9 84±14 72±16*94±5 70±12**48±17**100±7 86±15 78±18*95±4 78±7**57±17**100±2 99±5 100±2 98±5 99±5 90±10 94±13 98±18 88±25 97±10 83±15 84±20 98±20 97±20 107±8 94±18 99±17 96±12组别 APD20(ms) APD50(ms) APD90(ms) APA(mV) 张力(g) Vmax(V/s)

图1 Nim、Pin对豚鼠APD和收缩力的影响

图2 无药Tyrode液冲洗后APD的变化
3 讨论
Nim属非甾体抗炎药,据美国食品药品管理局报道[7-8]:针对多种COX-2选择性或非选择性非甾体类抗炎药持续时间达3年的临床试验显示,Nim可能引起严重的不良事件、中风和心肌梗塞的风险增加,且其风险性可能是致命的。所有的非甾体类抗炎药,都可能有相似的风险[9]。其中有心血管疾病危险因素或心血管疾病的患者,会有更大的风险。即使患者既往没有心血管症状,医生和患者也要警惕该类事件的发生发展。医生应告知患者严重心血管安全性的症状、体征以及如果发生应采取的措施、步骤;患者应警惕诸如胸痛、无力、气短、言语含糊等症状和体征,而且当有任何上述症状或体征发生后应立刻寻求医生帮助。
本实验研究了Nim与Pin对豚鼠心乳头肌动作电位和收缩力的影响。结果为Nim 3 μmol/L和Nim 10 μmol/L均显著缩短豚鼠心室肌细胞的 APD20、APD50、APD90,对 APA、Vmax、收缩力均无明显影响。Pin 10 μmol/L 显著缩短豚鼠心室肌细胞的 APD20、APD50、APD90,对APA、Vmax、收缩力均无明显影响并且Nim对豚鼠心乳头肌APD缩短这一作用,可以用无药的Tyrode液洗脱。
心室肌细胞动作电位时程主要取决于2期和3期的复极[10-11],电生理研究表明,心肌APD复极过程主要是K+外流,同时也有Na+和Ca2+的参与[12]。其中2期形成的机制是内向电流与外向电流平衡的结果。内向离子流主要是Ca2+负载的,外向离子流是K+携带的;若2期Ca2+内流被阻断,则2期时程缩短,若K+外流被阻断,则2期时程延长。任何影响细胞内外电流平衡的机制均会使APD发生变化。APD受心肌各种离子流,内向钠钙电流和外向钾电流等综合作用的影响[13-14]。由于APA反应Na+内流的总量,Vmax主要取决于0期激活的Na+通道的数量[15-16]。Nim对Vmax、APA无明显影响,提示Nim对心肌细胞Na+通道无明显作用,其对APD的作用是通过对Ca2+、K+电流的影响实现的。
Nim使豚鼠心乳头肌细胞的APD明显缩短,提示可能具有一定的K+通道开放作用和/或Ca2+通道阻滞作用,且此作用是否与其抑制环氧合酶有关均待进一步研究。
[1]Yang Z,Hollande F,Pialdwin GS,et al.Blockade of long chain fatty acid oxidation by non-steroidal anti-inflammotory drugs may contribute to inhibition of proliferation of human colorectal carcinoma[J].Cancer Let,1998,124(2):187.
[2]Goodin S,Shiff SJ.NSAIDs for the chemoprevention of oral cancer:promise of pessimism[J].Clin Cancer Res,2004,10(3):1561.
[3]Slattery ML,Samowite W,Hoffman M.Aspirin,NSAIDs,and colorectal caner possible involvement in an insulin related pathway[J].Cancer Epidemiol Biomarkers Prev,2004,13(4):538.
[4]王瑞丽,戴静,阮林海,等.COX-2在慢性粒细胞白血病中的表达及其临床意义[J].中外医学研究,2009,7(9):22-23.
[5]Rodriguez-Burford C,Barnes MN,Oelschlager DK,et al.Effects of Nonsteroidal Antil-inflammatory agents(NSAIDs)on ovarian carcinoma cell lines:preclinical evaluation of NSAIDs as chemopreventive agents[J].Clin Cancer Res,2002,8(1):202.
[6]顾希钧,周昕.非甾体类抗炎药物不良反应概述[J].中国临床药学杂志,2005,14(6):388-390.
[7]Bennett JS,Daugherty A,Herrington D.The use of nosteroida anti-inflammatory drugs (NSAIDs).a science advisory from the American Heart Association[J].Circulation,2005,111(13):1713.
[8]Kohli M,Yu J,Seaman C,et al.SMAC/Diablo dependent apoptosis induced by nonsteroidal anti-inflammatory drugs(NSAIDs) in colon cancer cells[J].Proc Natl Acad Sci USA,2004,101(48):16897.
[9]程岚,王芳,周红义,等.阿米洛利对动物心肌动作电位的影响[J].临床心血管病杂志,2004,20(2):101-103.
[10]Ma T,Fan ZZ,He RR.Electrophysiological effects of phytoestrogen genistein on guinea pig papillary muscles[J].Sheng Li Xue Bao,2002,54(1):83-87.
[11]李泱,姚伟星,夏国瑾,等.节基四氢巴马汀对豚鼠心肌动作电位的影响[J].中国中医药科技,2001,8(6):369-370.
[12]Ma T,Fan ZZ,He RR.Electrophysiological effects of phytoestrogen genistein on guinea pig papillary muscles[J].Acta Physiolog,2002,54:83-87.
[13]李明华,赵得华,张贵卿,等.马钱子碱对豚鼠心脏乳头肌动作电位的影响[J].中国药理学通报,1997:13(2):157-159.
[14]Hondeghem LM,Katzung BG.Time and voltage-dependent interactions of antiarrhythmic drugs with cardic sodium channels[J].Biochim Biophys Acta,1997,373-398.
[15]Ma T,Fan ZZ,He RR.Electrophysiological effects of phytoestrogen genistein on guinea pig papillary muscles[J].Sheng Li Xue Bao,2002,54(1):83-87.
[16]Itoigawa M,Takeya K,Ito C,et al.Structure-activity relationship of cardiotonic flavonoids in guinea-pig papillary muscle [J].Journal of Ethnopharmacology,1999,65(3):267-272.

