呕吐毒素生物降解研究进展
■计 成 赵丽红 李笑樱 刘淑静
(中国农业大学动物科技学院动物营养国家重点实验室,北京 100193)
科技的进步推动了人类社会的全面发展,农业、畜牧业的发展使人们在满足物质生活的同时,越来越多地关心畜产品和食品的质量和安全。诸如瘦肉精、三聚氰胺、牛奶黄曲霉毒素M1超标事件的发生,使人们更加警示和关注畜产品安全问题。全球饲料霉菌毒素污染具有普遍性和严重性,随时随地危害畜禽生产和人类食品安全。美国早在2002年已将霉菌毒素列为对人类食物链造成巨大威胁的危险因素,其毒性仅次于二噁英。谷物粮食等作物在田间就会感染霉菌,如果环境温度、湿度适合,在运输、加工、储存过程中霉菌会继续繁殖生长,毒素含量相应会继续增加。饲料霉变给粮食工业和畜牧业造成巨大的经济损失,联合国粮农组织(FAO)估计,全球每年25%的谷物受到霉菌毒素的污染,平均有2%不能食用造成浪费;加之因采食霉变饲料引起的动物中毒、疾病和死亡,造成的危害和损失数据难以统计。
1 呕吐毒素污染概况
谷物饲料易受镰孢菌、头孢霉、漆斑菌和其它一些霉菌污染,所产生的镰孢霉毒素对人类和动物健康有极大的危害[1]。镰孢霉毒素中最重要、数量最多的毒素是单端孢霉烯类毒素(Trichothecenes,TS),该类毒素包括约150种化合物,大致划分为A类、B类等四个亚类。A类单端孢霉烯毒素包括:T-2毒素、HT-2毒素、双乙酸基藨草烯醇(DAS)和镰孢菌酸(NEO);B类单端孢霉烯毒素包括:脱氧瓜萎镰孢菌烯醇(又名呕吐毒素,DON)、雪腐镰孢菌烯醇(NIV)和镰孢菌烯酮-X等[2]。
呕吐毒素对谷物的污染程度居于镰刀菌毒素之首,对动物健康造成巨大威胁。呕吐毒素的化学名称为3α,4β,7α,15-四羟墓蔗草镰孢菌-9-烯-8-酮,分子式为C15H20O6,分子量为296.3,多分布于小麦、大麦、玉米等谷物籽实中[3]。加拿大小麦中呕吐毒素的含量高达8.5 mg/kg,南非玉米呕吐毒素的含量高达160 mg/kg,埃及有50%的谷物中有呕吐毒素,含量为0.07~4.0 mg/kg。中国配合饲料样品中呕吐毒素阳性检出率高达100%,平均含量为0.6 mg/kg。饲料或粮食中DON含量超过1 mg/kg时会对人和动物健康产生危害,因此,美国食品药物管理局规定食品中DON限量标准为1 mg/kg,我国农业部也对动物饲料中DON的限量标准做了规定,其值也不应超过1 mg/kg[4]。课题组2011年对北京市15个代表性养猪场所用饲料原料和全价配合饲料(131份)霉菌毒素污染情况、检出频率和特点进行调研,结果表明:玉米、麸皮、豆粕、DDGS和配合饲料中各类霉菌毒素的检出率都非常高,其中玉米、DDGS和部分全价配合饲料所含毒素超标率很高,而呕吐毒素的超标率最高,玉米呕吐毒素超标率为57.1%,DDGS超标率为88.2%,猪配合饲料呕吐毒素超标率为15.8%[5]。
2 动物呕吐毒素中毒症及毒理作用机制
不同动物对DON的敏感性不同,猪对其最敏感,牛、羊次之,家禽对DON有较高的耐受力。猪DON最明显的中毒特征为:呕吐、拒食、腹痛、腹泻,解剖发现胃肠道炎症、出血等症状,长时间采食DON可延缓猪的生长、降低免疫机能[6]。家禽DON中毒症:采食量和增重下降,解剖发现口腔溃疡,肌胃糜烂,死亡率升高。牛DON中毒表现:体质衰弱,采食量下降,生长缓慢,产奶量降低,受孕率低。据Danicke(2002)[7]报道,猪日粮中DON含量在1 mg/kg、犊牛2 mg/kg、家禽5 mg/kg,即可影响其采食量和增重。猪的日粮中DON含量达2 mg/kg时,24 h后常出现呕吐、腹泻、肌无力,甚至昏迷。DON对人类健康的危害研究已经证明,发霉玉米中的DON对人产生食物中毒性白细胞缺乏症(ATA)。人的中毒症状主要表现为胃部不适,恶心、呕吐、头痛、头晕、腹痛、腹泻等。有资料显示,曾在前苏联、中国及北美等国家和地区爆发过人类食物中毒性白细胞缺乏症病,发病率和死亡率均较高。在我国食管癌、胃癌高发区居民饮食中DON污染率和含量均相当高。国际癌症研究机构(IARC)已将呕吐毒素列为三类致癌物之一。
呕吐毒素的毒性基团是C12,13-环氧基,该毒性基团对生长较快的细胞(胃肠道黏膜细胞、淋巴细胞、脾细胞、胸腺细胞等)有较强的损伤作用,而且还抑制蛋白质的合成。DON的毒理作用机制可总结为:DON在代谢过程中,第9位分子官能团由羟基生成了酯类,再与细胞核糖体结合,通过切断某些肽键和肽链而破坏核糖体功能结构,干扰位于核糖体60S亚基上的肽基转移酶活性中心,最终抑制蛋白质的合成[8]。当DON进入细胞后,强烈地与核糖体结合,并给双链RNA蛋白激酶(PKR)和造血细胞激酶(HcK)转导信号;同时,核糖体的中毒性应激反应使p38和细胞外调节蛋白激酶(ERK)活性降低,抑癌基因p53和转录因子c-Jun磷酸化被诱导,进一步使丝裂原活化蛋白激酶(MAPK)磷酸化,激活体内MAPKs信号通路,从而引起机体各种生理反应[9]。其信号传导的具体机制尚不很清楚,两种假说,一种可能是由蛋白质介导的,一种可能是由于DON损害了28S rRNA基因造成的。
真核生物体内MAPKs链是信号传递网络中的重要途径,在将细胞外刺激信号转导至细胞及其核内,并引起细胞生物学反应的过程中起到至关重要的作用。目前已发现3条并行的MAPKs信号通路(ERK、JNK/SAPK和p38)参与了DON激活的MAPK过程[10]。当ERK、JNK/SAPK和p38接受上游的级联反应信号后,不仅可以磷酸化胞浆蛋白,而且可以转位进入细胞核,磷酸化一些核内的转录因子(c-fos、c-Jun、Elk-1、c-myc 和ATF-2),使下游一系列致炎细胞因子(IL-1β、IL-6、TNF-α)大量表达[11-12],从而参与细胞增殖与分化的调控。
最近研究表明,DON还可引起线粒体细胞凋亡基因Bax的易位和细胞色素C的释放。DON引起线粒体细胞色素C释放,激活caspase-9凋亡启动分子,再激活caspase-3凋亡作用分子,引起细胞凋亡[13-14]。不仅如此,DON还可使线粒体跨膜能力下降,释放大量的O2-·,导致线粒体膜两侧的离子失去平衡,线粒体外膜发生破裂,以改变线粒体膜通透性转换孔道(PTP)的开闭状态的方式介导细胞凋亡[15]。
3 呕吐毒素解毒、去毒方法
呕吐毒素对畜牧业及人类产生如此严重的危害,因此,如何实现该类毒素的解毒、去毒是畜牧工作者研究的重要课题。迄今为止,已知的去除饲料中呕吐毒素的方法有物理、化学和生物学法。
物理去毒方法包括研磨,密度筛选,使用紫外光、γ-射线照射以及添加霉菌毒素吸附剂等。呕吐毒素能溶于水,将受其污染的谷物湿磨碎后,呕吐毒素会在浸渍液中富集,淀粉中只含有少量毒素。谷物和油料籽实的密度筛选法是根据受污染和不受污染谷物籽实的密度差异,采用浮选法将它们重新分流,从而将二者区分开来的方法,这种方法能够显著降低呕吐毒素的浓度。易感染呕吐毒素的玉米和小麦很适用于这种方法。目前,应用较广的物理去毒方法是霉菌毒素吸附剂法,包括硅藻土、黏土、硅铝酸盐、酵母细胞壁提取物、酯化甘露聚糖、葡甘露聚糖等。但大量试验证实霉菌毒素吸附剂只对饲料中的黄曲霉毒素(AFB)有较好的吸附效果(大约能吸附70%左右的AFB1),而对DON的吸附率不足5%。因此,目前对于饲料DON的去除没有更好的解决方法。
上述诸多物理、化学脱毒方法因其具有不可避免的缺陷,如饲料经化学脱毒处理后营养品质和适口性降低,吸附剂吸附法只对黄曲霉毒素有吸附效果,对其他毒素无效,吸附毒素同时还吸附维生素和矿物元素,因此对养殖者来说都不太适用,没有被广泛应用。生物降解法因其具有高效性、环保性而成为人们关注的热点。
4 呕吐毒素生物降解研究进展
微生物降解是目前对呕吐毒素污染削减研究的重点。有研究表明,DON结构中C12和C13位的环氧结构和C3-OH基团是DON的主要毒性基团,也是生物降解主要研究位点(见图1)。
4.1 开环氧化作用
20世纪70年代,Sato等[16]报道植物中的硫醇类物质对C12和C13位环氧结构具有亲核攻击作用,还原剂破坏环氧结构后生成烯烃,水解后生成两个相邻的-OH基团。Yoshizawa等[17-18]报道,动物肠道中的细菌可以将DON中的C12和C13环氧结构降解为C9和C12形成双键的物质。同时,研究证明牛瘤胃和肠道中的混合微生物可将单端孢霉烯中的环氧结构破坏,但瘤胃和肠道中的纯培养物对DON的环氧结构没有作用,可能是这些细菌严格厌氧,具有复杂的营养需求。Binder等[19]从牛瘤胃的富集培养物中分离到一株可转化DON和其他单端孢霉烯族毒素的厌氧优杆菌属细菌(Eubacterium BBSH797),随后的试验确定了菌株BBSH797降解DON的代谢产物为DOM-1[20]。He等[21]从鸡肠道中分离筛选出微生物可将98%以上的DON在96 h内转化为DOM-1。Eriksen等[6]通过毒性试验研究发现,DOM-1的毒性远远低于DON,为DON的1/55。Yu等[22]采用PCR-DG⁃GE方法从鸡肠道中分离了10株具有将DON转化为DOM-1的菌株。Guan等[23]从褐色大头鲶肠道中分离得到微生物混合物C133,该混合物在完全培养基中将DON转变为DOM-1。Li等[24]通过仔猪饲喂试验发现菌株LS100具有将DON转化为DOM-1的能力,且降解产物DOM-1不会对猪产生负面影响。
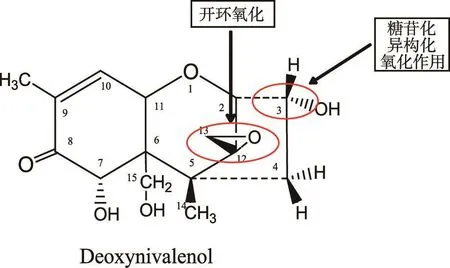
图1 DON推测的作用位点
4.2 3C-糖苷化、异构化和氧化作用
3C-糖苷化作用是微生物产生的糖苷酶或者乙酰基转移酶将葡萄糖基或者乙酰基转移到DON的3号位碳原子上,生成毒性比DON低的降解产物DON-葡糖苷酸或者3-ADON,据推测正是由于乙酰基转移酶的存在,才使镰刀霉可以抵抗自身产生毒素的毒性[25]。Poppenberger等[26]从阿拉伯芥中分离出UDP-葡萄糖基转移酶可以将一分子葡萄糖基转移到DON的3号位碳源子上,得到DON-葡糖苷酸。进一步试验结果表明,DON-葡萄糖苷酸的毒性作用比DON低[27]。Ma等[28]从小麦(Triticum aestivum L.)变种中获得UDP-葡萄糖基转移酶基因片段(TaUGT3),其在大肠杆菌DH10B中成功表达,并发现接种这种大肠杆菌的拟南芥提高了对DON的抵抗能力。Khatibi等[29]将2种3-O-乙酰基转移酶基因片段(FgTRI101和Ff⁃TRRI201)克隆到酵母菌中成功表达,可有效将燃料酒精发酵副产物中的高浓度DON转化为3-ADON,这一研究有一定的商业推广应用价值。
3C-异构化作用使DON形成C-3位差向异构体3-epi-DON,但由于该降解产物中仍存在12,13-环氧化基团,其毒性作用与DON相当。Ikunaga等[30]从小麦地里分离到一株诺卡氏细菌WSN05-2可将DON转化为3-epi-DON和另一种结构还未阐明的降解产物。在含有1 000 μg/ml的DON的基础培养基中接种WSN05-2菌株反应7 d后,DON的转化率可达90%。10 d后两种降解产物均未检测到,DON的骨架结构完全被破坏,这表明3-epi-DON和另一种代谢产物并不是WSN05-2代谢DON的终产物,而只是两种中间产物。
3C-OH氧化作用使DON中的3-OH氧化为毒性比DON低的产物DON 3-酮基。Shima等[31]通过富集培养方法从土壤中筛选得到一株土壤杆菌属的细菌E3-39,该菌在30℃厌氧条件下其胞外提取液可将培养基中200 μg/ml的DON代谢掉,代谢产物中70%为3-酮基-DON。Völkl等[32]从自然界样品中分离出一株具有将DON降解为3-酮基-DON的细菌,该菌在20℃条件下保存6个月仍能保持对DON的降解能力,该菌代谢DON的代谢产物主要为3-酮基-DON。
本课题组已从74个土壤、霉变饲料和动物肠道食糜样品中分离出一株高效降解呕吐毒素的细菌ANSB714,其发酵液(活菌数4.5×109CFU/ml)与初始浓度100 mg/kg的DON反应24 h,降解率为97.34%。通过生理生化和16S rRNA基因序列分析方法鉴定出该菌株为德沃斯氏菌(Devosia sp)。在模拟胃肠道条件下,对霉变小麦和DDGS中DON降解率分别为86.19%和84.34%。通过高效液相色谱-二级质谱联用测定DON降解产物的分子结构,推测菌株德沃斯氏菌ANSB714降解DON的作用机制,是DON分子上的C3-OH基团被氧化为酮基的途径。降解DON的德沃斯氏菌ANSB714毒理学和安全性评价试验结果表明:德沃斯氏菌ANSB714对小鼠经口急性毒性LD50大于40 ml/kg体重,对小鼠精子畸形试验结果为阴性,对小鼠骨髓细胞微核试验结果为阴性。
5 呕吐毒素生物降解研究前景展望
早期报道的能生物降解呕吐毒素的微生物大多都是来源于动物肠道的微生物混合物,混合物没法进行大规模发酵生产。也有降解呕吐毒素单一菌株的报道,但是这些研究都是用菌株和毒素标准品进行的体外试验,没有进一步验证其对饲料呕吐毒素的降解效果,也没有验证其对动物的安全性和有效性,没能解决实际应用问题。尽管一些动物肠道微生物对呕吐毒素有降解作用,但是到目前为止,没有关于呕吐毒素降解酶的研究报道,也没有利用这些微生物或其产生的酶研发饲料添加剂的相关报道。因此,寻找新的高效降解饲料DON的菌株,研究解毒作用机制,通过动物安全性和有效性评价,研究其对动物DON中毒症的缓解和作用效果,是开发DON降解菌饲料添加剂的研究基础。

