超声刀辅助经肛门低位直肠肿瘤局部切除术的临床应用
江淳 王荣土 沈宏伟
超声刀辅助经肛门低位直肠肿瘤局部切除术的临床应用
江淳 王荣土 沈宏伟
传统的开腹手术治疗低位直肠肿瘤风险大、并发症发生率高,且易造成肠道、排尿和性功能的损害;而使用电刀经肛门局部切除术因手术空间小、暴露差、易出血,难以获得全肠壁切除,肿瘤切缘阳性率和术后复发率较高。超声刀辅助经肛门局部切除术治疗低位直肠良性肿瘤及早期恶性肿瘤的手术范围及创伤小,并发症发生率低,肠道功能恢复快,对早期恶性肿瘤可获得与根治术相似的生存效果,并可显著提高患者的生活质量;对良性肿瘤作局部切除的优势更明显;但目前临床上对局部切除术的安全性、适应证及辅助治疗等观点存在分岐[1-3]。笔者回顾并比较了低位直肠早期恶性肿瘤及良性肿瘤患者行超声刀与电刀辅助经肛门局部切除术的疗效,现将结果报道如下。
1 对象和方法
1.1 对象 2001年1月至2011年12月衢州市第二人民医院普外科采用肿瘤局部切除术治疗低位直肠肿瘤患者77例。所有患者术前均行结肠镜检查排除大肠多发病灶,直肠指检肿块均能推动并作肿块病理活检,所有恶性肿瘤患者均行直肠腔内超声检查。排除标准∶(1)多原发结直肠肿瘤;(2)同时或既往患其他恶性肿瘤;(3)已存在周围淋巴结或远处转移;(4)接受化学或放射治疗(以下简称放、化疗);(5)随访资料不完整。采用电刀辅助经肛门局部切除术组(A组)37例,其中男19例,女18例;年龄45~71(58.3±8.3)岁;肿瘤距肛缘<4cm的30例,≥4cm的7例;肿瘤长径<3cm的33例,≥3cm的4例;良性18例(非肿瘤息肉3例、腺瘤8例、高级别上皮内瘤变6例、间质瘤1例),恶性19例(类癌3例、腺癌16例);病理分期T0 12例,Tis 6例,T1 16例,T2 3例。采用超声刀辅助经肛门局部切除术组(B组)40例,其中男23例,女17例;年龄45~75(57.8±8.3)岁;肿瘤距肛缘<4cm的33例,≥4cm的7例;肿瘤长径<3cm的35例,≥3cm的5例;良性22例(非肿瘤息肉2例、腺瘤9例、高级别上皮内瘤变9例、间质瘤2例),恶性18例(类癌3例、腺癌15例);病理分期T0 13例,Tis 9例,T1 14例,T2 4例。两组患者性别、年龄、肿瘤良恶性、类型、部位、大小及分期的比较差异均无统计学意义(均P>0.05)。
1.2 手术方法 (1)全身麻醉或硬膜外麻醉,若肿瘤位于直肠后壁或两侧壁,取膀胱截石位;若肿瘤位于直肠前壁,取折刀位。(2)充分扩张肛门至5~6指,并维持5min。(3)S形眼镜蛇拉钩将肛管牵开,显露肿瘤。组织钳夹起病变周围的直肠黏膜,或距肿瘤边缘约1~2cm处作上下左右4针缝线牵引。(4)A组在肿瘤基底部黏膜下及四周注射含1∶40万U肾上腺素的0.9%氯化钠溶液,使肿瘤浮起突出并预防出血;B组不作该处理。(5)A组用电刀切开直肠黏膜至浅肌层或全层,如为良性肿瘤,在距肿瘤边缘lcm处切开至肌层表面;大腺瘤、腺瘤局部变硬、广基、术前组织学发现有不典型增生或高度怀疑恶变者则切缘>1cm,且作肠壁全层切除,用可吸收缝线作全层连续缝合;术前证实为癌而肿瘤未侵犯浆膜的病例,切除周围脂肪组织及淋巴结,直至骶前筋膜[4],注意勿损伤前列腺或阴道。B组用超声刀完成(超声刀由美国强生公司生产,工作频率55.5 kHz,刀头振动幅度50~100μm),步骤与A组一致。(6)术中将切除标本送冷冻切片,明确手术切缘与肿瘤基底部病理情况后,决定下一步治疗方案,包括是否扩大切除范围或改为开腹手术。
1.3 后续治疗 手术的切除标本术后病理检查提示A组有8例肿瘤侵至肌层以上,其中2例追加腹会阴联合手术(Miles手术),术后均发现腺癌残留,但无淋巴结转移;B组有11例肿瘤侵至肌层以上,其中3例行Miles手术,1例发现腺癌残留,也无淋巴结转移。其余患者因高龄等因素未再行手术,均予术后辅助放、化疗。
1.4 随访 两组患者术后每3个月复查1次,2年后每6~12个月复查1次;以直肠指检及直肠镜为主要检查手段。
1.5 观察指标 两组患者的手术时间、术中出血量、术后出血率、切缘阳性率及术后复发率。
1.6 统计学处理 采用SPSS 19.0统计软件;计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验。
2 结果
两组患者手术时间、术中出血量、术后出血率、切缘阳性率及术后复发率的比较见表1。
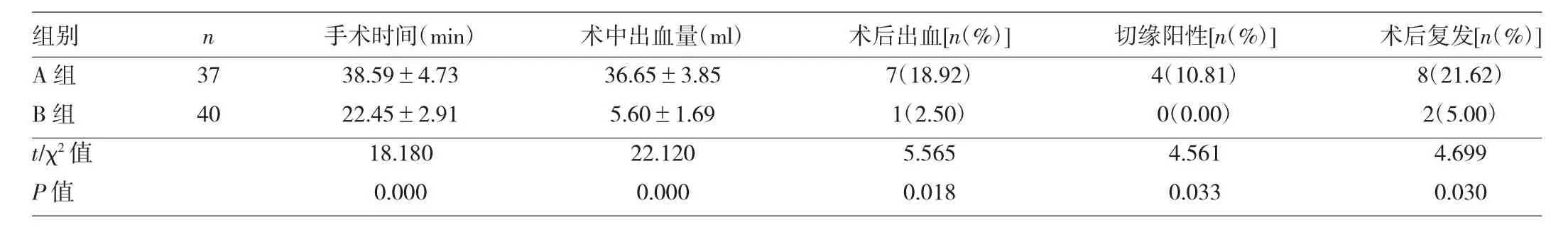
表1 两组患者手术时间、术中出血量、术后出血率、切缘阳性率及术后复发率的比较
由表1可见,B组患者的手术时间、术中出血量均明显少于A组患者,且术后出血率、切缘阳性率及术后复发率均低于A组(均P<0.05)。
3 讨论
对于早期低位直肠肿瘤通常采用的术式有经肛门入路手术、Kraske术、Mason术和腹腔镜手术,但都有适应证受限、操作困难、创伤大、并发症多等问题[5]。因此,既能根治性切除肿瘤又能保留肛门一直是肛肠外科医生努力的方向。Lee等[6]报道局部切除术治疗直肠肿瘤在T1、T2期5年生存率分别为100%和95%,与传统手术比较差异无统计学意义;而一组2 124例早期直肠癌的临床报道则表明局部切除术组术后30d内病死率和并发症发生率显著低于传统手术组[4]。
近年来,超声刀辅助经肛门低位直肠肿瘤切除术的技术得到不断改进,特别是超声内镜和其他诊断技术的联合应用,术前病变的诊断和分期更加清楚,适应证掌握更加准确,其临床应用前景可观。超声刀是将电能转化为机械能,利用使组织内水汽化,蛋白氢键断裂,组织被切开或凝固,同时振动蛋白产生的热量引起周围蛋白凝固,进一步封闭较大血管的原理。超声刀辅助为早期低位直肠肿瘤经肛门局部切除术开辟了一条新的途径。超声刀较电刀的优势在本文资料中得到充分证实,如手术时间、术中出血量、术后出血率、肿瘤切缘阳性率和术后复发率等方面,B组较A组均有显著优势。我们体会到超声刀在经肛门低位直肠肿瘤局部切除术中的优势有:(1)使用简便:因其手柄设计、长度及可旋转的刀头设计适应经肛门手术的狭小空间,特别是在肿物较大、盆腔狭小、操作空间有限的情况下使用更显灵活,从而加快手术完成速度;(2)视野清楚:超声刀可以使直径3 mm以下的血管凝固,使出血减少且没有电刀的烟雾,保持术野清晰;(3)切除完整:超声刀切除范围大可达全层;(4)安全性高:其通过将电能转化为机械能,切割和凝固组织时热损伤较轻,比较安全和微创。
术后复发是影响直肠癌局部切除术临床应用的主要障碍,所以局部切除术要严格把握适应证,但对高龄、全身情况差的患者在充分知情的情况下可适当放宽手术适应证。本研究结果显示,与传统电刀相比,超声刀用于辅助经肛门低位直肠肿瘤切除术的优势更大,但其临床应用和疗效还有待更多的病例和更详实的长期随访资料来进一步证实。
[1]Stamos M J,Murrell Z.Management of early rectal T1 and T2 cancers[J].Clin Cancer Res,2007,13(22):6885-6889.
[2]Nano M,Ferronato M,Solej M,et al.T1 adenocarcinoma of the rectum:transanal excision or radical surgery?[J].Tumori,2006,92 (6):469-473.
[3]Bretagnol F,Rullier E,George B,et al.Local therapy for rectal cancer:still controversial?[J].Dis Colon Rectum,2007,50(4): 523-533.
[4]Lev-Chelouche D,Margel D,Goldman G,et al.Transanal endoscopic micro surgery:experience with 75 rectalneoplasms[J].Dis Colon Rectum,2000,43(5):662-668.
[5]Asencio A F,Uribe Q N,Balciscueta C Z,et al.Transanal endoscopic surgery with conventional laparoscopy materials:is it feasible?[J].Cir Esp,2011,89(2):101-105.
[6]Lee W,Lee D,Choi S,et al.Transanal endoscopic microsurgery and radical surgery for T1 and T2 rectal cancer[J].Surg Endosc, 2003,17(8):1283-1287.
2014-07-16)
(本文编辑:李媚)
324022 衢州市第二人民医院普外科(江淳、王荣土);浙江大学医学院附属第二医院普外科(沈宏伟)
江淳,E-mail:jiangbin8008@163.com

