钙蛋白酶-10基因SNP-19与多囊卵巢综合征相关性研究
邓妙 刘元伟 张红艳 岑加萍 张治芬
●论 著
钙蛋白酶-10基因SNP-19与多囊卵巢综合征相关性研究
邓妙 刘元伟 张红艳 岑加萍 张治芬
目的 探讨钙蛋白酶-10基因(CAPN-10)单核苷酸多态性-19(SNP-19)与多囊卵巢综合征(PCOS)的相关性。方法 采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)技术,对107例PCOS患者(PCOS组)及111例健康体检者(对照组)的CAPN-10 SNP-19进行分析,并测定其性激素和生化指标。PCOS组再根据BMI与胰岛素抵抗(IR)稳态模型指数(HOMA-IR)分为肥胖组与非肥胖组、IR组与非IR组,分析CAPN-10 SNP-19与其关系。结果 与对照组相比,PCOS组BMI、空腹血糖(FPG)、TG、TC、LDL、黄体生成素(LH)、黄体生成素/卵泡刺激素(LH/FSH)、睾酮(T)均升高(均P<0.01)。PCOS组CAPN-10 SNP-19 1等位基因及1/2基因型频率均高于对照组(均P<0.05);且CAPN-10 SNP-19 1/2基因型PCOS发病风险较1/1、2/2基因型增加约2倍(OR=1.9,95%CI=1.1~3.3,P<0.05)。CAPN-10 SNP-19 1、2等位基因频率PCOS肥胖组与非肥胖组、IR组与非IR组比较均无统计学差异(均P>0.05);PCOS肥胖组和IR组CAPN-10 SNP-19 1/2基因型频率分别高于非肥胖组和非IR组,但差异均无统计学意义(均P>0.05)。结论 CAPN-10 SNP-19与PCOS遗传易感性有关,可能与PCOS肥胖及IR无关。
多囊卵巢综合征 半胱氨酸内肽酶类,钙蛋白酶-10 多态性,单核苷酸 胰岛素抵抗
【 Abstract】 Objective To investigate the relationship between single nucleotide polymorphisms-19(SNP-19)in calpain-10 (CAPN-10)gene and polycystic ovary syndrome(PCOS). Methods One hundred and seven PCOS patients(PCOS group)and 111 healthy female subjects(control group)were recruited in the study.The distribution of CAPN-10 SNP-19 was analyzed by polymerase chain reaction-restriction fragment length polymorphism(PCR-RFLP).Serum hormones and biochemical indicators were also measured.Oral glucose tolerance test(OGTT)was performed in PCOS group. Results The BMI,FPG,TG, TC,LDL,LH,LH/FSH and T levels were significantly increased in PCOS group compared to control group(P<0.01).The frequency of allele 1 and genotype 1/2 of CAPN-10 SNP-19 were higher in PCOS group than those in control group.Genotype 1/2 was closely associated with PCOS compared to 1/1 and 2/2(OR=1.9,95%CI=1.1-3.3,P<0.05).There was no significant difference in frequency of genotype 1/2 between obese group and non-obese group,between insulin resistance(IR)group and non-IR group of PCOS patients(P>0.05). Conclusion The SNP-19 in CAPN-10 may contribute to the genetic susceptibility to PCOS,but it may be not correlate with obesity or IR of PCOS patients.
【 Key words】 Polycystic ovary syndrome Cysteine endopeptidases,CAPN-10 Polymorphism,single nucleotide Insulin resistance
多囊卵巢综合征(polycystic ovarian syndrome,PCOS)是女性常见的内分泌疾病,影响女性从青春期到绝经后整个过程的身心健康。其发病机制尚不十分清楚,但大部分研究认为胰岛素抵抗(insulin resistance,IR)是PCOS病理生理的中心环节,约65%的PCOS患者存在IR[1]。钙蛋白酶-10基因(CAPN-10)是第1个被克隆定位的与2型糖尿病(T2DM)有关的基因,该基因的变异与IR的发生密切相关[2]。随后大量研究也证实CAPN-10与多种IR相关性疾病,如妊娠期糖尿病(GDM)、肥胖症、高血压等有关[3-5]。因为PCOS与T2DM、GDM等有共同的IR机制,所以CAPN-10也成为PCOS的重要候选基因。本研究旨在探讨CAPN-10单核苷酸多态性-19(single nucleotide polymorphisms-19,SNP-19)与PCOS的相关性,为PCOS发病的遗传因素、分子机制、临床诊断和基因治疗提供可能的实验依据。
1 对象和方法
1.1 对象 选取2013年1月至2014年1月在杭州市第一人民医院妇科就诊的PCOS患者设为PCOS组;纳入标准:近3个月未服用避孕药或其他影响性激素水平及糖脂代谢的药物;诊断标准参照2003年ESHRE/ASRM鹿特丹会议标准[6]。另以随机数字表法选取同期来本院体检的健康女性设为对照组;纳入标准:月经周期规律,无高雄激素血症及高雄激素表现,经阴道B超检查卵巢无多囊样改变;近3个月未服用避孕药或其他影响性激素水平及糖脂代谢的药物,并排除甲状腺、肾上腺等内分泌疾病。PCOS组共107例,年龄18~34(26.7± 4.8)岁。对照组共111例,年龄21~36(27.1±4.2)岁。两组受检者年龄比较无统计学差异(P>0.05);均于月经第2~4天或PCOS组患者闭经期B超检查未见优势卵泡时,禁食12h后清晨空腹采静脉血进行生化指标(TG、TC、HDL、LDL)、性激素[卵泡刺激素(FSH)、黄体生成素(LH)、雌二醇(E2)、孕酮(P)、催乳素(PRL)、睾酮(T)]测定和基因检测。PCOS组当日行糖耐量试验(OGTT):75g葡萄糖溶于250ml水中,3min内服下,空腹及服糖后2h分别采血测定血糖、胰岛素水平。两组受检者采血当日测量身高、体重,计算BMI、胰岛素抵抗稳态模型指数(HOMA-IR),HOMA-IR=[空腹血糖(FPG,mmol/L)×空腹胰岛素(mIU/L)]/22.5。PCOS组再根据HOMA-IR分为IR组(HOMA-IR≥2.0,76例)和非IR组(HOMA-IR<2.0,31例);根据BMI分为肥胖组(BMI≥25,29例)和非肥胖组(BMI<25,78例)。
1.2 方法
1.2.1 性激素及生化指标测定 性激素测定采用化学发光法(德国西门子ADVIA-centaur XP全自动化学发光免疫分析仪及配套试剂);血糖及血脂测定采用酶法(美国贝克曼-库尔特AU5800全自动生化分析仪及配套试剂);胰岛素测定采用电化学发光法(瑞士罗氏ebol电化学发光免疫分析仪及配套试剂)。
1.2.2 CAPN-10 SNP-19基因型检测 美国AXYGEN DNA提取试剂盒提取外周血有核细胞中的基因组DNA,采用聚合酶链反应-限制性片段长度多态性(PCR-RFLP)检测技术(美国Applied Biosystems-2720 PCR仪)。引物序列:上游引物 5′-GTTTGGTTCTCTTCAGCGTGGAG-3′,下游引物5′-CATGAACCCTGGCAGGGTCTAAG-3′;反应体系:25μl反应体系,1×PCR缓冲液(含Mg2+)12.5μl,2mmol/L dNTPs 2.5μl,5μmol/L上下游引物各1μl,5U/μl Taq酶0.25μl,基因组DNA 2μl,加注射用水至总体积25μl;循环条件:预变性95℃,5min;变性95℃,30s;退火58℃,30s;延伸72℃,30s;终止72℃,10min;共40个循环;PCR产物用3%琼脂糖凝胶电泳80V,60min跑胶;UVP凝胶成像系统拍照存图,在155bp处出现条带为缺失多态(del),等位基因记为1,在187bp处出现条带为插入多态(ins),等位基因记为2。
1.3 统计学处理 采用SPSS19.0统计软件;计量资料以表示,组间比较采用t检验;计数资料组间比较采用χ2检验;检测两组等位基因频率在群体中的代表性采用Hardy-Weinberg平衡检验。
2 结果
2.1 PCOS组与对照组BMI及生化指标比较 见表1。

表1 PCOS组与对照组BMI及生化指标比较
由表1可见,与对照组相比,PCOS组除HDL外BMI、FPG、TG、TC、LDL均升高(均P<0.01)。
2.2 PCOS组与对照组性激素指标比较 见表2。

表2 PCOS组与对照组性激素指标比较
由表2可见,与对照组相比,PCOS组LH、LH/FSH、T均升高(均P<0.01);两组FSH、E2、P、PRL水平均无统计学差异(均P>0.05)。
2.3 PCOS组中肥胖组与非肥胖组血糖、胰岛素水平及HOMA-IR比较 见表3。

表3 PCOS组中肥胖组与非肥胖组血糖、胰岛素水平及HOMA-IR比较
由表3可见,与非肥胖组相比,肥胖组空腹胰岛素、HOMA-IR均显著升高(均P<0.01);两组FPG、服糖后2h血糖、服糖后2h胰岛素水平均无统计学差异(均P>0.05)。
2.4 PCOS组中肥胖组与非肥胖组性激素指标比较 见表4。
由表4可见,与非肥胖组相比,肥胖组LH升高(P<0.05);LH/FSH及T也升高,但差异无统计学意义(均P>0.05);两组FSH、E2、P、PRL水平均无统计学差异(均P>0.05)。
2.5 CAPN-10 SNP-10 3种基因型电泳结果 见图1。

表4 PCOS组中肥胖组与非肥胖组性激素指标比较
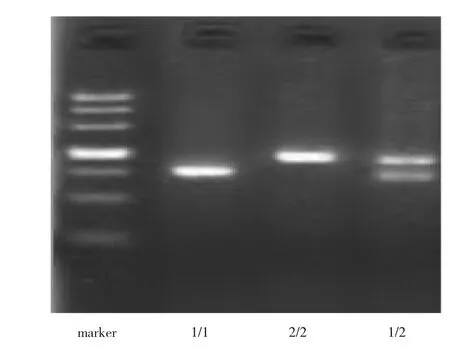
图1 CAPN-10 SNP-19 3种基因型电泳结果(marker:标志物;1/1:155bp片段纯合子;2/2:187bp片段纯合子;1/2:155/187bp片段杂合子)
由图1可见,本研究共检测到CAPN-10 SNP-19 1/1、1/2、2/2这3种基因型。
2.6 PCOS组与对照组CAPN-10 SNP-19等位基因及基因型频率比较 见表5。

表5 PCOS组与对照组CAPN-10 SNP-19等位基因及基因型频率比较[例(%)]
由表5可见,PCOS组CAPN-10 SNP-19 1等位基因、1/2基因型频率均高于对照组(均P<0.05)。且PCOS组、对照组CAPN-10 SNP-19基因型频率均符合Hardy-Weinberg遗传平衡法则(χ2=0.84、1.32,均P>0.05);CAPN-10 SNP-19 1/2基因型PCOS发病风险较1/1、2/2基因型增加约2倍(OR=1.9,95%CI=1.1~3.3,P<0.05)。
2.7 PCOS组中肥胖组与非肥胖组、IR组与非IR组CAPN-10 SNP-19等位基因、基因型频率比较 见表6。

表6 PCOS组中肥胖组与非肥胖组、IR组与非IR组CAPN-10 SNP-19等位基因、基因型频率比较[例(%)]
由表6可见,CAPN-10 SNP-19 1、2等位基因频率在肥胖组与非肥胖组、IR组与非IR组均无统计学差异(均P>0.05);肥胖组和IR组1/2基因型频率分别高于非肥胖组和非IR组,但差异无统计学意义(均P>0.05)。
3 讨论
CAPN-10位于称为非胰岛素依赖型糖尿病1的染色体2q37.3中,该基因全长31 kb,含有15个外显子和14个内含子。Turner等[2]研究发现CAPN-10 mRNA除心脏外,在胰岛表达水平最高,提示CAPN-10对内分泌功能有影响。CAPN-10编码的蛋白酶属于Ca2+依赖性非溶酶体半胱氨酸蛋白酶家族,通过激活及自溶而表现出蛋白水解酶活性,水解在Ca2+调节信号途径中起重要作用的其他蛋白酶,从而参与细胞骨架调整、酶的修饰及多种细胞过程。目前SNP数据库已列出521个人类CAPN-10 SNP位点。在众多位点中,对SNP-19、-22、-43、-44、-56、-58、-63和-110的研究较多。其中SNP-19位于内含子6nt7919、rs3842570,是32 bp的2次或3次重复多态。Hachisu等[7]研究显示串联重复序列的数目在转录调控中发挥重要作用,可影响mRNA的稳定性,并通过改变结构修饰的蛋白质活性,从而发挥病理生理作用。
本研究结果显示PCOS组CAPN-10 SNP-19 1等位基因及1/2基因型频率高于对照组(均P<0.05),且1/2基因型PCOS发病风险较1/1、2/2基因型增加约2倍。这提示CAPN-10 SNP-19与PCOS遗传易感性有关,是PCOS的易感基因。这与Gonzalez等[8]对西班牙PCOS患者的研究结果一致。而Dasgupta等[9]对印度南部地区PCOS患者的相关研究则表明,CAPN-10 SNP-19等位基因频率及基因型分布与PCOS无明显相关性。Vollmert等[10]对德国PCOS患者的研究表明SNP-19 2/2基因型与PCOS发病风险相关(OR=2.98)。本研究进一步统计了不同人种PCOS组CAPN-10 SNP-19次要等位基因频率,发现中国浙江地区PCOS患者次要等位基因频率1(40.2%)与西班牙PCOS患者(34.0%)[8]相近,但低于印度(54.0%)[9]、高于德国(29.0%)[10],差异均有统计学意义(均P<0.01)。这提示CAPN-10 SNP-19等位基因分布存在种族和地域的差异。
本研究显示与对照组相比,PCOS组BMI、FPG、TG、TC、LDL均升高,差异均有统计学意义(均P<0.01)。27.1%的PCOS患者存在肥胖,71.0%存在IR,且PCOS肥胖组较非肥胖组空腹胰岛素、HOMA-IR均显著升高(均P<0.01)。研究表明,高胰岛素水平可诱导肥胖相关基因表达[11],影响脂肪细胞分化,同时刺激食欲,从而引起肥胖;而肥胖者,游离脂肪酸、乳酸盐等代谢产物利用率增加又影响胰岛素的分泌、代谢及靶器官的敏感性,从而加重IR,形成恶性循环。肥胖及IR近期可影响PCOS患者促排卵效果及妊娠结局,远期可增加T2DM、心脑血管疾病风险。因此对PCOS合并肥胖患者,控制体重仍为首选的最基本的治疗方案。
进一步统计分析发现,PCOS肥胖组和IR组1/2基因型频率分别高于非肥胖组和非IR组,但差异均无统计学意义(均P>0.05)。究其原因可能有:(1)本研究采用HOMA-IR作为IR的评估标准,今后需要进一步测定服糖后1h血糖、胰岛素,根据曲线下面积、是否存在高峰延迟等综合评估IR,必要时完善高胰岛素正葡萄糖钳夹术(IR的金标准)。以BMI评估肥胖,今后需完善腰围、臀围、腰臀比等综合评估肥胖,并明确肥胖类型;(2)本研究中71.0%PCOS患者存在IR,非IR组仅31例,需要增加样本量以明确CAPN-10 SNP-19与PCOS IR的关系;(3)CAPN-10 SNP-19可能与PCOS肥胖及IR有关,但其相关性被CAPN-10内部影响CAPN-10转录活性的其他单核苷酸所改变。因此,今后有必要研究CAPN-10其他SNP、单倍型及单倍型组合与PCOS的相关性;(4)CAPN-10 SNP-19可改变结构修饰的蛋白质活性,SNP-19不同基因型的产物结构、组织分布及生物活性与PCOS肥胖和IR的关系有待进一步基因功能研究。
综上所述,CAPN-10 SNP-19与PCOS遗传易感性有关,是PCOS的易感基因。今后有必要进一步完善相关临床资料,扩大样本含量,综合研究CAPN-10 SNPs、单倍型及单倍型组合与PCOS发病风险、PCOS各临床表型及高危型PCOS的相关性,进而进行基因功能研究,探讨PCOS发病的遗传因素和分子机制,为临床诊断、预防和基因治疗提供理论依据。
[1]Rizzo M,Tyndall E K,Frontoni S,et al.Rapid and easy assessment of insulin resistance contributes to early detection of polycystic ovary syndrome[J].EndocrinolInvest,2013,36(7):527-530.
[2]Turner M D,Cassell P G,Hitman G A.Calpain-10:from genome search to function[J].Diabetes Metab Res Rev,2005,21(6):505-514.
[3]Mendoza-Lorenzo P,Salazar A M,Cortes-Arenas E,et al.The reduction of Calpain-10 expression is associated with risk polymorphisms in obese children[J].Gene,2013,516(1):126-131.
[4]罗毅平,刘国成,张温麑,等.妊娠糖尿病Calpain10基因表达与其单倍型组合的研究[J].中国妇幼保健,2013,28(25):4235-4238.
[5]Neuhaus T,Graf C,Stier S,et al.Variation in the calpain-10 gene is not associated with gestational diabetes mellitus[J].Scand J Clin Lab Invest,2014,74(1):59-66.
[6]Rotterdam ESHRE/ASRM-Sponsored PCOS consensus workshop group.Revised 2003 consensus on diagnostic criteria and long-term health risks related to polycystic ovary syndrome[J]. Fertil Steril,2004,81(1):19-25.
[7]Hachisu Y,Hashimoto R,Kishida K,et al.Analytical procedure of variable number of tandem repeats(VNTR)analysis and effective use of analysis results for tuberculosis control[J].Rinsho Byori,2013,61(12):1123-1135.
[8]Gonzalez A,Abril E,Aragon M J,et al.Comment:CAPN10 alleles are associated with polycystic ovary syndrome[J].Clin Endocrinol Metab,2002,87(8):3971-3976.
[9]Dasgupta S,Sirisha P V,NeelaveniK,et al.Association ofCAPN10 SNPs and haplotypes with polycystic ovary syndrome among South Indian Women[J].PLoS One,2012,7(2):e32192.
[10]Vollmert C,Hahn S,Lamina C,et al.Calpain-10 variants and haplotypes are associated with polycystic ovary syndrome in Caucasians[J].Am J Physiol Endocrinol Metab,2007,292(3): E836-E844.
[11]Palacios-Ortega S,Varela-Guruceaga,Milaqro F I,et al.Expression of Caveolin 1 Is Enhanced by DNA Demethylation during Adipocyte Differentiation Status of Insulin Signaling[J]. PLoS One,2014,9(4):e95100.
Association of CAPN-10 SNP-19 with polycystic ovary syndrome
DENG Miao,LIU Yuanwei,ZHANG Hongyan,et al.
Department of Gynecology and Obstetrics,Hangzhou First People′s Hospital,Hangzhou 310006,China
2014-07-03)
(本文编辑:李媚)
浙江省科技计划项目(2009C33114)
310006 杭州市第一人民医院妇产科(邓妙现在杭州市妇产科医院工作)
张治芬,E-mail:zhangzf@zju.edu.cn

