番石榴酸改善INS-1胰岛β细胞胰岛素抵抗
魏崧丞, 王婧茹,2, 叶开和, 王小康, 马锦锦, 张晓琦, 叶文才, 叶春玲*
(1.暨南大学药学院药理学教研室,广东广州510632;2.瑞典卡罗林斯卡医学院,瑞典斯德哥尔摩17177;3.暨南大学中药与天然药物研究所,广东广州510632)
番石榴酸改善INS-1胰岛β细胞胰岛素抵抗
魏崧丞1, 王婧茹1,2, 叶开和1, 王小康1, 马锦锦1, 张晓琦3, 叶文才3, 叶春玲1*
(1.暨南大学药学院药理学教研室,广东广州510632;2.瑞典卡罗林斯卡医学院,瑞典斯德哥尔摩17177;3.暨南大学中药与天然药物研究所,广东广州510632)
目的考察番石榴酸对INS-1胰岛β细胞胰岛素抵抗的作用,并探讨其可能的作用机制。方法40 mmol/L葡萄糖干预INS-1胰岛β细胞48 h建立胰岛素抵抗模型,设番石榴酸干预组 (0.3、1、3、10、30 nmol/L),以及空白对照组、二甲亚砜对照组,胰岛素抵抗模型组,正钒酸钠组 (1mmol/L)和罗格列酮组 (1mmol/L),药物作用48 h。分别以5.6、16.7 mmol/L葡萄糖干预细胞1 h作为基础胰岛素分泌 (BIS)、高糖刺激胰岛素分泌 (GSIS)条件,用放射免疫法检测药物对胰岛素分泌的影响,结果以该细胞总蛋白量校正。荧光定量PCR法检测药物对胰岛素抵抗INS-1细胞内PTP1B、PPARγmRNA表达的作用。结果与胰岛素抵抗模型组比较,0.3 nmol/L番石榴酸便能促进胰岛素抵抗INS-1细胞的GSIS(P<0.05或P<0.01);1 nmol/L番石榴酸即可显著促进基础胰岛素分泌(P<0.01)。0.3、3、30 nmol/L番石榴酸均能显著下调胰岛素抵抗INS-1细胞的PTP1BmRNA相对表达(P<0.05或P<0.01),其中0.3和3 nmol/L番石榴酸下调作用优于正钒酸钠,上调PPARγmRNA相对表达作用优于罗格列酮。结论番石榴酸能够改善INS-1细胞胰岛素抵抗,可能通过下调PTP1B和上调PPARγ基因表达有关。番石榴酸可能通过改善胰岛β细胞自身胰岛素抵抗而发挥抗糖尿病作用。
番石榴酸;INS-1胰岛β细胞;胰岛素抵抗;PTP1B;PPARγ
糖尿病(diabetesmellitus,DM)是由胰岛素绝对或相对不足引发的以慢性高血糖为主要表现的代谢综合征[1]。糖尿病分为1型糖尿病、2型糖尿病、妊娠期糖尿病及其他类型糖尿病,其中90%为2型糖尿病(type 2 diabetesmellitus,T2DM)患者[2]。2型糖尿病的发病机制虽尚未阐明,但胰岛素抵抗(insulin resistance,IR)是其发病的主要环节之一[3]。胰岛素抵抗在2型糖尿病病程早期即存在,甚至可能在高血糖之前出现,其贯穿在2型糖尿病发生发展的全过程,实质是通过降低胰岛素介导的靶细胞对胰岛素的敏感性,而导致靶组织代谢能力异常。流行病学证据证明糖耐量受损及糖尿病、高血压、血脂紊乱、动脉硬化均与胰岛素抵抗有关。在胰岛素抵抗时,胰岛β细胞可代偿性地分泌更多的胰岛素,以维持正常的空腹或餐后血糖水平,机体糖耐量仍在正常水平[4]。若胰岛β细胞功能受损,失代偿,其功能障碍进一步加重,导致糖耐量受损,诱发糖尿病。
随着研究的深入,人们发现,胰岛β细胞自身具有胰岛素信号传递级联反应[6]。研究人员证实胰岛β细胞胰岛素受体基因敲除小鼠 (βIRKO)会出现胰岛素第一相分泌丧失80%以上,这与人类2型糖尿病发病初期的临床特征相类似[7]。说明胰岛β细胞胰岛素信号转导通路发生障碍时,会影响胰岛素的分泌,人们将此定义为胰岛β细胞的胰岛素抵抗。综上所述,胰岛素抵抗不单只发生在胰岛素靶细胞上,分泌胰岛素的胰岛β细胞也会出现胰岛素抵抗,其发生机制可能与外周靶细胞相类似:以胰岛素信号转导通路异常为主要因素。因此,2型糖尿病患者中β细胞分泌胰岛素功能的减弱也可能与自身胰岛素抵抗程度相关。改善胰岛β细胞自身发生胰岛素抵抗也可成为药物研发新方向。
番石榴(Psidium guajava)为桃金娘科番石榴属植物[8]。本课题组首次发现番石榴叶总三萜(total triperpenoids from Psidium guajava leaf,TTPGL)是番石榴叶抗糖尿病的有效组分[9](发明专利号:ZL201110100466.5)并认为TTPGL降血糖的活性部位以乌苏烷型多羟基三萜酸为主。作为其主要成分之一的番石榴酸(guavenoic acid),它同乌苏酸(ursolic acid)、2α-羟基乌苏酸(2αhydroxyl-ursolic acid)、积雪草酸(asiatic acid)一起共占总含量的50%以上。但目前,对于番石榴酸的抗糖尿病作用及其作用机制分析,尚未见文献报道。为进一步探讨番石榴叶总三萜的抗糖尿病作用及其机制,本实验采用INS-1胰岛β细胞建立胰岛β细胞胰岛素抵抗模型,探讨番石榴叶总三萜中主要成分番石榴酸对胰岛β细胞胰岛素抵抗的影响;并通过观察番石榴酸对INS-1β细胞内蛋白酪氨酸磷酸酶1B(protein-tyrosine phosphatase 1B,PTP1B)基因、过氧化物酶增殖物活化受体 (peroxisome proliferator-activated receptor gamma,PPARγ)基因表达的影响,揭示其改善胰岛β细胞胰岛素抵抗的作用机制。
1 材料
1.1 细胞 大鼠胰岛细胞瘤细胞株,ISN-1(资源编号3111c0001ccc000378)购自中国医学科学院北京协和细胞资源中心。
1.2 主要仪器 SAFIRZ-Z酶标仪(TZCAN,奥地利);SN-682B全自动γ计数器 (上海日环仪器有限公司);PTC-1152 PCR仪(BIO-RAD,美国);CFD-3120荧光实时定量PCR仪(BIO-RAD,美国)。
1.3 药品及主要试剂 番石榴酸 (结构式见图1)来源于番石榴的干燥叶,溶剂法纯化工艺提取,纯度为95%,实验前用二甲亚砜 (DMSO)溶解,4℃保存。RPMI 1640培养液 (Lot.8112347)、0.05%胰酶-EDTA(1×)(Lot.210175K)、胎牛血清(Lot.1184652),均购自GIBCO公司;D-(+)-葡萄糖、2β-巯基乙醇、DMSO,购自SIGMA公司;碘 [125I]胰岛素放射免疫分析试剂盒,购自北京北方生物技术研究所;马来酸罗格列酮,上海原叶生物科技有限公司提供,实验前用DMSO溶解;正钒酸钠,购自Aladdin,实验前用DMSO溶解;RIPA裂解液(强)、BCA蛋白定量试剂盒,购自碧云天生物技术研究所;TRIzol,购自Invitrogen;ReverTra Ace qPCR RT Kit,购自TOYOBO;SsoFast EvaGreen Supermix qPCR Kit,购自BIORAD;DNA引物,委托华大基因合成。

图1 番石榴酸结构式Fig.1 Structural formula of guavenoic acid
2 方法
2.1 INS-1胰岛细胞的培养 培养条件为含有10%FBS、5.6 mmol/L葡萄糖、100 U双抗、50 mmol/L 2β-巯基乙醇的RPMI1640培养液;于37℃,5%CO2环境培养。
2.2 胰岛素抵抗INS-1细胞的胰岛素分泌的测定
取对数生长期的细胞,调整细胞密度至1×105个/mL,接种于48孔板。24 h后弃旧培养液。空白对照组、二甲亚砜对照组给予完全培养液,胰岛素抵抗模型组均给予含40 mmol/L葡萄糖完全培养液,正钒酸钠组 (1 mmol/L)、罗格列酮组(1 mmol/L)、番石榴酸组 (0.3、1、3、10、30 nmol/L)分别给予含有相应药物的40 mmol/L葡萄糖完全培养液。作用48 h,弃上清,PBS洗后加入300 ml/孔HBSS缓冲液于37℃平衡30 min;各组的基础糖刺激 (BIS),高糖刺激 (GSIS)分别给予5.6 mmol/L、16.7 mmol/L葡萄糖-HBSS溶液,300 mL/孔。37℃孵育1 h,取上清液,应用放射免疫法测定胰岛素量。结果以胰岛细胞总蛋白量校正。以单位质量胰岛素浓度 (每孔胰岛素含量/相应的蛋白含量)表示,即IU/(L·g protein)。
2.3 胰岛素抵抗的INS-1细胞PTP-1B,PPARγ mRNA的表达的测定 取对数生长期的细胞,调整细胞密度至2×105个/mL,接种于24孔板,24 h后弃培养液。干预方法及分组同 “2.2”项,其中番石榴酸剂量调整为:0.3、3、30 nmol/L。药物作用48 h后,弃上清,PBS洗,按TRIzol是结合实验手册提取总RNA,测定样品浓度与纯度后,逆转录。参照TOYOBO RT试剂盒进行逆转录。以RT产物为模板,加入SsoFast EvaGreen Supermix、对应引物,以10mL体系进行荧光定量PCR,反应条件为:95℃30 s,95℃5 s、62℃/54.5℃(PTP1B/PPARγ)5 s共进行45个循环,溶解曲线65~95℃(in 0.5℃inc.)5 s/step。
设计引物序列,分别为:RAT-PTP1B引物(正向引物5'-ACC CTG TGC GGA AAT GCG GG-3',反向引物5'-GGC AGT CAG TCA ACC CCG GC-3')、RAT-PPARγ引物(正向引物5'-TGT GGA CCT CTC TGT GAT-3',反向引物5'-CAT TGG GTC AGC TCT TGT GA-3')、内参GAPDH引物(正向引物5'-CCC ACT CCT CCA CCT TTG AC-3',反向引物5'-TCT TCC TCT TGTGCT CTT GC-3'),委托华大基因进行引物合成。
2.4 统计学分析 以上实验均进行重复性实验,结果以 “平均值±标准差” ()表示。应用SPSS 17.0统计学软件对实验结果进行统计学分析,两组间比较用t-test,P<0.05被认为有显著性差异,P<0.01为差异非常显著;应用GraphPad Prism 5.0软件绘图。
3 结果
3.1 番石榴酸对胰岛素抵抗INS-1细胞(IR-INS-1)分泌功能的影响 应用放射免疫法测定胰岛素抵抗INS-1胰岛β细胞在番石榴酸干预48 h后的BIS、GSIS值,用对应的总蛋白量校正。结果发现,40mmol/L葡萄糖干预48 h的胰岛素抵抗模型组与二甲亚砜组[BIS为(165.1±8.7)IU/(L·g protein)、GSIS为(215.1±8.1)IU/(L·g pro-tein)]比较,胰岛素抵抗组BIS与GSIS均有十分显著的降低 (P<0.01),分别为 (102.7±12.6)、(127.1±31.8)IU/(L·g protein),说明INS-1胰岛β细胞胰岛素抵抗模型构建成功。罗格列酮组和正钒酸钠组INS-1β细胞的BIS、GSIS与胰岛素抵抗模型组比较,均有显著的升高 (P<0.05或P<0.01)。
与胰岛素抵抗模型组BIS[(102.7±12.6)IU/(L·g protein)]比较,1、3、10、30 nmol/L的番石榴酸均能显著促进胰岛素抵抗INS-1细胞的基础分泌能力 (P<0.05),分别为(172.5± 33.6)、(140.0±39.5)、(157.0 ±12.4)、(149.3±7.2)IU/(L·g protein);与IR模型组GSIS[(127.1±31.8)IU/(L·g protein)]比较,较低剂量的番石榴酸 (0.3、1 nmol/L)便能显著促进胰岛素抵抗INS-1细胞的GSIS(P<0.01),分别为(297.9±0.8)、(237.2±19.7)IU/(L·g protein),结果见图2。

图2 番石榴酸对胰岛素抵抗INS-1细胞分泌功能的影响Fig.2 Effects of guavenoic acid on insulin secretion function of IR-INS-1 cells(,n=6)
3.2 番石榴酸对IR-INS-1细胞PTP1B、PPARγ mRNA表达的影响 番石榴酸、40 mmol/L葡萄糖干预INS-1胰岛β细胞48 h后,提取总RNA并测定其浓度与纯度 (测定结果A260/280在1.8~2.0正常范围内),逆转录后进行荧光定量PCR扩增,测定番石榴酸对IR-INS-1细胞中PTP1B、PPARγmRNA相对表达量。
3.3 PTP1B mRNA相对表达 胰岛素抵抗模型组与二甲亚砜对照组(1.00±0.07)比较,PTP1B mRNA相对表达上调显著 (P<0.05),为(1.23±0.07);番石榴酸组与胰岛素抵抗模型组比较,各浓度 (0.3、3、30 nmol/L)番石榴酸均能显著下调胰岛素抵抗INS-1细胞内PTP1B mRNA相对表达 (P<0.05或P<0.01),分别为(0.62± 0.12)、(0.55±0.03)、(0.73±0.18),其中0.3、3 nmol/L番石榴酸下调作用强于正钒酸钠 (0.76± 0.11)。结果详见图3。

图3 番石榴酸对IR-INS-1细胞PTP1B m RNA表达的影响(,n=6)Fig.3 Effects of guavenoic acid on relative RNA expression of PTP1B in IR-INS-1 cells(,n=6)
3.4 PPARγmRNA相对表达 胰岛素抵抗模型组与二甲亚砜对照组 (1.53±0.32)比较,PPARγ mRNA相对表达下调十分显著 (P<0.01),达(0.84±0.10);番石榴酸组与胰岛素抵抗模型组比较,各浓度 (0.3、3、30 nmol/L)番石榴酸均能极显著上调胰岛素抵抗INS-1细胞内PPARγmRNA表达 (P<0.01),分别为 (12.92±0.97)、(12.78±1.71)、(3.78±0.03);且 0.3、3 nmol/L番石榴酸上调作用明显强于罗格列酮(9.40±0.42)。结果见图4。
4 讨论
胰岛素主要有两方面的生物效应: (1)调节代谢,在维持机体新陈代谢稳态的过程中起全面促进合成代谢的作用; (2)调节细胞增殖,抑制凋亡。胰岛素生物效应是通过与胰岛素受体结合后,启动细胞内胰岛素信号转导级联反应实现的。胰岛素信号传导通路由以下成员组成:胰岛素受体(Insulin Receptor,IR)、胰岛素受体底物(insulin receptor substrate,IRS)[10]、磷脂酰肌醇-3激酶-丝氨酸/苏氨酸蛋白激酶 (PI3K-Akt)[11],丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)等[12]。胰岛素信号转导通路的下游信号反应主要有两条通路:(1)PI3K-AKT/PKB,主要发挥胰岛素代谢效应,介导细胞增殖等; (2)Shc/Raf/MAPK,主要调节受体基因转录,调节细胞生长、凋亡。在胰岛β细胞中,以上通路也都是存在的。胰岛β细胞也可以通过以上信号转导途径对其自身的胰岛素分泌、反馈、再合成进行调控。
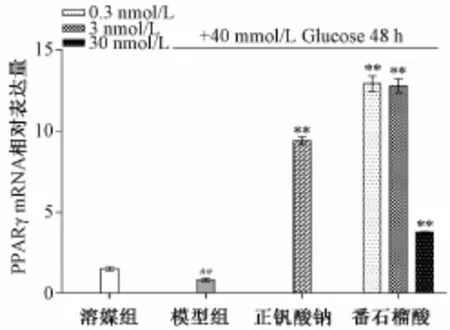
图4 番石榴酸对IR-INS-1细胞PPARγm RNA表达的影响(,n=6)Fig.4 Effects of guavenoic acid on relative RNA expression of PPARγin IR-INS-1 cells(,n=6)
胰岛素信号转导通路对胰岛β细胞功能、外周靶细胞对葡萄糖的摄取及利用均有关键作用。目前,作为胰岛素信号转导通路调节因子的PTP1B和PPARγ已成为糖尿病治疗的靶点。PTP1B是最早发现并被编码的蛋白酪氨酸激酶(protein tyrosine kinases,PTPase)家族成员之一[13],广泛而丰富地分布于各种细胞细胞浆内,属于去磷酸化酶[14],PTP1B是对胰岛素信号转导起到负性调控胰岛素作用受体通路的作用[15-16]。PTP1B基因敲除小鼠与对照小鼠相比,其胰岛素敏感性显著增强;还能延缓IRS-2基因敲除小鼠发生糖尿病的时间。另外,PTP1B与2型糖尿病的胰岛素抵抗密切相关[17-18]。研究人员在骨骼肌中过度表达PTP1B,通过应用葡萄糖钳夹术,证实PTP1B表达增高的小鼠具有明显的胰岛素抵抗特征;而抑制骨骼肌PTP1B表达,则能够抵抗白介素-6诱导的胰岛素抵抗[19]。
过氧化物酶增殖物活化受体家族(PPARs),为核激素受体家族成员,是配体依赖性转录因子,可以调节细胞生长、分化及代谢等相关基因[20]。PPARγ与PPARα,PPARδ3种亚型是PPARs存在形式[21]。与相应的配体结合活化后,PPARs方能与维甲酸X受体 (RXR)异源二聚化,再通过与目的基因调控区内的PPAR应答元件(peroxisome proliferator response element,PPRE)作用,以实现调控目的基因的转录[21-23]。PPARγ活力受丝裂原活化蛋白激酶(MAPK)或c-Jun的N-末端激酶信号通路调控。其中PPARγ主要表达于脂肪组织、肝脏、骨骼肌,能促进脂肪细胞分化的转录因子。在糖代谢调节中激活后的PPARγ发挥改善外周组织胰岛素敏感性作用[24-25]。
胰岛β细胞具有完整的胰岛素信号转导通路,并且能够表达主要转导调节因子,例如PTP1B、PPARγ。研究报道,胰岛素抵抗不单只发生在胰岛素靶细胞上,分泌胰岛素的胰岛β细胞自身也会出现胰岛素抵抗,其发生机制可能与外周靶细胞相类似:以胰岛素信号转导通路异常为主要因素。
本实验使用40 mmol/L高浓度的葡萄糖干预INS-1胰岛β细胞48 h,建立胰岛素抵抗模型。结果发现胰岛素抵抗模型组的BIS、GSIS显著下降,而阳性药物罗格列酮、正钒酸钠均能使BIS、GSIS恢复。以上结果表明,该胰岛素抵抗模型成功建立。实验结果显示,番石榴酸能够恢复INS-1胰岛β细胞胰岛素抵抗模型的BIS、GSIS,其中对GSIS作用尤为显著,表明番石榴酸具有改善INS-1胰岛β细胞自身胰岛素抵抗的作用。
在胰岛素信号转导通路中,胰岛素受体与胰岛素受体底物均是PTP1B的底物,能够在PTP1B的作用下去磷酸化而阻断信号传导[26]。本实验结果显示,阳性药正钒酸钠能显著下调胰岛素抵抗INS-1细胞的PTP1B基因表达;番石榴酸亦能显著下调胰岛素抵抗INS-1细胞的PTP1B基因表达,此结果与其影响胰岛素分泌的结果一致,其可能通过下调PTP1B基因表达,从而改善INS-1细胞胰岛素抵抗状态。
已有研究发现,内源性PPARγ以配体依赖的方式在INS-1细胞中发挥作用;在没有配体存在下,过表达PPARγ,能够增加INS-1细胞的GSIS,说明GSIS是受PPARγ介导的;当同时增加PPARγ与RXR时,能够产生协同效应,说明对GSIS目的基因的调控需要该二聚体的存在;PPARγ能够以配体依赖的形式通过上调GLUT2与Cb1-associated protein(CAP)基因的表达来实现对胰岛β细胞GSIS的促进作用[27]。本实验结果表明,阳性药罗格列酮能显著上调胰岛素抵抗INS-1细胞的PPARγ基因表达。番石榴酸在低剂量下即能对PPARγ基因表达量产生显著的上调作用,此作用结果与其促进胰岛素分泌的结果一致,提示其可能通过上调PPARγ基因表达,从而改善INS-1细胞胰岛素抵抗状态。
总之,番石榴酸能显著改善胰岛素抵抗,其作用机制可能与其下调PTP1Bm RNA、上调PPARγ mRNA基因表达有关。
[1]Landgraf R.Meglitinide analogues in the treatment of type2 diabetesmellitus[J].Drugs Aging,2000,17(5):411.
[2]Zimmet P,Alberti K,Shaw J.Global and societal imp lications of the diabetes epidemic[J].Nature,2001,414(6865):782-787.
[3]Kahn CR,Weir G C.Joslinˊs diabetesmellitus[J].Endocrinologist,1995,5(2):157-158.
[4]Araujo T G,Oliveira A G,Carvalho B M,et al.Hepatocyte growth factor plays a key role in insulin resistance-associated compensatory mechanisms[J].Endocrinology,2012,153(12):5760-5769.
[5]Morino K,Petersen K F,Sono S,et al.Regulation of mitochondrial biogenesis by lipoprotein lipase in muscle of insulinresistant offspring of parentswith type 2 diabetes[J].Diabetes,2012,61(4):877-887.
[6]Harbeck M C.Expression of insulin receptormRNA and insulin receptor substrate1 in pancreatic islet beta-cells[J].Diabetes,1996,45(6):711-717.
[7]Kulas D T,Zhang W R,Goldstein B J,et al.Insulin receptor signaling is augmented by antisense inhibition of the protein tyrosine phosphatase LAR[J].J Biol Chem,1995,270(6):2435-2438.
[8]Gutiérrez R M P,Mitchell S,Solis R V.Psidium guajava:a review of its traditional uses,phytochemistry and pharmacology[J].JEthnopharm,2008,117(1):1-27.
[9]王婧茹,赵晶晶,叶春玲,等.番石榴叶总三萜对2型糖尿病大鼠的降血糖和血脂作用[J].中国病理生理杂志,2012,28(6):1109-1113.
[10]Fiory F,Lombardi A,Miele C,etal.Methylglyoxal impairs insulin signalling and insulin action on glucose-induced insulin secretion in the pancreatic beta cell line INS-1E[J].Diabetologia,2011,54(11):2941-2952.
[11]Fiory F,Lombardi A,Miele C,et al.Altered insulin receptor signalling and beta-cell cycle dynamics in type 2 diabetesmellitus[J].Plos One,2011,6(11):28050.
[12]Saltiel A R,Kahn CR.Insulin signalling and the regulation of glucose and lipid metabolism[J].Nature,2001,414(6865):799-806.
[13]Byon JC H,Kusari A B,Kusari J.Protein-tyrosine phosphatase-1B acts as a negative regulator of insulin signal transduction[J].Mol Cell Biochem,1998,182(1-2):101-108.
[14]CicirelliM F,Tonks N K,Diltz CD,et al.Microinjection of a protein-tyrosine-phosphatase inhibits insulin action in Xenopus oocytes[J].Proc Natl Acad Sci,1990,87(14):5514-5518.
[15]CicirelliM F,Tonks N K,Diltz CD,et al.Prodrug delivery of novel PTP1B inhibitors to enhance insulin signalling[J].Diabetes ObesMetab,2009,11(6):579-588.
[16]Stuible M,Abella JV,Feldhammer M,et al.PTP1B targets the endosomal sortingmachinery:dephosphorylation of regulatory sites on the endosomal sorting complex required for transport component STAM2[J].JBiol Chem,2010,285(31):23899-23907.
[17]Barr A J.Protein tyrosine phosphatases as drug targets:strategies and challenges of inhibitor development[J].Future Med Chem,2010,2(10):1563-1576.
[18]Bakhtiyari S,Meshkani R,Taghikhani M,et al.Protein tyrosine phosphatase-1B(PTP-1B)knockdown improves palmitateinduced insulin resistance in C2C12 skeletalmuscle cells[J]. Lipids,2010,45(3):237-244.
[19]Nieto-Vazquez I,Fernández-Veledo S,de Alvaro C,etal.Dual role of interleukin-6 in regulating insulin sensitivity inmurine skeletalmuscle[J].Diabetes,2008,57(12):3211-3221.
[20]Mangelsdorf D J,Evans R M.The RXR heterodimers and orphan receptors[J].Cell,1995,83(6):841-850.
[21]Hu E,Kim J B,Sarraf P,et al.Inhibition of adipogenesis through MAP kinase-mediated phosphorylation of PPARgamma[J].Science,1996,274(5295):2100-2103.
[22]ChakravartiD,LaMorte V J,Nelson M C,etal.Role of CBP/ P300 in nuclear receptor signalling[J].Nature,1996,383(6595):99-103.
[23]Senniappan S,Shanti B,James C,et al.Hyperinsulinaemic hypoglycaemia:geneticmechanisms,diagnosisand management[J].Inherit Metab Dis,2012,35(4):589-601.
[24]GandhiGR,Stalin A,Balakrishna K,etal.Insulin sensitization via partial agonism of PPARgamma and glucose uptake through translocation and activation of GLUT4 in PI3K/p-Akt signaling pathway by embelin in type 2 diabetic rats[J].Biochim Biophys Acta,2013,1830(1):2243-55.
[25]Kong C S,Kim J,Eom T K,et al.Phosphorylated glucosamine inhibits adipogenesis in 3T3-L1 adipocytes[J].Nutr Biochem,2010,1(5):438-43.
[26]吴 鸿.蛋白酪氨酸磷酸酶1B对β细胞胰岛素分泌功能及其胰岛素信号转导通路的影响[D].上海:第二军医大学,2009.
[27]Xu Z K,Chen N G,Ma C Y,et al.Role of peroxisome proliferator-activated receptor gamma in glucose-induced insulin Secretion[J].Acta Bioch Bioph Sin,2006,8(1):1-7.
Effect of guavenoic acid on im proving insulin resistance in INS-1 cells and itsmechanisms
WEISong-cheng1, WANG Jing-ru1,2, YE Kai-he1, WANG Xiao-kang1, MA Jin-jin1, ZHANG Xiao-qi3, YEWen-cai3, YE Chun-ling1*
(1.Department of Pharmacology,Pharmacy Collegeof Jinan University,Guangzhou 510632,China;2.The Karolinska Institute in Sweden,Stockholm,Sweden 17177;3.Research Institute of Traditional Chinese Medicine and Natural Medicine of Jinan University,Guangzhou 510632,China)
AIMTo investigate the improvementeffectof guavenoic acid(GA)on insulin resistance in INS-1 cells and its possiblemechanism.M ETHODS40mmol/L glucose caused stimulation to INS-1 cells in vitro for 48h to establish the insulin resistance model(IR).These INS-1 cells were assigned into guavenoic acid groups(0.3,1,3,10,30 nmol/L),DMSO group,the IR group,sodium orthoranadate group(1 mmol/L),Rosiglitazone group(1 mmol/L),and the control group,then 5.6,16.7 mmol/L glucose were used to challenge INS-1 cells for 1h,respectively,to test their basal insulin secretion(BIS)and glucose stimulated insulin secretion(GSIS).The influence of test drugs to insulin secretion was calculated by radioimmunology and was calibrated by total proteins in cells.ThemRNA expressions of PTP1B and PPARγweremeasured by q-PCR.RESULTSCompared with themodel group,guavenoic acid(0.3 nmol/L)could promote GSIS of insulin resistance INS-1 cells(P<0.05 or P<0.01);guavenoic acid(1 nmol/L)played a significant role in the promotion of BIS(P<0.01).Compared with the model group,guavenoic acid(0.3,3,and 30 nmol/L)could significantly decrease relative expression of PTP1BmRNA in insulin resistance INS-1 cells(P<0.05 or P<0.01).Downward effectof guavenoic acid(0.3 and 3 nmol/L)was better than thatof sodium orthovanadate;the incrementof relative expression of PPARγmRNA by guavenoic acid(0.3 and 3 nmol/L)wasmore than that of Rosiglitazone.CONCLUSIONGuavenoic acid can significantly improve the insulin resistance of INS-1 cells,which may be related to the down-regulation of PTP1B gene expression and up-regulation of PPARγgene expression.
guavenoic acid;INS-1βcells;insulin resistance;PTP1B;PPARγ
R285.5
A
1001-1528(2015)04-0710-06
10.3969/j.issn.1001-1528.2015.04.005
2014-05-18
广东省高等学校科技创新重点项目 (cxzd1111)
魏崧丞(1988—),女,硕士生,研究方向为内分泌药理学。Tel:13751824465,E-mail:wswschello@163.com
*通信作者:叶春玲,女,博士,教授,硕士生导师,研究方向为内分泌药理学。Tel:(020)85223843,E-mail:yechunling2005@ 163.com