黄连碱在人肝微粒体中的代谢
刘 倩, 陈龙龙, 马双成, 张祖艳, 李云华, 钱 勇, 顾 军, 谢天培*
(1.上海沪丰生物科技有限公司,上海200433;2.中国食品药品检定研究院,北京100050;3.上海诗丹德生物技术有限公司,上海201203;4.美国纽约州卫生部Wadsworth医学研究中心,奥尔巴尼,纽约12201)
[药 理]
黄连碱在人肝微粒体中的代谢
刘 倩1, 陈龙龙1, 马双成2, 张祖艳1, 李云华1, 钱 勇3, 顾 军4, 谢天培3*
(1.上海沪丰生物科技有限公司,上海200433;2.中国食品药品检定研究院,北京100050;3.上海诗丹德生物技术有限公司,上海201203;4.美国纽约州卫生部Wadsworth医学研究中心,奥尔巴尼,纽约12201)
目的研究黄连碱在人肝微粒体中的代谢情况。方法通过酶促动力学实验计算酶促动力学参数,通过检测CYP 4 5 0亚酶专属性抑制剂对黄连碱代谢的影响,推测参与黄连碱代谢的CY P酶亚型,并推断代谢产物的结构。结果黄连碱在人肝微粒体中代谢的米氏常数Km为6.802 7μmol/L,最大代谢速率Vmax为0.054 76 nmoL/(mg protein· min),肝清除率Clint为0.008 m L/(mg·min),奎宁、甲氧沙林、酮康唑均在一定程度上抑制了黄连碱的代谢,黄连碱在人肝微粒体中的代谢产物为黄连碱脱去一个亚甲基结构。结论CYP2D6、CYP2A6、CYP3A4可能参与黄连碱的代谢,代谢产物为脱亚甲基黄连碱。
黄连碱;人肝微粒体;酶促动力学;代谢产物
黄连碱为天然季胺型异喹啉类生物碱,存在于黄连、延胡索、白屈菜、人血草、苦地丁等多种植物中,具有多方面的药理作用,包括抑制A型单胺氧化酶[1-2]、选择性抑制血管平滑肌增殖[3]、选择性调节血管平滑肌细胞中的多药耐药蛋白质表达[4]、抗真菌活性[5]、抗乙型肝炎病毒作用[6]、通过抑制心肌细胞凋亡和炎症损伤对抗心肌缺血/再灌注[7]、抑制破骨前体细胞RANKL诱导的NF-κB磷酸化及成骨细胞功能[8]、保护胃黏膜[9-10]、抑制醛糖还原酶活性[11]、通过抗氧化和抑制RhoA/Rho激酶对异丙肾上腺素引起的大鼠心肌梗塞发挥心脏保护作用[12]、对肝癌细胞和白血病细胞的细胞毒作用[13]等。虽然近年来对黄连碱的药理作用进行了广泛的研究,但在黄连碱代谢方面的报道较少,而药物代谢是影响药物作用的最重要因素之一。对药物代谢的途径及稳定性、参与代谢的酶及动力学参数以及由代谢引起的药物相互作用问题的研究,是寻找高效低毒药物的必要条件,因此有必要对黄连碱的代谢进行研究。
CYP450是公认的人类最重要的代谢酶系统,能作用于不同结构的外源化合物使其进行生物转化。通常认为90%的药物的氧化是由CYP450酶系催化的。其中CYP3A4占34%,CYP2D6为19%,CYP2C8和CYP2C9为16%,CYP2C19为8%,CYP1A2为8%[14-15]。本实验采用人肝微粒体体外温孵法研究黄连碱的酶促动力学、通过测定CYP450亚酶专属性抑制剂对黄连碱代谢的影响推测可能参与黄连碱代谢的CYP450亚酶,并研究黄连碱在人肝微粒体孵育体系中的Ⅰ相代谢产物。本研究为黄连碱的体内代谢及药物相互作用研究提供参考依据。
1 仪器与试剂
1.1 仪器 Agilent 1290超高效液相-G6460三重串联四极杆质谱联用仪;涡旋振荡器(Vortex-5,江苏海门其林贝尔仪器制造有限公司);恒温振荡培养箱 (HZQ-X100,太仓市华美生化仪器厂);离心机(Fresco 21,thermo美国);超声波清洗仪(KQ5200DB,昆山市超声仪器有限公司)。
1.2 试药 α-萘黄酮购于上海晶纯生化科技股份有限公司,磺胺苯吡唑购于美国Sigma公司;4-甲基吡唑购于国药集团化学试剂有限公司;酮康唑、氟康唑、甲氧沙林购于中国食品药品检定研究院;奎宁购于上海百灵威化学技术有限公司;盐酸黄连碱、四氢小檗碱购于上海诗丹德生物技术有限公司;人肝微粒体购于美国BD Gentest公司(20人混合肝微粒体);PBS缓冲液(Corning cellgro,美国);NADPH(烟酰胺腺嘌呤二核苷酸磷酸四钠盐还原型)购于上海鼎国生物技术有限公司;甲醇、乙腈 (质谱级)购于美国Merck公司;其余试剂均为分析纯,水为超纯水。
2 试验方法与结果
2.1 分析条件 色谱条件Agilent Proshell C18色谱柱(4.6 mm×50 mm,2.7μm);流动相为乙腈-0.2%乙酸(25:75);体积流量0.8 m L/min;柱温30℃;进样量2μL。
质谱条件电喷雾离子源 (ESI),正离子扫描;检测方式:①定量分析采用MRM模式,黄连碱(m/z)320.2→292.3(CE值为29 eV),内标四氢小檗碱(m/z)340.0→176.2(CE值为30 eV);②定性分析采用全扫描及产物离子扫描;干燥气温度350℃;干燥气体积流量10 L/min;雾化器压力45 psi(1 psi=6.895 kPa);鞘气温度400℃;鞘气体积流量11 L/min。
2.2 黄连碱的体外代谢体系和处理方法 温孵体系总孵育体积0.2 m L,含人肝微粒体、1 mmol/L NADPH及盐酸黄连碱。介质为磷酸缓冲液(PBS)。配置好的温孵液置于37℃振荡孵育特定时间后立即取出,用等体积的含内标四氢小檗碱的冷乙腈终止反应,涡旋震荡后,10 000×g离心10 min。过滤,LC-MS检测。
2.3 标准曲线的建立 取不同浓度黄连碱甲醇溶液,加到热失活的人肝微粒体悬浮液中,使反应液中黄连碱的最终浓度为0.01~100μmol/L。按“黄连碱的体外代谢体系和处理方法”项操作,以黄连碱的浓度为横坐标,黄连碱与内标峰四氢小檗碱峰面积比值为纵坐标绘制标准曲线,结果在0.01~15μmol/L、15~100μmol/L范围内分别呈线性关系,计算曲线的回归方程为Y=0.686 9X+ 0.120 7,r=0.997 1(0.001~15μmol/L),Y= 0.742 7X+20.689 7,r=0.998 4(15~100μmol/L)。测得检测下限为0.5 nmol/L。
2.4 稳定性、回收率和精密度试验 依据标准曲线方法配制3个不同浓度的黄连碱溶液用于稳定性、回收率和日内日间精密度的测定。测得3个浓度的相对回收率分别为 98.73%、99.24%和100.86%。3个浓度的日内精密度 RSD分别为2.59%、3.40%、3.02%(n=6),3 d的日间精密度RSD为5.29%、6.01%、6.37% (n=6)。冻融稳定性显示样品在72 h内稳定,RSD分别为为5.73%、3.15%、5.90%(n=6)。
2.5 肝微粒体蛋白质量浓度对代谢率的影响 人肝微粒体蛋白质量浓度在0~2 mg/mL范围内,温孵时间为90 min时,随着肝微粒体蛋白质量浓度的增大,黄连碱代谢率增大 (见图1)。当肝微粒体质量浓度达到1.2 mg/mL时,代谢率增加减缓。最终选择肝微粒体质量浓度为1.2 mg/mL。黄连碱代谢率以被代谢的黄连碱的量和加入黄连碱的量的比值进行计算。

图1 肝微粒体蛋白质量浓度对代谢率的影响Fig.1 Effect of m icrosomal protein concentration on the metabolic rate of coptisine in human m icrosomes
2.6 温孵时间对黄连碱代谢率的影响 人肝微粒体质量浓度为1.2 mg/mL。样品体系37℃孵育0、5、15、30、60、90、120 min,LC-MS检测黄连碱的质量浓度。结果表明在90 min后,黄连碱质量浓度趋于稳定 (见图2)。最终确定孵育时间为90 min。
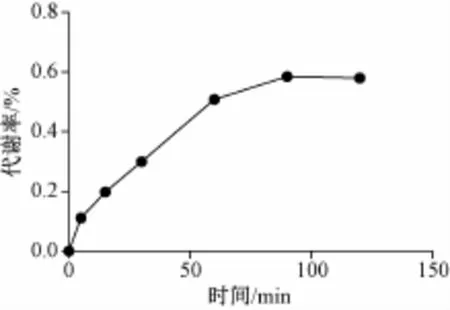
图2 温孵时间对黄连碱代谢率的影响Fig.2 Effectof incubation time on themetabolic rate of coptisine in human m icrosomes
2.7 底物浓度对黄连碱在人肝微粒体中代谢速率(V)的影响 在人肝微粒体温孵液中加入不同浓度的黄连碱标准溶液,使黄连碱的浓度分别为1、10、20、40、60、80、100μmol/L,肝微粒体蛋白浓度为1.2 mg/mL,孵育90 min后取样,处理后进行测定。结果 (见图 3)显示底物浓度达到66.2μmol/L时代谢接近饱和。代谢速率以温孵液中黄连碱浓度的减少量(μmol/L)除以温孵时间(min)及人肝微粒体蛋白质量浓度 (mg/mL)表示。
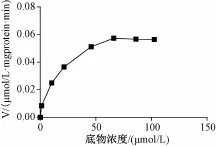
图3 底物浓度对代谢速率的影响Fig.3 Effect of substrate concentration on the m etabolic rate of coptisine in human liver m icrosomes
2.8 黄连碱在人肝微粒体中酶促动力学实验 根据测得浓度与代谢速率做Linewearver-Burk双倒数曲线,横轴截距为-1/Km,纵轴截距为1/Vmax,得米氏常数Km=6.802 7μmol/L,最大代谢速率Vmax=0.054 76 nmol/(mg protein·min)。肝清除率CLint=Vmax/Km=0.008 mL/(mg·min)。
2.9 抑制性实验推测可能参与黄连碱代谢的CYP450亚酶 通过测定CYP450亚酶专属性抑制剂对黄连碱代谢的影响,推测可能参与黄连碱代谢的CYP450亚酶。按 “2.2”项下方法,所采用的抑制剂为 α-萘黄酮 (CYP1A2),甲氧沙林(CYP2A6),磺胺苯吡唑 (CYP2C9),氟康唑(CYP2C19),奎宁 (CYP2D6),4-甲基吡唑(CYP2E1),酮康唑(CYP3A4),各抑制剂浓度范围为0~100μmol/L。所有的抑制剂都溶解在甲醇中,加等量甲醇 (不含抑制剂)作为阴性对照样品。各体系中有机溶剂的比例小于1%。结果见图4。由图4可见,奎宁、甲氧沙林、酮康唑均在一定程度上抑制了黄连碱的代谢。奎宁、甲氧沙林、酮康唑分别是CYP2D6、CYP2A6、CYP3A4的特异性抑制剂,推测CYP2D6、CYP2A6、CYP3A4参与了黄连碱的代谢。
2.10 黄连碱代谢产物研究 按 “2.2”项下方法制备样品 (不加内标),及空白样品 (不加黄连碱),并制备对照样品即加NADPH后不经孵育立即终止反应,12 000×g离心10 min,取上清液。进样分析。将黄连碱的人肝微粒体孵育液的一级全扫描与空白样品以及对照样品相比较发现原药M0(m/z320.2)'以及一个可能的代谢产物M1(m/z 308.2),其二级质谱与黄连碱相似,推测为黄连碱去亚甲基产物。二级质谱图见图5。由于黄连碱结构中的N+有很强的吸电子作用,导致与D环相连的O原子的电子向C环转移,质子化的可能性较低,因此推断亚甲基的丢失发生在靠近A环的位置。黄连碱及代谢产物可能的结构见图6。

图4 专属性CYP450抑制剂对黄连碱在人肝微粒体中代谢率的影响Fig.4 Effects of CYP450 inhibitors on metabolic rate of coptisine in human liver m icrosomes
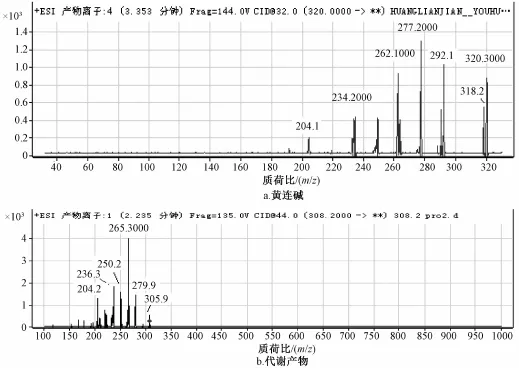
图5 黄连碱及代谢产物的二级质谱图Fig.5 Secondary ion mass spectrogram of coptisine and itsmetabolites
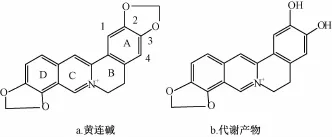
图6 黄连碱及其代谢产物结构图Fig.6 Structures of coptisine and itsmetabolites
3 讨论
黄连碱为原小檗碱型生物碱季铵盐,与小檗碱结构非常相似,小檗碱在临床上已经得到广泛的应用,黄连碱则可能由于来源没有小檗碱广泛而受到限制,但近年来对黄连碱的研究日益增多,药理研究发现黄连碱在很多方面如抑制A型单胺氧化酶、选择性抑制血管平滑肌增殖、选择性调节血管平滑肌细胞中的多药耐药蛋白质表达等作用都优于小檗碱,因此黄连碱或经结构修饰后的产物很可能有较好的应用前景。而黄连碱的代谢研究报道较少,本实验针对黄连碱的代谢情况进行研究。
本实验考察了黄连碱的代谢条件,并进行了酶促动力学研究。测定酶反应速率有两种方法,即单位时间内产物生成法和单位时间内底物消除法。产物生成法需要有产物的对照品,而对于未知代谢产物的化合物,这种方法的应用就受到限制。本研究采用底物消除法测定了黄连碱的酶动力学参数。由于运用底物消除法选择的底物浓度要保证在一定的反应时间内有一定的清除 (20%以上)[16]。本实验发现黄连碱底物浓度在1.2~21.4μmol/L之间时消除率在20%之上,满足底物消除法测定酶动力学参数的要求。黄连碱在人肝微粒体中代谢的米氏常数Km为6.802 7μmol/L,最大代谢速率Vmax为0.054 76 nmol/(mg protein·min)。肝清除率Clint为0.008 mL/mg·min,小檗碱在人肝微粒体中代谢的Km为2.69 nmol/m L(即2.69μmol/L),最大代谢速率Vmax为1.51 nmol/(mg protein·h)[即0.025 2 nmol/(mg protein·min)]。肝清除率Clint为0.56 mL/(mg·h)[即0.009 3 mL/(mg· min)][17],虽然存在使用试剂及实验条件的不同,但两者在人肝微粒体中的代谢有一定的相似性。
为了推测在人肝微粒体中参与黄连碱代谢的CYP450酶亚型,本实验考察了7种专属抑制剂对黄连碱代谢的影响。结果显示奎宁、甲氧沙林、酮康唑均在一定程度上抑制了黄连碱的代谢,即CYP2D6、CYP2A6、CYP3A4可能参与了黄连碱的代谢,而CYP1A2、CYP2C9、CYP2C19、CYP2E1未参与黄连碱的代谢。结合文献报道[18],黄连碱表现出很强的浓度依赖性的对CYP2D6的抑制作用,对CYP1A2具有抑制作用,对CYP2C9具有活化作用,这对阐明参与药物代谢的酶,评价药物与代谢酶间的相互作用,为预测药物相互作用和药物代谢多态性以及指导临床合理用药提供理论依据。
本研究为黄连碱的体内代谢及药物相互作用研究提供参考依据。
[1]Lee M K,Lee K S,Kim H S,etal.Inhibitory effects of coptisine onmonoamine oxidase activity[J].Nat Prod Sci,2000,2(6):70-72.
[2]Ro JS,Lee S S,Lee K S,et al.Inhibition of type A monoamine oxidase by coptisine inmouse brain[J].Life Sci,2001,70(6):639-645.
[3]Tanabe H,SuzukiH,Nagatsu A,etal.Selective inhibition of vascular smooth muscle cell proliferation by coptisine isolated from Coptis rhizoma,one of the crude drugs composing Kampo medicines Unsei-in[J].Phytomedicine,2006,13(5):334-342.
[4]Suzuki H,Tanabe H,Mizukami H,et al.Selective regulation of multidrug resistance protein in vascular smooth muscle cells by the soquinoline alkaloid coptisine[J].Biol Pharm Bull,2010,33(4):677-682.
[5]KongW J,Zhao Y L,Xiao X H,et al.Investigation of the anti-fungal activity of coptisine on Candida albicans growth by microcalorimetry combined with principal component analysis[J].JAppl Microbiol,2009,107(4):1072-1080.
[6]Li H L,Han T,Liu R H,et al.Alkaloids from Corydalis saxicola and their anti-hepatitis B virus activity[J].Chem Biodivers,2008,5(5):777-783.
[7]Guo J,Wang S B,Yuan T Y,et al.Coptisine protects rat heart against myocardial ischemia/reperfusion injury by suppressingmyocardial apoptosis and inflammation[J].Atherosclerosis,2013,231(2):384-391.
[8]Lee JW,Iwahashi A,Hasegawa S,et al.Coptisine inhibits RANKL-induced NF-jB phosphorylation in osteoclast precursors and suppresses function through the regulation of RANKL and OPG gene expression in osteoblastic cells[J].J Nat Med,2012,66(1):8-16.
[9]李 峰,张 浩,华 桦,等.黄连碱对应激所致小鼠胃黏膜损伤的保护作用[J].华西药学杂志,2007,22(26):713.
[10]Hirano H,Osawa E,Yamaoka Y,etal.Gastric-mucousmembrane protection activity of coptisine derivatives[J].Biol Pharm Bull,2001,24(11):1277-1281.
[11]Jung H A,Yoon NY,Bae H J,etal.ChoiInhibitory activities of the alkaloids from Coptidis Rhizoma against aldose reductase[J].Arch Pharm Res,2008,31(11):1405-1412.
[12]Gong L L,Fang L H,Wang S B,et al.Coptisine exert car dioprotective effect through anti-oxidative and inhibition of RhoA/Rho kinase pathway on isoproterenol-induced myocardial infarction in rats[J].Atherosclerosis,2012,222(1):50-58.
[13]Lin C C,Ng L T,Hsu F F,et al.Cytotoxic effects of Coptis chinensis and Epimedium sagittatum extracts and their major constituents(berberine,coptisine and icariin)on hepatoma and leukaemia cell growth[J].Clin Exp Pharmacol Physiol,2004,31(1-2):65-69.
[14]Daly A K.Pharmacogenetics of the cytochromes P450[J]. Curr Top Med Chem,2004,4(16):1733-1744.
[15]Lewis D F.Structures and oxidativemetabolism of xenobiotics[J].Pharmacogeno Mics,2003,4(4):387-395.
[16]Xia Z L,Ying J Y,Sheng R,et al.In vitro metabolism of BY2X in human liver microsomes and the structural elucidation ofmetabolite by liquid chromatography-mass spectrometrymethod[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,857(2):266-274.
[17]陈健龙,张玉玲,董 宇,等.小檗碱的酶反应动力学及其代谢酶表型和代谢产物研究[J].中草药,2013,13(44):3334-3340.
[18]Han Y L,Yu H L,LiD,etal.In vitro Inhibition of Huanglian[Rhizoma coptidis(L.)]and its six active alkaloids on six cytochrome P450 Isoforms in human livermicrosomes[J].Phytother Res,2011,25(11):1660-1665.
M etabolism of coptisine in human liver m icrosomes
LIU Qian1, CHEN Long-long1, MA Shuang-cheng2, ZHANG Zu-yan1, LIYun-hua1, QIAN Yong3,GU Jun4, XIE Tian-pei3*
(1.Shanghai Hufeng Biotech Co.,Ltd,Shanghai 200433,China;2.National Institutes for Food and Drug Control,Beijing 100050,China;3. Shanghai Standard Biotech Co.,Ltd,Shanghai 201203,China;4.Wadsworth Center,Albany,NY 12201,USA)
AIMTo study themetabolism of coptisine in human livermicrosomes.M ETHODSThe enzyme kinetic parameters of coptisine in human livermicrosomes were calculated through enzyme kinetics.The exclusive CYP450 inhibitorswere used to investigate their inhibitory effects on the metabolism of coptisine,and HPLC-MS/ MSwas used to speculate and analyze the structure of CYP450 isoenzymes responsive to these reactions.RESULTSThe Km,Vmaxand CLintof coptisine in human livermicrosomes were 6.802 7μmol/L,0.054 76 nmol/(mg protein·min)and 0.008 mL/(mg·min),respectively.Quinine,8-methoxypsoralen and ketoconazole partly inhibited themetabolism of coptisine.Onemetabolite was formed by demethylene group from coptisine.CONCLUSIONIt is demonstrated that CYP2D6,CYP2A6 and CYP3A4 are responsible for the metabolism of coptisine in human livermicrosomes.The metabolite is demethylene coptisine.
coptisine;human livermicrosomes;enzyme kinetic;metabolites
R966
A
1001-1528(2015)04-0689-05
10.3969/j.issn.1001-1528.2015.04.002
2014-05-18
上海市国际科技合作基金项目 (12430700200)
刘 倩(1978—),女,博士,研究方向为中药化学和代谢。Tel:13917735267,E-mail:liuqian01101@163.com
*通信作者:谢天培(1962—),男,博士,研究方向为中药物质基础。Tel:(021)51320033,E-mail:tam@nature-standard.com
日期:2014-12-01
网络出版地址:http://www.cnki.net/kcms/detail/31.1368.R.20141201.1536.001.htm l