典型环亚胺类毒素大气压化学电离质谱分析
王艳龙,陈军辉,李兆永,王 帅,郑晓玲,王小如,2
(1.国家海洋局第一海洋研究所,海洋生态研究中心,山东 青岛 266061;2.厦门华夏职业学院,福建 厦门 361024)
环亚胺类毒素(cyclic imines,CIs)是一类海洋脂溶性藻毒素,其特点是均含有环状亚胺结构,主要包括以下几类化合物:Spirolides(SPXs)、Gymnodimines(GYMs)、Pinnatoxins(PnTxs)、Pteriatoxin(PtTxs)、Prorocentrolides和Spiro-prorocentrimine等[1]。环亚胺类毒素可使神经产生急性中毒,最大的毒性特点是对动物快速致死。虽然现在还没有关于环亚胺类毒素造成人类中毒的报道,但是欧洲食品安全局已经要求用更多的环亚胺类毒素数据来评估其给贝类消费者带来的健康风险[2]。GYMs和SPXs是最具代表性、也最为常见的环亚胺类毒素,近年来在世界不同地区的贝类、浮游生物以及海洋环境中均有发现[3-9]。由此可见,环亚胺类毒素对人类健康的潜在威胁不容忽视,研发环亚胺类毒素的有效检测方法非常必要。
自20世纪90年代GYMs和SPXs被发现以来,根据它们快速致死的特征,小鼠生物活体测定方法[10]一直被用于该类毒素的检测。为了解决小鼠生物活体测定法存在假阳性结果和无法准确定量等问题,液相色谱法[11]、根据分子之间相互作用的受体检测法[12-13]和液相色谱-电喷雾质谱联用法[9,14]等开始逐渐用于典型环亚胺类毒素的检测。质谱作为检测器,具有灵敏度高、选择性好,以及可以提供待测物结构信息等优点,在海洋藻毒素检测领域展现出了广阔的应用前景。然而,电喷雾质谱法(ESI-MS)在测量基质复杂的样品时容易受到基质的干扰[15],造成测量结果偏差较大;而大气压化学电离(APCI)是另一种软电离技术,与ESI-MS技术相比,其抗基质干扰能力较强[16],常用于ESI-MS检测效果不佳的弱极性化合物的检测。目前,采用大气压化学电离质谱法(APCI-MS)对环亚胺类毒素进行检测的研究还未见报道。
本研究拟采用大气压化学电离-离子阱质谱(APCI-IT-MS)技术对2种典型环亚胺类毒素(GYM和SPX1)的一级、多级质谱特征进行研究,与ESI-MS法进行抗基质干扰能力比较,并对液相色谱-大气压化学电离质谱法(LC-APCI-MS2)检测GYM和SPX1的方法重复性、稳定性等进行考察,以期为LC-APCI-MS2法测定环亚胺类毒素提供实验依据。
1 实验部分
1.1 仪器、试剂及材料
1200型高效液相色谱仪:美国Agilent公司产品,配有四元泵、DAD检测器、自动进样器等;6320型离子阱质谱仪:美国Agilent公司产品,配有ESI离子源和APCI离子源;Milli-Q超纯水处理系统:美国Millipore公司产品;KQ-400KDE型高功率数控超声波仪:昆山市超声仪器有限公司产品;R201型旋转蒸发仪:上海申生科技有限公司产品;氮吹仪:安谱公司产品;Himac CR22GII高速冷冻离心机:日本HITACHI公司产品。
环亚胺类毒素标准溶液GYM 和SPX1:加拿大国家海洋研究中心产品;甲醇、乙腈(色谱纯):美国Tedia公司产品;氨水(质谱纯):瑞士Fluka公司产品;超纯水:由Milli-Q超纯水系统制得。
沉积物样品:于2012年5月28日采自杭州湾海域,保存于-20 ℃冰箱中;海水样品:采自青岛市近岸海域,保存于4 ℃冰箱中;赤潮藻样品:本实验室培养的利玛原甲藻;贝类样品(紫贻贝):购自青岛水产品市场,购买后立即低温运回实验室,于-20 ℃冷冻保存。
1.2 标准溶液的配制
取0.5 mL标准品各1瓶,用甲醇稀释并定容至5 mL,得250.1 μg/L GYM和7 053 μg/L SPX1的标准储备液(单标);然后用甲醇稀释成5.003 μg/L GYM和56.42 μg/L SPX1的混合标准溶液。所有标准溶液于-20 ℃保存,备用。
1.3 实验条件
1.3.1色谱条件 ZORBAX Extend-C18色谱柱(3 mm×150 mm×3.5 μm);流动相:A为水,B为甲醇;洗脱梯度:0~5~22~27 min,20%B~64%B~100%B~20%B;流速0.4 mL/min;进样体积10 μL;柱温:室温(20~23 ℃)。
1.3.2APCI-MS条件 正离子模式,质量扫描范围m/z100~1 300,雾化气压力4.14×105Pa,干燥气流速5 L/min,干燥气温度350 ℃,气化室温度400 ℃,毛细管电压4 kV,裂解电压143.5 V,锥孔电压40 V。进行LC-APCI-MS2分析时,离子源各参数不变,采用多反应监测(MRM)模式对目标化合物进行质谱分析。GYM以m/z508 [M+H]+峰为母离子,m/z490的二级子离子[M-H2O+H]+峰为定量离子,碰撞能量为1 V;SPX1以m/z692 [M+H]+峰为母离子,m/z674的二级子离子[M-H2O+H]+峰为定量离子,碰撞能量为1 V。
1.3.3ESI-MS条件 正离子模式,质量扫描范围m/z100~1 300,雾化气压力2.76×105Pa,干燥气流速11 L/min,干燥气温度350 ℃,毛细管电压4 kV,裂解电压143.5 V,锥孔电压40 V。
1.4 基质样品溶液的制备
空白沉积物样品提取液、空白海水样品提取液、空白赤潮藻提取液和空白贝类组织提取液的制备方法参照文献[17-20]。所有的样品提取液经0.22 μm尼龙纤维滤膜过滤至液相进样小瓶中,于-20 ℃条件下避光保存,待用。
取4份200 μL毒素混合标准溶液,将按上述方法制备的4种不同类型的空白样品基质粗提液稀释并定容至1 mL,配制成基质标准溶液。GYM、SPX1在不同基质标准溶液中的浓度均为1.001 μg/L和11.28 μg/L。
1.5 方法学考察
1.5.1精密度 取GYM和SPX1混合标准溶液,按1.3节条件重复测定6次,得到GYM和SPX1提取离子峰的峰面积和保留时间。计算GYM和SPX1峰面积和保留时间的相对标准偏差(RSD),用于评价仪器的精密度。
1.5.2专属性 在优化的实验条件下,测定甲醇(溶剂空白)、不同空白基质样品溶液和不同基质标准溶液,通过对比空白基质样品溶液与基质标准溶液的检测结果,评价该方法的专属性。
1.5.3基质效应 为了评价4种不同类型样品中基质对目标化合物质谱分析的影响,取按1.4节方法配制的4种不同类型样品基质标准溶液,通过MS2分析,将测得的各目标化合物峰面积与同一浓度水平甲醇配制的混合标准溶液作对比,来确定4种不同类型样品中基质对各目标化合物的抑制作用。
1.5.4重复性和稳定性 制备6个每种样品基质标准溶液的平行样品,按1.3节条件进行分析,得到各化合物提取离子峰的峰面积,根据峰面积相对标准偏差确定该方法的重复性。测定后的样品溶液置于4 ℃冰箱中保存,并分别在0、8、24、48、96 h后再进样测定,得到各化合物的峰面积,以各峰面积的RSD值作为样品溶液稳定性评价指标。
2 结果与讨论
2.1 APCI质谱分析特征
2.1.1APCI-MS分析特征 采用APCI正负切换全扫描模式对GYM和SPX1标准品进行分析,结果发现,这两种典型环亚胺类毒素只在APCI+模式下有质谱响应,APCI-模式下并没有质谱信号。GYM和SPX1在APCI+模式下形成的准分子离子[M+H]+峰(基峰)分别为m/z508和m/z692,在一级质谱检测过程中未发现[M+Na]+和[M+NH4]+峰等,其一级质谱图示于图1。GYM和SPX1在APCI+模式下与在ESI+模式下的一级质谱图基本一致。文献[21-22]采用ESI离子源进行GYM和SPX1质谱分析,在ESI+模式下,GYM和SPX1也均生成准分子离子[M+H]+峰(基峰)。
2.1.2APCI-MSn分析特征及裂解规律 在一级质谱分析的基础上,分别以m/z508和m/z692离子峰作为母离子,对GYM和SPX1进行APCI多级质谱分析,结果示于图2和图3。

图1 GYM(a)和SPX1(b)大气压化学电离质谱的一级质谱图Fig.1 MS spectra of GYM (a) and SPX1 (b) by APCI-MS

图2 GYM大气压化学电离质谱的二级(a)和三级(b)质谱图Fig.2 MS2 (a) and MS3 (b) spectra of GYM by APCI-MS

图3 SPX1大气压化学电离质谱的二级(a)和三级(b)质谱图Fig.3 MS2 (a) and MS3 (b) spectra of SPX1 by APCI-MS
GYM的APCI-MS2分析结果主要得到m/z490子离子峰(基峰),推测为准分子离子m/z508失去一分子水([M+H-H2O]+)所形成,由于m/z490子离子峰的丰度高、稳定性好,故在GYM分析中被选为定量离子。除m/z490外,还可以观察到丰度很低的m/z410子离子峰,推测为母离子m/z508失去碎片-C5H6O2所形成。
选择m/z490子离子峰进行APCI-MS3分析,可以看出,m/z392子离子峰丰度最高,同时形成m/z472、462、446、378、162等碎片离子峰。推测m/z392离子为m/z490离子峰失去碎片-C5H6O2所形成,m/z378离子为m/z392继续失去中性碎片-CH2所形成,m/z472离子为m/z490离子峰失去一分子水所形成,m/z462离子为m/z490离子峰失去碎片-CO所形成,m/z446离子为m/z490离子峰失去中性碎片-CO2所形成。m/z162离子应为文献[23-24]中指出的含有环亚胺结构的碎片离子,其裂解途径示于图4a。

图4 GYM(a)和SPX1(b)的裂解途径Fig.4 Fragment pathways of GYM (a) and SPX1 (b)
从图3可以看出,SPX1在APCI-MS2分析中主要得到一系列失水碎片离子,分别为m/z674([M+H-H2O]+)、m/z656([M+H-2H2O]+)和m/z638([M+H-3H2O]+)等。同时还形成了丰度较低的碎片离子m/z426,推测为准分子离子m/z692丢失中性碎片-C15H22O3后再失去一分子水形成的,其裂解途径示于图4b。选取二级质谱图上丰度最大的m/z674离子作为三级质谱分析的母离子,可以看出,裂解得到的仍是一系列失水碎片离子(m/z656、638和620)。
2.2 LC分离条件及APCI-MS灵敏度考察
乙腈-水和甲醇-水是环亚胺类毒素LC分离时常用的流动相,本实验比较了乙腈-水和甲醇-水作为流动相时,GYM和SPX1的色谱分离效果。结果表明,使用这两种流动相时,GYM和SPX1的分离效果相似,但为了降低APCI离子源电晕放电针上的积碳效应,选择了甲醇-水作为流动相。在此基础上,对LC-APCI-MS和LC-ESI-MS分析GYM和SPX1标准品(浓度分别为1.001 μg/L和11.28 μg/L)的灵敏度进行比较,结果示于图5。两种毒素在APCI条件下的EIC色谱峰信噪比(S/N)优于ESI条件下的信噪比。由于信噪比的提高,使得两种毒素在APCI条件下的检出限(GYM和SPX1分别为1.00 pg和5.64 pg)比ESI条件下的检出限(GYM和SPX1分别为5.00 pg和28.2 pg)降低了大约5倍。
2.3 LC-APCI-MS2方法学考察
2.3.1基质效应 在LC/MS2分析复杂基质样品的过程中,与分析物共流出的基体中内生化合物对MS2检测灵敏度有重要的影响[22],在很大程度上,基质效应与提取物类型有关[25]。本研究选取4种不同类型样品基质,考察了LC-APCI-MS2方法检测GYM和SPX1的抗基质干扰能力,并与LC-ESI-MS2方法进行比较,结果列于表1。可以看出,虽然不同样品基质均能对目标化合物产生不同程度的基质影响,但APCI条件下产生的基质效应比ESI条件下产生的影响小,这更有利于目标化合物的准确测定。本研究的目的是探明典型环亚胺类毒素APCI-MS的分析特征,因此,并没有针对不同样品基质的特点优化色谱分离条件。在将APCI-MS2应用于实际样品分析时,可在本研究的基础上,进一步优化色谱分离条件,最大程度的降低样品基质影响,以获得最佳的检测灵敏度和准确度。

注:a.GYM,ESI+;b.SPX1,ESI+;c.GYM,APCI+;d.SPX1,APCI+图5 GYM和SPX1的LC-APCI/ESI-MS提取离子流图Fig.5 EICs of GYM and SPX1 by LC-APCI/ESI-MS
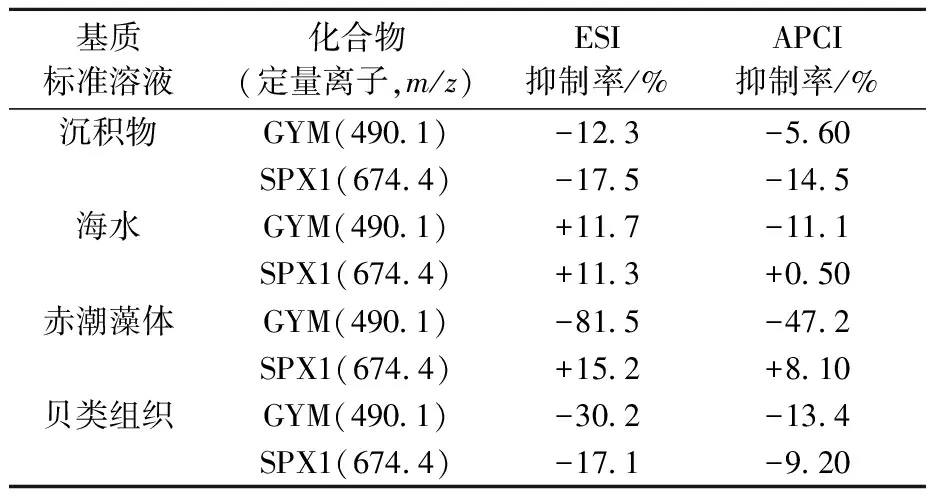
基质标准溶液化合物(定量离子,m/z)ESI抑制率/%APCI抑制率/%沉积物GYM(4901)-123-560SPX1(6744)-175-145海水GYM(4901)+117-111SPX1(6744)+113+050赤潮藻体GYM(4901)-815-472SPX1(6744)+152+810贝类组织GYM(4901)-302-134SPX1(6744)-171-920
注:+表示信号增强;-表示信号抑制
2.3.2专属性 采用1.3节条件对试剂空白(甲醇)、不同样品空白和不同基质标准溶液进行测定,结果表明(以沉积物基质为例),在试剂空白和不同样品空白中均未检测出相应的毒素,而在基质标准溶液中检测出了GYM和SPX1,结果示于图6,说明本方法具有良好的专属性。
2.3.3精密度、重复性和稳定性 精密度实验结果显示,GYM和SPX1化合物的峰面积RSD不大于4.25%,保留时间RSD不大于0.24%,说明仪器具有较好的精密度。APCI条件下,4种不同基质中两种毒素的峰面积RSD均小于10.0%,表明该方法的重复性和稳定性良好,能满足不同基质样品中SPX1和GYM藻毒素同步测定的要求,结果列于表2。

图6 LC-APCI-MS2分析沉积物基质标准溶液的TIC(a)和EICs(GYM(b)和SPX1(c))图 Fig.6 TIC (a) and EICs (GYM (b) and SPX1 (c)) of spiked marine sediment sample by LC-APCI-MS2

表2 LC-APCI-MS2分析重复性和稳定性的实验结果(n=6)Table 2 Results of repeatability and stability by LC-APCI-MS2 (n=6)
3 结论
本研究解析了2种典型环亚胺类毒素(GYM和SPX1)在APCI条件下的一级和二级质谱特征以及多级质谱裂解规律。实验表明,APCI-MS法的灵敏度和抗基质干扰能力均好于ESI-MS法,说明APCI-MS法更适于典型环亚胺类毒素的分析。此外,采用LC-APCI-MS2法分析沉积物、海水、赤潮藻以及生物体基质样品,均能获得良好的方法专属性、重复性和稳定性,这为发展LC-APCI-MS2法定性、定量分析不同基质复杂样品中环亚胺类毒素打下了良好的实验基础。后续工作可在本研究的基础上,针对不同样品的特点,采取合适的样品前处理方法,以开发APCI-MS分析不同类型样品中典型环亚胺类生物毒素的有效方法。
[1] OTERO A, CHAPELA M J, ATANASSOVA M, et al. Cyclic imines: Chemistry and mechanism of action: A review[J]. Chemical Research in Toxicology, 2011, 24(11): 1 817-1 829.
[2] ALEXANDER J, BENFORD D, BOOBIS A, et al. Scientific opinion on marine biotoxins in shellfish-Cyclic imines (spirolides, gymnodimines, pinnatoxins and pteriatoxins)[J]. Journal of European Food Safety Authority, 2010, (8): 1 628-1 887.
[3] TOUZET N, FRANCO J M, RAINE R. Morphogenetic diversity and biotoxin composition of Alexandrium (Dinophyceae) in Irish coastal waters[J]. Harmful Algae, 2008, 7(6): 782-797.
[5] AMZIL Z, SIBAT M, ROYER F, et al. Report on the first detection of pectenotoxin-2, spirolide-A and their derivatives in French shellfish[J]. Marine Drugs, 2007, 5(4): 168-179.
[6] MACKINNON S L, CEMBELLA A D, BURTON I W, et al. Biosynthesis of 13-desmethyl spirolide C by the dinoflagellate alexandrium ostenfeldii[J]. The Journal of Organic Chemistry, 2006, 71(23): 8 724-8 731.
[7] KHARRAT R, SERVENT D, GIRARD E, et al. The marine phycotoxin gymnodimine targets muscular and neuronal nicotinic acetylcholine receptor subtypes with high affinity[J]. Journal of Neurochemistry, 2008, 107(4): 952-963.
[8] BIR R, KRYS S, FRMY J M, et al. First evidence on occurrence of gymnodimine in clams from Tunisia[J]. Journal of Natural Toxins, 2002, 11(4): 269-275.
[9] AASEN J, MACKINNON S L, LEBLANC P, et al. Detection and identification of spirolides in Norwegian shellfish and plankton[J]. Chemical Research in Toxicology, 2005, 18(3): 509-515.
[10] MUNDAY R, TOWERS N R, MACKENZIE L, et al. Acute toxicity of gymnodimine to mice[J]. Toxicon, 2004, 44(2): 173-178.
[11] MARROUCHI R, DZIRI F, BELAYOUNI N, et al. Quantitative determination of gymnodimine-A by high performance liquid chromatography in contaminated clams from Tunisia coastline[J]. Marine Biotechnology, 2010, 12(5): 579-585.
[12] VILARIO N, FONFRA E S, MOLGO J, et al. Detection of gymnodimine-A and 13-desmethyl C spirolide phycotoxins by fluorescence polarization[J]. Analytical Chemistry, 2009, 81(7): 2 708-2 714.
[13] RODRGUEZ L P, VILARIO N, MOLGO J, et al. Solid-phase receptor-based assay for the detection of cyclic imines by chemiluminescence, fluorescence, or colorimetry[J]. Analytical Chemistry, 2011, 83(15): 5 857-5 863.
[14] GARCA-ALTARES M, CASANOVA A, BANE V, et al. Confirmation of pinnatoxins and spirolides in shellfish and passive samplers from catalonia (Spain) by liquid chromatography coupled with triple quadrupole and high-resolution hybrid tandem mass spectrometry[J]. Marine Drugs, 2014, 12(6): 3 706-3 732.
[15] SCHUHMACHER J, ZIMMER D, TESCHE F, et al. Matrix effects during analysis of plasma samples by electrospray and atmospheric pressure chemical ionization mass spectrometry: Practical approaches to their elimination[J]. Rapid Communications in Mass Spectrometry, 2003, 17(17): 1 950-1 957.
[16] ISMAIEL O A, HALQUIST M S, ELMAMLY M Y, et al. Monitoring phospholipids for assessment of ion enhancement and ion suppression in ESI and APCI LC/MS/MS for chlorpheniramine in human plasma and the importance of multiple source matrix effect evaluations[J]. Journal of Chromatography B, 2008, 875(2): 333-343.
[17] MENDOZA W G, MEAD R N, BRAND L E, et al. Determination of brevetoxin in recent marine sediments[J]. Chemosphere, 2008, 73(8): 1 373-1 377.
[18] LI X, LI Z Y, CHEN J H, et al. Detection, occurrence and monthly variations of typical lipophilic marine toxins associated with diarrhetic shellfish poisoning in the coastal seawater of Qingdao City, China[J]. Chemosphere, 2014, (111): 560-567.
[19] SUZUKI T, BEUZENBERG V, MACKENZIE L, et al. Discovery of okadaic acid esters in the toxic dinoflagellate Dinophysis acuta from New Zealand using liquid chromatography/tandem mass spectrometry[J]. Rapid Communications in Mass Spectrometry, 2004, 18(10): 1 131-1 138.
[20] 母清林,方杰,万汉兴,等. 液相色谱-串联质谱法检测贝类产品中腹泻性贝类毒素[J]. 分析化学,2011, 39(1):111-114.
MU Qinglin, FANG Jie, WAN Hanxing, et al. Determination of diarrhetic shell fish poisoning in shell fishes by liquid chromatography with tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2011, 39(1): 111-114(in Chinese).
[21] DOM NECH A, CORTS-FRANCISCO N, PALACIOS O, et al. Determination of lipophilic marine toxins in mussels. Quantification and confirmation criteria using high resolution mass spectrometry[J]. Journal of Chromatography A, 2014, (1 328): 16-25.
[22] GERSSEN A, MULDER P P, MCELHINNEY M A, et al. Liquid chromatography-tandem mass spectrometry method for the detection of marine lipophilic toxins under alkaline conditions[J]. Journal of Chromatography A, 2009, 1 216(9): 1 421-1 430.
[23] GERSSEN A, MCELHINNEY M A, MULDER P P, et al. Solid phase extraction for removal of matrix effects in lipophilic marine toxin analysis by liquid chromatography-tandem mass spectrometry[J]. Analytical and Bioanalytical Chemistry, 2009, 394(4): 1 213-1 226.
[24] REGUEIRO J, ROSSIGNOLI A E,LVAREZ G, et al. Automated on-line solid-phase extraction coupled to liquid chromatography-tandem mass spectrometry for determination of lipophilic marine toxins in shellfish[J]. Food Chemistry, 2011, 129(2): 533-540.
[25] KILCOYNE J, FUX E. Strategies for the elimination of matrix effects in the liquid chromatography tandem mass spectrometry analysis of the lipophilic toxins okadaic acid and azaspiracid-1 in molluscan shellfish[J]. Journal of Chromatography A, 2010, 1 217(45): 7 123-7 130.

