一种艰难梭菌类毒素A的制备方法
代文秀 邓卉卉 何菁荣 张祎 杨战利 傅思武
摘要:目的 探索一种制备艰难梭菌类毒素A的方法。方法 艰难梭菌VPI 10463菌株经透析培养后纯化取得A毒素,再用甲醛脱毒即获得艰难梭菌类毒素A。结果 制备的类毒素具有良好的免疫原性,不具备细胞毒性。结论 该法具有可行性、简便性,并具有重要的临床应用价值。
关键词:艰难梭菌;A毒素;类毒素
中图分类号:R378.8 文献标识码:A
Abstract: Objective To explore a method for preparing Clostridium difficile toxoid A. Methods Clostridium difficile VPI 10463 strain was cultured by dialysis and purified to obtain toxin A, and then detoxified with formaldehyde to obtain Clostridium difficile toxoid A. Results The prepared toxoid has good immunogenicity and no cytotoxicity. Conclusion The method is feasible, simple, and has important clinical application value.
Keywords: Clostridium difficile; toxin A; toxoid
艰难梭菌(Clostridium difficile,CD)为革兰阳性芽胞杆菌 [1]。抗生素滥用破坏肠道微生态平衡,艰难梭菌大量增殖产毒,导致艰难梭菌感染(CDI)[2]。研究表明,艰难梭菌A毒素在艰难梭菌致病过程起着重要作用。随着高致病菌株的出现及菌株耐药性的增加,CDI发病率逐年上升。由于缺乏有效疫苗,CDI防治仍是一个棘手的难题。外毒素用0.4%甲醛处理,脱去毒性而保留免疫原性,可得类毒素。其人工主动免疫刺激机体可产生中和外毒素的抗体。因此艰难梭菌类毒素A的制备为艰难梭菌疫苗和抗体的制备提供了物质基础。
基金项目:本科生科研创新项目(XBMU-BYL19186)
作者简介:代文秀(1999-),女,西北民族大学医学部本科生,E-mail:2658356368 @qq.com
通信作者:傅思武(1967-),男,教授,医学博士,从事微生态制品研究,E-mail:yxfsw@xbmu.edu.cn
1材料与方法
1.1材料 艰难梭菌VPI 10463菌株,Vero细胞,SSCM培养基,BHI培养基,低温离心机,CO2恒温培养箱,BioLogic DuoFlow 系统,紫外线分光光度计,酶标仪,SPF级雌性BALB/C小鼠。
1.2方法
1.2.1培养及纯化 同文献[3,4],Cd 10463于SSCM培养基中增菌,按5%接种于BHI培养基中培养。培养液离心取上清液,50%飽和硫酸铵盐析后再次离心,取沉淀并溶解,透析后离心取沉淀。沉淀如上处理,再次离心取上清。将A毒素样品加入DEAE-Toyopearl 650M 色谱柱,待其完全进入胶体开始洗脱,按A280吸收峰收集洗脱液,透析24h,离心取沉淀,即为纯化的艰难梭菌A毒素。
1.2.2蛋白浓度测定 参考文献[5],采用考马斯亮蓝染色测蛋白法,以牛血清白蛋白为标准品建立标准曲线,用分光光度计测定OD595nm。
1.2.3类毒素制备 A毒素加入甲醛溶液至终浓度为0.4%,37℃放置7-14天,脱毒,最终得到艰难梭菌类毒素A。
1.2.4类毒素检测
1.2.4.1无菌实验 将类毒素A接种于BHI培养基,37℃培养96h,涂片,革兰染色后镜检,观察有无细菌生长。
1.2.4.2细胞毒性测定 将类毒素A作10倍系列稀释,取103、104、105、106四个稀释度,分别接种于长满良好单层Vero 细胞的96 孔细胞培养板中,每个稀释度接种6 孔,0.1mL/孔,另设6 孔只接种稀释液作空白对照,0.1ml/孔。37℃培养1周,每天观察各孔细胞病变情况。
1.2.5小鼠免疫及血清IgG测定 取24只20±2g的SPF级雌性BALB/C小鼠,随机分为2组,每组12只。一组小鼠分别腹腔注射10μg生理盐水作空白对照,另一组分别腹腔注射10μg类毒素A作实验组,两组分别于0d、7d、14d、28d、42d进行免疫。于7d、14d、28d、42d尾静脉采血、收集血清样品,采用间接ELISA法,测OD450来反映血清中特异性IgG含量。
1.3统计方法 采用SPSS 19.0,正态分布的连续变量以表示,两组之间比较采用t检验,检验水准α=0.05。
2结果
2.1蛋白含量:标准曲线方程为y=0.0106x+0.0904。测得纯化后A毒素的吸光度为0.103,因而浓度为1.189mg/ml。
2.2类毒素检测
2.2.1无菌实验:在严格无菌操作下,类毒素A接种于BHI培养基后无细菌生长。
2.2.2细胞毒性测定:在适宜条件下无菌培养1周,各稀释度及空白对照组无明显细胞病变。
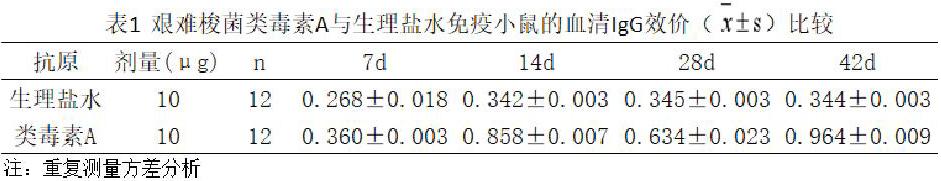
2.3血清IgG测定
3讨论
艰难梭菌为肠道正常菌群成员之一,菌群失调可导致CDI。其主要引起抗生素相关性腹泻、伪膜性肠炎、中毒性巨结肠等病变。[6]目前CDI的治疗有抗菌药物、益生菌制剂、内溶素及免疫疗法等。事实上这些方法仍不能有效防治CDI,因此疫苗研发十分重要。
艰难梭菌为专性厌氧菌,培养困难,而透析培养不使用厌氧培养设备,使培养简化、易行。该法在离子交换层析前采用盐析与酸沉处理,有效去除杂蛋白,减少纯化过程蛋白的降解与损耗,且此法将层析介质由DEAE-Sepharose CL 6B改为DEAE-Toyopearl 650M,分离效果更佳。此外本法操作简单、设备简易、重复性好,可大批量制备艰难梭菌类毒素A。
经甲醛处理后的艰难梭菌A毒素,无菌实验与细胞毒性测定均为阴性,表明制备的艰难梭菌类毒素A无毒性,安全试验合格。如表1,每次所测IgG效价()实验组均大于对照组,且P值均<0.05,表示类毒素A能刺激机体发生免疫应答并产生抗体,说明类毒素A具有明显的免疫原性。综上所述,类毒素A无毒但具备免疫原性,该艰难梭菌类毒素A的制备方法可行、简便且有效。
参考文献
[1]Leuzzi R , Adamo R , Scarselli M . Vaccines against Clostridium difficile[J]. Human Vaccines & Immunotherapeutics, 2014, 10(6):1466-1477.
[2]Etienne-Mesmin L . Clostridium difficile : la belle et la bête[J]. Medecine ences: M/S, 2017, 33(10):825-828.
[3]傅思武,周殿元.艱难梭菌A毒素的纯化[J].中国生化药物杂志,2004(02):86-88.
[4]傅思武, 艰难梭菌B毒素的纯化及其生物学活性鉴定. 甘肃省,西北民族大学,2012-04-06
[5]祝连彩,唐士金,周丽.考马斯亮蓝G 250法测定蛋白质含量的教学实践及方法学探讨[J].教育教学论坛,2020(23):266-269.
[6]Nunzia DUrzo, Malito E , Biancucci M , et al. The structure of Clostridium difficile toxin A glucosyltransferase domain bound to Mn2+ and UDP provides insights into glucosyltransferase activity and product release.[J]. Febs Journal, 2012, 279(17).
西北民族大学医学部,甘肃兰州 730030

