谷胱甘肽的合成与其活性初步评价
代 涛,李松涛,赵红玲,王小青,王良友
河北省中药研究与开发重点实验室 承德医学院中药研究所,承德 067000
谷胱甘肽是广泛存在于生物细胞内,具有重要生理功能的天然活性肽。其在体内以两种形态存在,还原型谷胱甘肽(γ-GSH,2)和氧化型谷胱甘肽(GSSG,3),还原型谷胱甘肽由L-谷氨酸、L-半胱氨酸及甘氨酸组成,氧化型谷胱甘肽是由两分子2 的巯基(-SH)经氧化脱氢得到,其化学结构式见图1。在机体中大量存在并起主要作用的是还原型谷胱甘肽,但两者可在酶的作用下相互转化,有报道3 对2清除自由基有协同作用[1]。现都成为效果较好的药物。因其较好的抗氧化,清除自由基作用,现已广泛应用于医疗、保健品、食品工业、化妆品等领域[2-4]。
药理学研究表明,2 中的巯基(-SH)是发挥抗氧化等作用的活性位点,故将其结构中的γ-谷氨酸替换为α-谷氨酸,得到2 的类似物α-GSH(1),其化学结构式见图1。动物实验表明,其也有较好的抗氧化,清除自由基作用。
目前对于2 的制备方法的研究,国内外报道的主要有溶剂提取法、酶合成法、液相合成法、发酵法[5-9]。其中溶剂提取法生产工艺比较落后、生产规模小且产量低,产品质量不高。酶合成法操作较复杂、且需要底物氨基酸和昂贵的ATP,成本高。液相合成法反应步骤多、反应时间长、操作复杂、需光学拆分且产品纯度不高,环境污染严重。缺点都较明显,使用较少,目前工业生产以发酵法为主,但因其所得的目标产物含量不高、提取困难、成本造价高、产率不稳定,生产周期长等原因,应用也受到限制。而1 因其不是体内天然产物,发酵法无法直接获得,合成方法目前报道较少。本研究采用Fmoc 固相多肽合成法,用逐步缩合的方式合成高纯度1、2,再将2 经氧化得高纯度的3,并研究了三者对四氯化碳(CCl4,4)诱导的小鼠急性肝损伤的治疗效果。

图1 三种谷胱甘肽化学结构式和合8 成路线图Fig.1 Structure and synthetic route of 1,2 and 3
1 材料与方法
1.1 仪器与试剂
Agilent Technologies 1200 型高相液相色谱(HPLC,美国Agilent 公司);Newstyle 型反相半制备HPLC(江苏汉邦科技有限公司);Christ 冷冻干燥机(德国);TDL-40B 型大容量离心机(上海安亭科学仪器厂);Heal Force Easy 20 纯水机(香港力康公司);752 型UV 分光光度计(上海光谱仪器有限公司);Agilent Technologies 6310 Ion trap LC/MS(美国Agilent 公司)。
2-氯三苯甲基氯树脂(2-CTC 树脂,替代度1.3 mmol/g,天津南开合成科技有限公司);Fmoc 保护的氨基酸有 Fmoc-Gly-OH,Fmoc-Cys (Trt)-OH,Fmoc-Glu-Ot-Bu-OH,Fmoc-Glu (Ot-Bu)-OH 全部购自成都诚诺新技术有限公司;缩合试剂1-羟基苯并三氮唑(HOBt),N,N-二异丙基碳二亚胺(DIC),N,N-二异丙基乙胺(DIPEA)由苏州天马医药集团有限公司提供;哌啶、甲醇(MeOH)、二氯甲烷(DCM)、N,N-二甲基甲酰胺(DMF)、三氟乙酸(TFA)、苯甲硫醚、乙二硫醇(EDT)、苯甲醚、间甲酚(m-Cresol)、三异丙基硅烷(TIS)、碘(I2)、双氧水(30%H2O2)、无水乙醇、冰乙酸、碳酸氢钠,维生素C 均为分析纯;乙腈(高效液相色谱纯),超纯水,4(CCl4,含量99.5%,批号20120722),1、2 对照品(日本TCI 公司,含量>98.0%),3 对照品(上海源聚生物科技有限公司,进口分装,含量99.0%),注射用还原型谷胱甘肽(2,阳性对照药,上海复旦复华药业有限公司,规格0.6 g),ALT、AST 测定试剂盒(南京建成生物工程研究所)。
雄性清洁级昆明小鼠[体重(20 ±2)g,北京华阜康生物科技有限公司,实验动物生产许可证SCXK(京)2009-0004]。
1.2 还原型谷胱甘肽(1、2)的制备
1.2.1 Fmoc-Gly-CTC Resin 的制备
将3.846 g(5 mmol)2-CTC 树脂两份分别投入反应柱a、b 中,DCM 溶胀0.5 h,抽干。DMF 洗涤(50 mL × 5,每次1 min)后,抽干。将4.460 g(15 mmol)Fmoc-Gly-OH、5.239 mL(30 mmol)DIPEA 两份分别用50 mL DMF 在冰浴下溶解后投入两反应柱中,氮气均匀吹拂,30 ℃反应1.5 h,DMF 洗涤(50 mL × 5,每次1 min),除去过量反应原料,制得Fmoc-Gly-CTC 树脂。两反应柱中分别加入50 mL MeOH 封闭液(体积比为DCM∶MeOH∶DIPEA=80∶15∶5)封闭两次,每次10 min,抽干,DMF 洗涤(50 mL × 5,每次1 min),无水MeOH 洗涤(25 mL ×3,每次10 min),减压干燥至恒重,取少量所得树脂进行替代度检测。由替代度测定方法[10],测得Fmoc-Gly-CTC 树脂替代度分别为0.94 mmol/g,0.93 mmol/g。
1.2.2 Glu(Ot-Bu)-Cys(Trt)-Gly-CTC 与Glu-Ot-Bu-Cys(Trt)-Gly-CTC 树脂的制备
将5.400 g(5 mmol)制备好的Fmoc-Gly-CTC 树脂两份分别加入到反应柱a、b 中,用DCM 溶胀0.5 h,抽干。加入30 mL 20%的哌啶/DMF 溶液,N2均匀吹拂反应15 min,脱除Fmoc 基团,用DMF 洗涤(50 mL × 3,每次1 min),抽干,茚三酮检测阳性。将8.786 g (15 mmol)Fmoc-Cys(Trt)-OH、2.432 g(18 mmol)HOBt、2.787 mL(18 mmol)DIC 两份分别用DMF 在冰浴下溶解,预反应10 min 后,投入两反应柱中,N2吹拂,30 ℃反应2 h 后取少量树脂洗涤后滴加茚检液,检测阴性,反应完全。DMF 洗涤(50 mL × 5,每次1 min),除去多余的氨基酸等。再按照谷胱甘肽的氨基酸序列,用上述方法分别偶联Fmoc-Glu(Ot-Bu)-OH 与Fmoc-Glu-Ot-Bu-OH。
1.2.3 Glu-Ot-Bu-Cys(Trt)-Gly-CTC 树脂的裂解
分别将1.36 g 干燥至恒重的Glu(Ot-Bu)-Cys(Trt)-Gly-CTC 与Glu-Ot-Bu-Cys(Trt)-Gly-CTC 树脂置于两圆底烧瓶中,冰浴搅拌下分别加入13.6 mL经冷冻的TFA-EDT-m-Cresol(体积比为95∶4∶1)裂解液,反应0.5 h 后,逐渐升至室温,于室温下继续反应1.5 h。经粗过滤后将母液倾入120 mL 无水冰乙醚中,析出白色沉淀,4000 rpm 离心5 min,弃去上清液,重复5 次,减压真空干燥至恒重,得粗肽分别为266、289 mg。
1.2.4 1、2 粗品的HPLC 鉴定分析
1、2 粗品进行HPLC 分析,色谱柱为Innoval C18柱(250 mm × 4.6 mm,5 μm);流动相为0.1%TFA/H2O(A),0.1% TFA/5% H2O/CH3CN(B),B相1%~21%,梯度洗脱20 min,流速为0.8 mL/min,检测波长为215 nm,样品浓度为1 mg/mL,进样量5 μL。
1.2.5 1、2 纯品的制备
分别称取干燥至恒重的1、2 粗品各200 mg 分别溶于5 mL 超纯水中,用反相半制备HPLC 分离纯化,半制备柱Hedera ODS-2 反相硅胶柱(250 mm ×10 mm,10 μm)。收集主峰纯度达99%的组分。冷冻干燥,得1、2 纯品130 mg、136 mg。
1.3 3 的制备
1.3.1 3 粗品的制备
1.3.1.1 空气氧化法
将100 mg 2 纯品溶于5 mL 超纯水中,用饱和碳酸氢钠水溶液调pH 6,混匀,恒温摇动(30 ℃),HPLC 监测反应进程,反应72 h 达终点,冰乙酸调pH 3 以终止反应。
1.3.1.2 双氧水氧化法
将100 mg 2 纯品溶于1 mL 超纯水中,用饱和碳酸氢钠水溶液调pH 6,加入0.2 mL、30%的过氧化氢溶液,混匀,恒温摇动(30 ℃),HPLC 监测反应进程,30 min 达到反应终点,冰乙酸调pH 3 以终止反应。
1.3.1.3 碘氧化法
将100 mg 2 纯品溶于1 mL 超纯水中,加入2.758 mL、20 mg/mL 碘的乙醇溶液,使得碘与2 的摩尔比为1∶1.5,混匀,恒温摇动(30 ℃),HPLC 监测反应进程,10 min 达到反应终点,饱和维生素C水溶液除去过量的碘以终止反应。
1.3.2 3 纯品的制备
将1.3.1.3 所得溶液注入反相半制备HPLC中,半制备柱Hedera ODS-2 反相硅胶柱(250 mm ×10 mm,5 μm)。分段收集,合并主峰纯度达98%的组分,减压真空干燥,得3 91.8 mg。取少量干燥至恒重的3 进行HPLC 分析,分析条件同1.2.4。
1.4 1、2 与3 纯品的ESI-MS 分析
分别取1、2 与3 纯品各1 mg 分别溶于1 mL 超纯水中,加少许乙腈,进样5 μL,ESI-MS 分析。
离子阱质谱仪离子源:ESI;电离模式:正/负离子模式;质量扫描范围:m/z 50~1500 amu;毛细管电压:-130.2 V。
1.5 三种谷胱甘肽保肝活性研究
将112 只雄性昆明小鼠随机分为14 组,每组8只,分别作为正常对照组、4(0.1%)致肝损伤模型组,注射用2 对照组(20、40、80 mg/kg),肝损伤+合成1 组(20、40、80 mg/kg),肝损伤+合成2 组(20、40、80 mg/kg),肝损伤+合成3 组(20、40、80 mg/kg)。用生理盐水将购买的注射用2、合成化合物1(α-GSH)、合成化合物2(γ-GSH)、合成化合物3(GSSG)分别配得浓度为0.2%、0.4%、0.8%的溶液,4 配成0.1%的花生油稀溶液。正常组和4 肝损伤模型组以10 mL/kg 剂量连续7 d 腹腔注射生理盐水,其余12 组则以腹腔注射给予等剂量的相应药物。第7 d 给药后,除正常组外各组按20 mL/kg 剂量腹腔注射给予0.1% 4 溶液,动物禁食24 h 后摘眼球取血600~800 μL,现制备血清并测定ALT 和AST 活性[11,12]。对试验数据进行统计学处理,各组间的比较采用两样本均数的t 检验。
2 结果与讨论
2.1 目标产物1、2、3 的表征与图谱
还原型谷胱甘肽1(α-GSH):白色固体,总收率60%,粗品保留时间5.254 min,纯品保留时间5.252 min,ESI-MS m/z:306.5[M-H]-,见图2、图3、图5。
还原型谷胱甘肽2(γ-GSH):白色固体,总收率64%,粗品保留时间5.443 min,纯品保留时间5.394 min,ESI-MS m/z:307.3[M-H]+,见图2、图3、图5。
氧化型谷胱甘肽3(GSSG):白色固体,总收率57%,纯品保留时间7.964 min,ESI-MS m/z:611.7[M-H]-,见图4、图5。

图2 1、2 粗品的HPLC 色谱图Fig.2 HPLC chromatograms of 1 and 2 before purification

图3 1、2 纯品的HPLC 色谱图Fig.3 HPLC chromatograms of 1 and 2 after purification

图4 3 纯品HPLC 色谱图Fig.4 HPLC chromatogram of pureified 3
2.2 合成条件的优化
本研究采用Fmoc 固相合成法合成1、2,在全保护肽合成过程中,选择合适的树脂,缩合剂及替代度对提高纯度、得率十分重要。由于两者肽链较短,故选用了适合短肽合成,且合成速率较快的2-CTC 树脂。缩合试剂选用缩合能力较强,价格低廉的DIC/HOBt 体系。替代度选用较高的1.3 mmol/g,这样不仅可以提高收率,降低成本,还可以避免因替代度过高导致的相邻分子间的相互作用,影响产品的纯度和后处理。

图5 三种谷胱甘肽ESI-MS 分析图谱Fig.5 ESI-MS spectra of 1,2 and 3
在两者合成过程中另一个影响产品纯度和收率的重要因素就是切割条件的选择。
2.2.1 裂解试剂
固相合成中切割反应是在各种酸条件下完成的,一般不同的树脂需要不同的切割试剂,同一树脂也因肽侧链保护基的不同而需要不同的试剂配方,以减少副反应,提高纯度。称取干燥至恒重的2 树脂,室温下以不同配比的裂解试剂反应2 h,结果见表1。结合纯度、收率与成本确定C 配方为较优的裂解试剂,1 树脂裂解效果与之类似。
2.2.2 裂解温度
一般认为,低温可以抑制副反应的发生,适度提高温度可以加快反应速度,但不可过高,否则会使多肽降解,副反应增多,严重影响产品纯度。本实验选用不同裂解温度进行试验,发现先将树脂在冰浴条件下裂解0.5 h 后,再缓慢升至室温(30 ℃),较直接于室温下裂解效果好。
2.2.3 裂解时间
通常情况下,适度延长反应时间有利于反应完全,提高得率,但若时间过长在脱除树脂和保护基时会发生许多副反应,同时当多肽长时间处于强酸性环境中时,也会影响到肽的稳定性。实验中发现当裂解2 h 时,反应基本完全,且纯度和收率都较高。
此外,本实验还利用不同的氧化方法[13],通过氧化巯基为二硫键得到3,氧化在各自较优的条件下进行,并对氧化效果进行了比较,结果见表2。
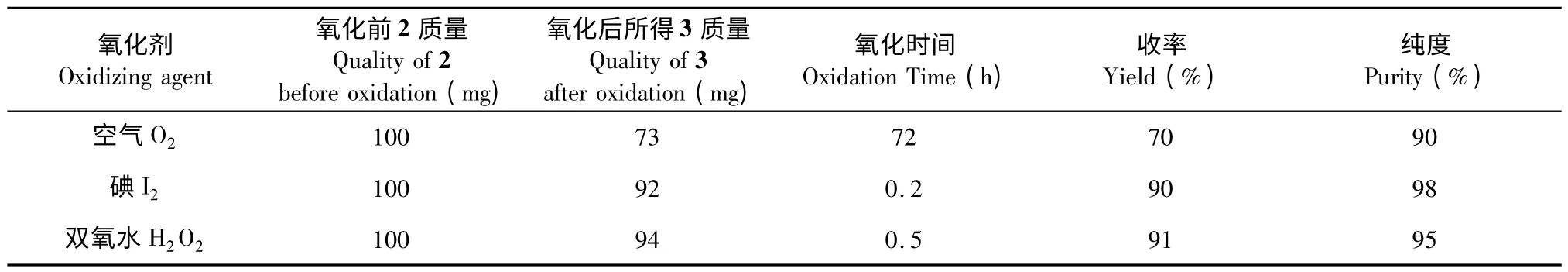
表2 不同氧化法氧化效果的比较Table 2 Comparison of different oxidation effect
从表中可知,空气氧化的纯度虽然较高,但收率较差,同时反应时间长,且底物浓度必须较低,否则副产物较多,较为繁琐。故工业多采用双氧水氧化法,本实验除采用此法以外,还尝试了碘氧化法,由
2.3 目标产物的保肝活性
由表3 知,合成1(α-GSH)、2(γ-GSH)和3(GSSG)与注射用2 在80、40 mg/kg 剂量下都可以显著降低小鼠肝脏血清中ALT 和AST 水平,而低剂量(20 mg/kg)作用稍弱。
表3 连续给予合成化合物1、2、3 与注射用2 后对4 致急性肝损伤小鼠血清ALT 与AST 的影响(,n=8)Table 3 Effects of synthetic compounds 1,2,3 and 2 for injection on serum ALT and AST of 4-induced acute liver injury in mice (,n=8)

表3 连续给予合成化合物1、2、3 与注射用2 后对4 致急性肝损伤小鼠血清ALT 与AST 的影响(,n=8)Table 3 Effects of synthetic compounds 1,2,3 and 2 for injection on serum ALT and AST of 4-induced acute liver injury in mice (,n=8)
注:与肝损伤模型组比较,* P<0.05,**P<0.01。Note:compare with liver injury model group,* P<0.05,**P<0.01.
3 结论
通过与注射用γ-GSH 比较,小鼠急性肝损伤试验结果表明,合成化合物1(α-GSH)、2(γ-GSH)和3(GSSG)的高、中剂量组都可以显著降低小鼠肝脏ALT 和AST 水平,其治疗效果与同等剂量的注射用γ-GSH 无显著差异。初步说明可以考虑此方法用于谷胱甘肽的合成。
1 Jin CY (金春英),Cui JL (崔京兰),Cui SY (崔胜云),et al.Synergistic effect of oxidized glutathione to glutathione and scavenging free radicals.Chem Anal (分析化学),2009,37:1349-1353.
2 Raghunathan VK,Ellis EM,Justice NAT,et al.Involvement of reduced glutathione and glutathione reductase in the chronic toxicity of hexavalent chromium tomonocytes in vitro.Toxicology,2007,23:105-106.
3 Every D,Morrison SC,Simmons LD,et al.Distribution of glutathione in millstreams and relationships to chemical and baking properties of flour.Cereal Chem,2006,83:57-61.
4 Jiang J (江洁),Shan LF (单立峰).Preparation and application of glutathione.Feed Ind (饲料工业),2007,28:15-17.
5 Liu GQ (刘国琴),Chen J (陈洁),Zhao L (赵雷),et al.Discussion of optimization method and technological conditions for extracting glutathione from wheat germ.J Henan Univ Tech (河南工业大学学报),2007,28:1-5.
6 Wu WT (吴梧桐),Lao XZ (劳兴珍),Zheng X (郑珩),et al.By the method of enzyme engineering technology of biosynthesis of glutathione (通过酶工程法生物合成谷胱甘肽).CN200710020902.1,2007-10-17.
7 Camera E,Picardo M.Analytical methods to investigate glutathione and related compounds in biological and pathological processes.J Chromatogr B,2002,781:181-206.
8 Chen J (陈坚),Wei GY (卫功元),Li Y (李寅),et al.Glutathione production by microbial fermentation.J Food Sci Biotech (食品与生物技术学报),2004,23:104-110.
9 Chen X (陈雪),Zhao WJ (赵文杰),Feng J (冯军),et al.Strain screening of glutathione producing strain.Chin J Pharm Ind (中国医药工业杂志),2007,38:481-483.
10 Han Y (韩月),Yin ZF (尹志峰),Zhao HL (赵红玲),et al.Solid phase synthesis of pramlintide.Chin J New Drug(中国新药杂志),2012,21:1046-1049.
11 Xu SY (徐淑云),Bian RL (卞如濂),Chen X (陈修),et al.Methodology of pharmacological experiment (药理实验方法).Beijing:People's Medical Publishing House,2001.1346.
12 Sun J(孙键),Xu HJ(徐宏江),Zhu YH(朱裕辉),et al.Preparation and hepatoprotective activity of oxidized glutathione system.Chin J Pharm Ind (中国医药工业杂志),2013,44:265-268.
13 Wang LY (王良友),Pan HP (潘和平),Chen ZY (陈正英).The formation of several two disulfide bonds in peptide synthesis method is introduced.Organ Chem (有机化学),1998,18:576-580.

