樟属植物叶水浸提液对油樟悬浮细胞培养的影响
李 群,谭韵雅,魏 琴,汪 超,游 玲
1四川师范大学生命科学学院,成都 610101;2宜宾学院香料植物资源开发与利用四川省高校重点实验室,宜宾 644000
植物体内各种次生代谢产物产生或增加主要通过各种生物或非生物因子诱导子调节代谢途径、中间产物及关键酶活性等方式实现[1]。这些生物因子可能是植物激素物质[2],也可能是目标代谢产物前体物质[3,4]。将前体物质作为诱导剂的前提是明确该目标产物的生物合成途径。虽然明确生物合成途径的次生代谢产物并不多,但前提物质一定是以中间代谢产物的形式存在于产生这些代谢产物的植物体内,甚至于有相近化学成分的近缘植物体内。目前在植物次生代谢产物积累方面,研究较多的是生物诱导子中的真菌诱导子[5-7]。而利用植物体本身或近缘种提取液作为诱导子的研究不多。王平等[8]研究表明,天竺桂水提液可促进油樟叶悬浮细胞黄酮类物质积累。天竺桂与油樟为同属植物,这可能与天竺桂水提液中存在黄酮类物质诱导因子有关。
油樟(Cinnamomum longepaniculatum N.Chao ex H.W.Li.)为樟科(Lauraceae)樟属(Cinnamomum)常绿乔木,为重要的经济作物,其根、茎、叶、种子均可提芳香油。油樟叶中提取的芳香油主要成分为萜类物质,占芳香油85%以上[8],其中已报道有重要经济价值的成分有1,8-桉叶油素、r-松油烯、a-松油醇等[9-14]。油樟是中国特有天然香料。油樟主要分布于四川宜宾,目前资源不足30 万亩,所产油樟油远不能满足市场需求。探讨油樟油及其组分产生的影响因子及相关基础研究,有利于进一步充分利用油樟资源。本课题组前期分析检测了油樟、大叶樟、香樟和天竺桂4 种樟属植物叶水浸提液挥发性物质组成成分情况,这些成分有共有性和物种特征性[15]。油樟油主成分1,8-桉叶油素的分子结构中含有氧杂二环,推测其前提物质可能为水溶性的。天竺桂等其它近缘种是否对油樟挥发性物质的积累产生促进作用,这方面的研究未见报道。以此为出发点,本实验将4 种樟属植物油樟(Cinnamomum longepaniculatum N.Chao ex H.W.Li.)、大叶樟(Cinnamomum parthenoxylum)、香樟(Cinnamomum camphora)、天竺桂(Cinnamomum japonicum Sieb.)叶水浸提液添加到油樟悬浮培养系中,研究其水浸提液对油樟悬浮培养细胞生长及挥发性次生代谢产物的影响,旨在初步探究油樟近缘种中是否存在有利于油樟挥发性物质积累的物质,为进一步研究奠定基础。
1 材料与方法
1.1 材料
油樟(Cinnamomum longepaniculatum N.Chao ex H.W.Li.)、大叶樟(Cinnamomum parthenoxylum)、香樟(Cinnamomum camphora)、天竺桂(Cinnamomum japonicum Sieb.)的叶片采自宜宾学院校园内,由宜宾学院魏琴教授鉴定;1,8-桉叶油素(0.5 mL/支,HPLC≥99%)、α-松油醇(0.1 g/支,98%)和γ-松油烯(1 g/支,GC95%)三种标品在北京世纪奥科生物技术有限公司购回。
1.2 仪器
气相色谱仪[Agilent7890A、氢火焰离子化检测器(FID)]。
1.3 实验方法
1.3.1 油樟悬浮细胞系的建立
参照魏琴等[16]的配方进行愈伤组织培养。培养基配方是B5 +0.5 mg/L NAA+2.0 mg/L 6-BA+3%蔗糖+0.7%琼脂,pH5.8。将愈伤组织(约2 g鲜重)转移到含40 mL 液体的培养基100 mL 锥形瓶中悬浮培养,每20 d 继代一次,摇床转速110 r/min,25 ℃条件下培养,培养温度25 ℃。每三周继代一次,连续继代三次,直至愈伤组织较为疏松后用于建立悬浮培养体系。
1.3.2 樟属植物叶水浸提液制备
采摘新鲜的油樟、大叶樟、香樟和天竺桂叶片洗净,晾干,称取40 g 放入打浆机中加入适量蒸馏水打2 min,用四层纱布过滤,滤液定容至1 L 就获得浓度为40 g/L 的水提液。121 ℃高压灭菌20 min后放入4 ℃冰箱保存备用。
1.3.3 1,8-桉叶油素、γ-松油烯和α-松油醇3 种物质混和标样的制备与检测
称取0.5 g 1,8-桉叶油素、γ-松油烯和α-松油醇标品,分别置于50 mL 容量瓶中用乙醇定容,制成10 g/L 的标准溶液。取配好的10 g/L 的3 种标准溶液,用超纯水稀释配制成浓度为0.1mg/L 的混和标样。取10 mL 培养物顶空进样,进行气相色谱检测。
1.3.4 樟属植物叶浸提液对悬浮细胞生长和挥发性物质积累的影响
在悬浮培养基中分别添加浓度为0.1%(100 mL 悬浮细胞培养基中添加0.1 mL 樟属植物叶浸提液,以下同)、0.25%、1%、4%、10%的4 种樟属植物叶浸提液,摇床转速110 rpm,25 ℃条件下培养,以未加浸提液的实验组作为对照,每组重复3 瓶,培养20 d。取10 mL 培养物(细胞加培养液)顶空进样,进行气相色谱检测,以1,8-桉叶油素、a-松油醇和r-松油烯三种标品制作混标,用与样品相同的方法进样,用以对样品中产物进行定性检测。每组重复3次。
1.3.4.1 生物量的测定
将悬浮细胞培养物抽滤,取细胞,置于烘箱中45 ℃干燥至恒重,称其质量为细胞干重。每组重复3 次。
1.3.4.2 GC-FID 条件
HP-5(30 m×320 μm ×0.25 μm)毛细管柱,平衡温度95 ℃,平衡时间20 min。载气为氮气,氢气流速30 mL/min,空气流速400 mL/min,氮气尾吹气25 mL/min,顶空进样,分流比3.0。柱箱程序:90 ℃保持4 min,然后20 ℃/min 到130 ℃保持5 min,然后20 ℃/min 到190 ℃保持1 min,然后20 ℃/min到240 ℃保持1 min。
1.3.5 数据处理
以峰面积表示各物质的产量,其中总挥发性次生代谢产物以总峰面积表示。试验所有数据均用SPSS 17.0 软件进行统计学处理。数据以平均值±标准误即()表示。
1.3.6 方法学考察
1.3.6.1 精密度和稳定性试验
取1.3.3 中配制好的0.1 mg/L 的混标,取10 mL 于顶空进样瓶中,按1.3.4.2 方法重复进样5次,计算1,8-桉叶油素、r-松油烯、a-松油醇及总峰面积的峰面积RSD(%)分别为1.92、1.04、1.20、1.66;取同一供试品在同一天内重复进样5 次,并连续进样3 d,计算1,8-桉叶油素、r-松油烯、a-松油醇及总峰面积的峰面积日内与日间RSD(%)分别为1.83、1.78、1.90、1.36。
1.3.6.2 回收率试验
取1.3.3 中配制好的10 g/L 标准溶液,用超纯水为溶剂配制成1、0.5、0.1 mg/L 的混标,分别取5 mL 于顶空进样瓶中,再分别加入5 mL 已测样品,依1.3.4.2 中方法测定,计算出1,8-桉叶油素、r-松油烯、a-松油醇及总峰面积的峰面积回收率分别为100.11%、99.36%、100.04%、100.10%、99.45%,RSD(%)分别为1.55、1.89、1.28、1.88。
以上方法学验证结果表明本实验所用方法可靠。
2 实验结果
2.1 混合标样GC-FID 分析
由混合标品的气相色谱检测结果可知(图1A),1,8-桉叶油素、a-松油醇和γ-松油烯的出峰时间分别为2.840、3.167 和5.325 min。样品中(图1B)相同的出峰时间被认为是与标品相同的物质。
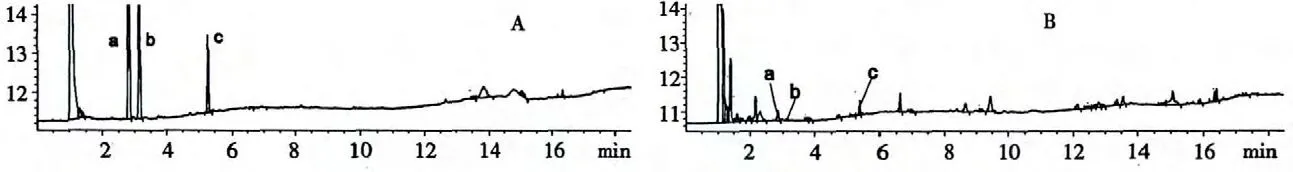
图1 混合标样(A)和样品(B)GC-FID 总离子流图Fig.1 GC-FID chromatograms of mix standard (A)and sample (B)
2.2 4 种樟属植物叶水浸提液对悬浮细胞生长的影响
樟属植物叶浸提液对悬浮细胞生长的影响见图2。经方差分析得知4 种樟属植物叶水浸提液试验组中的细胞干重与对照组相比均无显著性差异,说明4 种水提液诱导子对油樟细胞生长既无明显地促进作用也无明显地抑制作用。
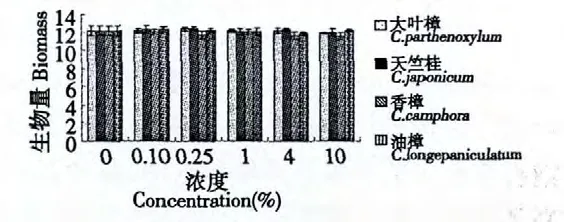
图2 樟属植物提取物处理后悬浮细胞的生物量(g/L)Fig.2 The biomass of suspension cell after processed by Cinnamomum plant extracts (g/L)
2.3 4 种樟属植物叶水浸提液对次生代谢产物积累总量的影响
4 种樟属植物叶水浸提液对次生代谢产物积累总量的影响见图3。经方差分析得知,绝大部分试验组和对照组相比差异显著。天竺桂与香樟水提液诱导子对次生代谢产物积累总量均呈低浓度促进高浓度抑制的作用效果,水浸提液添加量分别为4%和1%时促进作用最强,其总峰面积分别为空白对照组的1.78 和1.45 倍。大叶樟和油樟水提液对次生代谢产物积累总量均呈抑制作用,且随着浓度的增加其抑制作用越强。
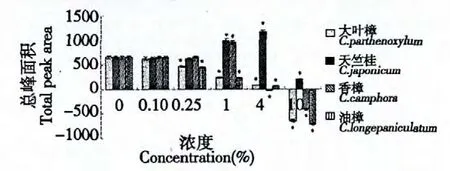
图3 樟属植物提取物处理后悬浮细胞中总挥发性物质积累量(总峰面积/pA)Fig.3 The accumulation of total volatile substances in suspension cell after processed by Cinnamomum plant extracts (total peak area/pA)
2.4 4 种樟属植物叶水浸提液对3 种萜类物质积累的影响
4 种樟属植物叶水浸提液对悬浮细胞3 种萜类物质积累的影响见图4。不同樟属植物叶水浸提液对3 种萜类物质积累的影响不同。
对于1,8-桉叶油素的积累,仅天竺桂水提液诱导子试验组对1,8-桉叶油素积累呈低浓度促进高浓度抑制的影响,且在添加量为1%时促进作用最强,1,8-桉叶油素峰面积为空白对照组的1.46 倍,其余几种诱导子在所设试验浓度范围内对其均呈抑制作用,且浓度越高其抑制作用越强。
对于γ-松油烯的积累,4 种水提液诱导子在所设试验浓度范围内对松油烯积累均呈促进作用,其中大叶樟、天竺桂和香樟水提液均在添加量为1%时促进作用最强,此时γ-松油烯峰面积分别为0.39、0.27 和0.32 pA,油樟水提液在添加量为4%时促进作用最强,此时γ-松油烯峰面积为0.27 pA。
对于α-松油醇的积累,天竺桂和香樟叶水浸提液对α-松油醇积累呈低浓度促进高浓度抑制的影响,且均是在浓度为0.25%时促进作用最强,此时α-松油醇峰面积分别为空白对照组1.62 和1.24倍,而大叶樟水提液对α-松油醇积累均呈抑制作用,且浓度越高其抑制作用就越强。
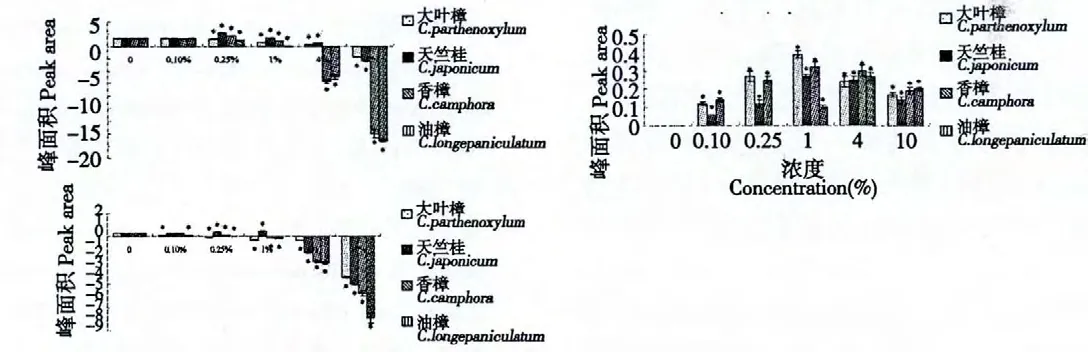
图4 樟属植物提取物处理后悬浮细胞中3 种萜类化合物积累量(峰面积/pA)Fig.4 The accumulation of 3 terpenoids in suspension cell after processed by Cinnamomum plant extracts (Peak area/pA)
3 讨论
4 种樟属植物叶水浸提液添加至悬浮细胞系后,细胞生长量未受太大的影响(图2),该措施保证了悬浮细胞的生物量。对于以收集次生代谢产物为目的的研究或生产有积极意义。
不同樟属植物叶水浸提液添加至悬浮细胞系后,对挥发性次生代谢产物积累总量及3 种组分影响均不同(图3、图4)。这与这几种植物叶水浸提液成分差异有密切关系[15]。本研究因为受标品限制,仅检测了目前开发利用价值较高、有标品的3 种萜类物质。4 种叶水浸提液对γ-松油烯均有促进作用,且是从无到有的诱导(对照中无),这是否与4种叶水浸提液均含有2,2'-亚甲基双[6-(1,1-双甲基乙基)-4-甲基]苯酚这个特征性化合物有关,有待进一步研究;对于1,8-桉叶油素的积累,仅天竺桂水提液有积极的诱导促进作用,这是否与天竺桂叶水浸提液中独特而含量较高(91.82%)的顺式-四氢化-2,5-二甲基-呋喃有关,有待进一步研究;天竺桂和香樟能促进α-松油醇的积累,这是否与二者的叶水浸提液中共同含有的1,2-苯二羧酸丁基(2-甲基丙基)酯、1,2-苯二羧酸单(2-乙基己基)酯、1-甲基-4-(1-甲基乙基)-1,4-环已二烯、2,2'-亚甲基双[6-(1,1-双甲基乙基)-4-甲基]苯酚及三乙酸甘油酯有关,有待进一步研究。这些代谢产物的诱导也可能是多种成分共同作用的结果。
由于本实验中所加叶水浸提液含有与所测产物相同的物质,在表示产物的积累时减去了诱导子中原本含有的含量,因此部分产物积累量为负值(图3、图4)。从本实验的结果中可以看出,在高浓度条件下,其次生代谢产物峰面积降低或大多均为负值,这说明在高浓度叶水浸提液作用下,油樟细胞可能会消耗诱导子中的某些物质,也许被当做碳源用于细胞的生长,也许被转化为其它的不具有挥发性或者挥发性差的物质,也可能因为叶浸提液中目标代谢产物的存在,反馈抑制导致含量下降。
在本研究中,所有对次生代谢产物有促进作用的试验组,其诱导促进强度均不高,未超过对照的2倍(图3、图4),这可能跟采叶的季节、时间有关,也与悬浮细胞培养条件有关,有待进一步筛选条件。朱娜等[17]提到诱导子具有专一性、快速性、浓度效应、时间效应以及协同效应。本研究仅讨论了浓度效应,专一性、时间效应及协同效应有待进一步研究。
本研究首次报道了以上几种樟属植物提取物诱导子对油樟悬浮细胞培养过程中挥发性产物积累的作用,为利用油樟细胞生产一些有用次生代谢产物提供了一定的理论基础。
1 Fang HY(房慧勇),Zhu H(朱虹),Ding HM(丁海麦),et al.Research progress on effect factors of secondary metabolites content in callus.China J Chin Mater Med(中国中药杂志),2014,39:2846-2850.
2 Gu YH(谷荣辉),Hong LY(洪利亚),Long CL(龙春林).The ways of producing secondary metabolites via plant cell culture.Plant Physiol J(植物生理学报),2013,49:869-881.
3 Liu R(刘冉),Wang ZY(王振宇),Cui J(崔杰),et al.Effects of precursors and elicitations on the synthesis polyphenols of Pinus koraiensis.J Beijing Forest Univ(北京林业大学学报),2013,35(5):22-27.
4 Dong LM(董乐萌),Wei JH(魏建和),Liu YJ(刘玉军),et al.Advances in studies on spatial-specific distributions of secondary metabolites and related enzymes in plants.Chin Tradit Herb Drugs(中草药),2009,40:153-155.
5 Xu MJ,Dong JF,Wang HZ,et al.Complementary action of jasmonic acid on salicylic acid in mediating fungal elicitorinduced flavonol glycoside accumulation of Ginkgo biloba cells.Plant Cell Environ,2009,32:960-967.
6 Pawar KD,Yadav AV,Shouche YS,et al.Influence of endophytic fungal elicitation on production of inophyllum in suspension cultures of Calophyllum inophyllum L.Plant Cell Tiss Org,2011,106:345-352.
7 Tan Y(谭燕),Ja R(贾茹),Tao JH(陶金华),et al.Regulation on biosynthesis of active constituents in medicinal plants by endophytic fungal elicitor.Chin Tradit Herb Drugs(中草药),2013,44:2004-2008.
8 Wang P(王平),Zhang P(张萍),Hou M(侯茂),et al.Effects of Cinnamomum japonicum Sieb.water extracts on the flavonoids accumulation in cell suspension culture of Cinnamomum longepaniculatum N.Chao ex H.W.Li.Bull Biol(生物学通报),2012,47(10):39-40.
9 Hu WJ(胡文杰),Gao HD(高捍东),Jang XM(江香梅),et al.Analysis on constituents and contents in leaf essential oil from three chemical types of Cinnamum camphora.J Cent South Univ For Tech(中南林业科技大学学报),2012,32:186-194.
10 Li L,Li ZW,Yin ZQ,et al.Antibacterial activity of leaf essential oil and its constituents from Cinnamomum longepaniculatum.Int J Clin Exp Med,2014,7:1721-1727.
11 Xu S,Yin ZQ,Wei Q,et al.Anti-hepatoma effect of safrole from Cinnamomum longepaniculatum leaf essential oil in vitro.Int J Clin Exp Pathol,2014,7:2265-2272.
12 Ye KC(叶奎川),Yin ZQ(殷中琼),Wei Q(魏琴),et al.Anticancer activity of the essential oil from Cinnamomum longepaniculatum leaves and its major components against human BEL-7402.Acta Anat Sin(解剖学报),2012,43:381-385.
13 Shi CF(石超峰),Yin ZQ(殷中琼),Wei Q(魏琴),et al.Bacteriostatic action and mechanism of α-terpineol on Escherichia coli.Acta Vet Zootech Sin(畜牧兽医学报),2013,44:796-801.
14 Huang D(黄彤),You L(游玲),et al.Inhibiting effects of by-products from Cinnamommum longepaniculatum oil on pathogenic bacteria causing skin infection.J Sichuan Agric Univ(四川农业大学学报),2014,32:53-58.
15 Wei Q(魏琴),Tan YY(谭韵雅),Li Q(李群),et al.GCMS analysis of five kinds of cinnamomum plant leaf water leaching solution.J Sichuan Univ,Nat Sci(四川大学学报,自科版),2015,52:193-198.
16 Wei Q(魏琴),Wang L(王丽),Fu TH(傅体华),et al.Studies of cell suspension culture and induction of secondary metabolism products in Cinnamomum longepaniculatum.Chin Bull Bot(植物学通报),2008,5:591-596.
17 Zhu N(朱娜),Zhou YQ(周宇琼).Application of elicitor on medicinal plant cultivation.Mod Agric Sci Technol(现代农业科技),2011,24:52-53.

