阿莫西林/克拉维酸钾联合常规抗结核药治疗耐多药肺结核的疗效观察Δ
郭 蕊 ,焦雪峰,陈 爽,罗 琳(河南省胸科医院药剂科,河南 郑州 450000)
耐多药肺结核(multidrug resistance tuberculosis,MDRTB)是指结核病患者感染的结核分枝杆菌至少同时对异烟肼和利福平2 种抗结核药耐药,其传染性强、病程长、治疗难度大、死亡率高,对人类健康危害极大[1-3]。2010 年第5 次结核病流行病学抽样调查结果显示,我国肺结核患者耐多药率为6.8%,广泛耐药率2.1%,且MDR-TB 病例总数和每年新发病例数均高居全球第1 位[4-6]。基于此,河南省胸科医院(以下简称“我院”)将2012 年1 月至2014 年1 月就诊的205 例耐多药肺结核患者分为观察组和对照组进行治疗,现报告如下。
1 资料与方法
1.1 资料来源
入选标准:(1)经初治或复治短程化疗失败、不规则治疗或者中断治疗者,痰培养示结核杆菌阳性,药物敏感试验示至少对异烟肼和利福平耐药;(2)年龄18 ~60 岁;(3)未使用过阿莫西林/克拉维酸钾、异烟肼、吡嗪酰胺、盐酸乙胺丁醇、利福喷丁、左氧氟沙星、对氨基水杨酸,或使用过以上药物,但总用药时间不超过2 个月;(4)胸片证实肺内有病变,伴有或不伴有空洞均可;(5)无青霉素过敏史;(6)患者及家属均知情同意。排除标准:(1)有心、肝,肾功能异常者;(2)有糖尿病史及电解质紊乱者;(3)有严重药物过敏史者;(4)妊娠期和哺乳期妇女,吸毒者、药瘾者。选取2012 年1 月—2014 年1 月期间收治的符合以上标准的205 例患者,采用随机数字表法分为对照组和观察组。对照组患者102 例,男性61 例,女性41 例,年龄21 ~79 岁,平均(46.17 ±5.32)岁;病程2.4 ~26 年,平均(12.44 ± 6.95)年。观察组患者103 例,男性59 例,女性44 例,年龄20 ~81 岁,平均(45.82 ±5.45)岁;病程2.1 ~27 年,平均(12.53 ±7.14)年。2 组患者在年龄、性别、空洞比例等方面比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属并签署了知情同意书。
1.2 方法
2 组患者均接受药物治疗12 个月,其中强化期3 个月,维持期9 个月。对照组:吡嗪酰胺(口服1.5 g/次,1 日1 次)+乙胺丁醇(口服0.75 g/次,1 日1 次)+对氨基水杨酸异烟肼(口服1.0 g/次,1 日1 次)+利福喷丁(口服0.6 g/次,1 周2 次)+左氧氟沙星,其中左氧氟沙星强化期静脉滴注给药(0.6 g/次,1 日1 次),维持期口服给药(0.4 g/次,1 日2 次);观察组:在对照组治疗的基础上加用阿莫西林/克拉维酸钾,用法为强化期静脉滴注给药(1.2 g/次,每8 h 给药1 次),维持期口服给药(0.312 5 g/次,1 日3 次)。所有患者在治疗过程中全程口服肌苷片(0.4 g/次,1 日3 次),进行护肝治疗。
1.3 观察指标
患者治疗前做痰涂片检查与培养,药物敏感试验,菌型鉴定,进行胸部X 线检查,查血常规、尿常规、肝、肾功能。治疗期间每月复查血常规、尿常规、肝、肾功能,进行胸部X 线检查1次及痰涂片与培养鉴定抗酸杆菌3 次。密切观察患者咳嗽、咯痰、胸痛、呼吸困难、咯血、发热、乏力、盗汗等临床症状和药物的不良反应。
1.4 疗效评定标准
(1)痰菌阴转:痰涂片和培养检查连续2 个月为阴性且不复阳。(2)病灶吸收标准:病灶吸收≥1/2 为显著吸收;0 <病灶吸收<1/2 为吸收;病灶无明显改变为无变化;病灶扩大为恶化。总有效率为显著吸收率和吸收率的总和。(3)空洞闭合标准:空洞完全闭合为闭合,空洞直径缩小≥1/2 为缩小,空洞直径缩小或扩大<1/2 为不变,空洞直径增大≥1/2 为增大。总有效率为闭合率和缩小率的总和。(4)药品不良反应评价:根据上报到国家药品不良反应监测系统的药品不良反应事件初步评价药物不良反应情况。
1.5 统计学方法
本研究中数据采用SPSS 16.0 统计学软件进行分析,计数资料以率(%)表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 2 组患者痰菌阴转情况比较
观察组患者在治疗3 个月后痰菌阴转率为45.63%,对照组为40.20%,2 组的差异无统计学意义(P>0.05);观察组在治疗6、9、12 个月后痰菌阴转率均明显高于对照组,差异均有统计学意义(P<0.05),见表1。

表1 2 组患者痰菌阴转情况比较[例(%)]Tab 1 Comparison of sputum negative conversion rate in 2 groups[cases(%)]
2.2 2 组患者病灶吸收情况比较
疗程结束时,观察组患者总有效率为88.35%,明显高于对照组的66.67%,差异有统计学意义(P<0.05),见表2。

表2 2 组患者病灶吸收情况比较[例(%)]Tab 2 Comparison of focal absorption rate in 2 groups[cases(%)]
2.3 2 组患者空洞闭合情况比较
疗程结束时,观察组和对照组患者的空洞闭合总有效率分别为84.47%和64.71%,差异有统计学意义(P<0.05),见表3。
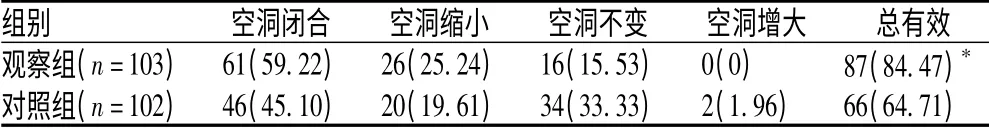
表3 2 组患者空洞闭合情况比较[例(%)]Tab 3 Comparison of cavity closure rate in 2 groups[cases(%)]
2.4 2 组患者不良反应发生情况比较
2 组患者在治疗过程中出现的不良反应有胃肠道反应(恶心、呕吐、腹泻)、肝功能异常(转氨酶升高)、神经系统症状(头晕、头痛)和皮疹。观察组患者的不良反应发生率为13.59%,与对照组的11.76%比较,差异无统计学意义(P>0.05),见表4。

表4 2 组患者不良反应发生情况比较[例(%)]Tab 4 Incidences of adverse reactions in 2 groups[cases(%)]
3 讨论
我国为全球27 个高耐药结核负担国家之一,耐多药肺结核疫情严峻,其诊疗方案也一直处于探究摸索阶段。2001 年中华医学会制定的《肺结核病诊断和治疗指南》中主张,一线和二线抗结核药物联合应用治疗耐多药肺结核,但并未将阿莫西林/克拉维酸钾列入药物治疗方案中[1]。在我国《耐药结核病规划管理指南2011 年更新版》中,将阿莫西林/克拉维酸钾归为二线抗结核药中的第5 组药品,即对耐多药肺结核的疗效尚不明确,可以使用,但不能作为治疗方案中的核心药物[7-8]。
阿莫西林/克拉维酸钾是阿莫西林与β-内酰胺酶抑制剂克拉维酸组成的复方制剂。研究结果表明,结核分枝杆菌对β-内酰胺类抗菌药物产生耐药的机制为,其可产生β-内酰胺酶,从而破坏β-内酰胺类抗菌药物的结构[9]。克拉维酸钾可不可逆地竞争性抑制β-内酰胺酶的活性,合用时可使阿莫西林免遭β-内酰胺酶水解,显著提高其抗结核分支杆菌的活性[10]。国内外多个研究支持阿莫西林克拉维酸钾的抗结核作用,如王璐等[11]的研究和Ahmed 等[10]的研究分别从体内和体外证实阿莫西林/克拉维酸钾对耐多药肺结核患者的结核菌株有效。但也有些研究持相反的观点,如Donald 等[12]的研究结果表明,阿莫西林/克拉维酸钾对肺结核患者无早期杀菌活性。Chambers 等[13]的研究结果表明,阿莫西林/克拉维酸钾只在使用前3 d 对肺结核患者有效,其原因可能是阿莫西林/克拉维酸钾很难穿透哺乳动物的细胞膜进入细胞内,只能杀死细胞外的结核分枝杆菌,而对细胞内的结核分枝杆菌则束手无策。
本研究在随机化和科学设计的基础上,观察阿莫西林/钠克拉维酸钾在治疗耐多药肺结核方面的疗效,样本量为205 例。研究结果显示,观察组患者治疗6、9、12 个月后痰菌阴转率明显高于对照组,在治疗结束时的病灶吸收情况、空洞闭合情况均明显优于对照组,差异均有统计学意义(P<0.05),表明阿莫西林/克拉维酸钾对耐多药肺结核的治疗有效;2 组的不良反应发生率的差异无统计学意义(P>0.05),表明阿莫西林克/拉维酸钾联合常规抗结核药物不会使不良反应叠加,在治疗耐多药肺结核方面安全、低毒。
本研究中,观察组与对照组患者治疗3 个月后痰菌阴转率的差异无统计学意义(P>0.05),原因可能为:耐多药肺结核具有病情复杂、治疗难度大、所需疗程长等特点。2011 年世界卫生组织建议耐多药结核病治疗的强化期至少8 个月,对于既往未接受过耐多药结核病治疗的患者,全疗程至少20 个月[14]。
影响本研究结果可信性的因素有:(1)未采用盲法试验,不可避免会存在选择性偏倚和测量偏倚,可能会对实验结果造成一定的影响;(2)纳入患者数量偏少,且地域局限,可能会对研究的真实性产生影响。
综上所述,阿莫西林/克拉维酸钾治疗耐多药肺结核安全、有效,但短期疗效优势不明显。考虑到本研究在方法学上存在一定局限性,阿莫西林/克拉维酸钾在治疗耐多药肺结核中的作用和地位还需更科学合理的大样本、随机、盲法对照临床试验加以证实。
[1] 张培元.肺结核诊断和治疗指南[J]. 中华结核和呼吸杂志,2001,24(2):70-74.
[2] 赵攀,黄成瑜,肖和平,等.耐多药肺结核的外科治疗研究进展[J].中华医学杂志,2012,92(48):3448-3450.
[3] 刘毅. 耐多药结核病研究进展[J]. 中国现代医生,2013,51(21):12-15.
[4] 全国第五次结核病流行病学抽样调查技术指导组,全国第五次结核病流行病学抽样调查办公室.2010 年全国第五次结核病流行病学抽样调查报告[J].中国防痨杂志,2012,34(8):485-508.
[5] 李亮,杜建.修订版耐药结核病规划管理指南对中国耐药结核病防治工作的启示[J]. 中华结核和呼吸杂志,2010,33(7):498-499.
[6] 郭翠菊,杜先智.耐多药结核病的治疗进展[J]. 国际检验医学杂志,2015,36(3):375-377.
[7] 聂理会,初乃惠.《耐药结核病规划管理指南2011 年更新版》解读[J].中国临床医生,2013,41(3):6-8.
[8] 许寅.耐药结核病规划管理指南解读[A]∥第十四届全国感染药学学术会议论文汇编[C].2012:382-383.
[9] 谢惠安.现代结核病学[M].北京:人民卫生出版社,2000:536.
[10] Ahmed I,Jabeen K,Inayat R,et al. Susceptibility testing of extensively drug-resistant and pre-extensively drug-resistant Mycobacterium tuberculosis against levofloxacin,linezolid,and amoxicillin-clavulanate[J].Antimicrob Agents Chemother,2013,57(6):2522-2525.
[11] 王璐,王晓,彭江丽. 阿莫西林/克拉维酸钾联合左氧氟沙星及基础抗结核药物治疗耐多药肺结核的临床疗效[J]. 药学服务与研究,2011,11(2):156-158.
[12] Donald PR,Sirgel FA,Venter A,et al.Early bactericidal activity of amoxicillin in combination with clavulanic acid in patients with sputum smear-positive pulmonary tuberculosis[J]. Scand J Infect Dis,2001,33(6):466-469.
[13] Chambers HF,Kocagöz T,Sipit T,et al. Activity of amoxicillin/clavulanate in patients with tuberculosis[J].Clin Infect Dis,1998,26(4):874-877.
[14] Falzon D,Jaramillo E,Schünemann HJ,et al. WHO guidelines for the programmatic management of drug-resistant tuberculosis:2011 update[J].Eur Respir J,2011,38(3):516-528.

