丝裂霉素与卡介苗膀胱灌注预防浅表性膀胱癌有效性和安全性的系统评价Δ
曹 睿 ,王海雪,钟小燕,杨 丹,叶 云(.泸州医学院药学院,四川 泸州 646000;2.泸州医学院附属医院药剂科,四川 泸州 646000)
膀胱肿瘤发病率居于泌尿系统肿瘤首位,在各类肿瘤中处于第10 位,其中70%~80%为浅表性膀胱癌,治疗以手术为首选[1],但术后复发率较高。膀胱内灌注治疗是目前预防浅表性膀胱癌术后复发最常用的一种治疗手段。目前认为膀胱肿瘤术后腔内治疗以丝裂霉素(Mitomycin C,MMC)和卡介苗(Bacille Calmette-Guerin,BCG)疗效最好。MMC 为细胞周期非特异性药物,由链霉菌提取,化学结构具有苯醌、乙酰亚胺基及氨甲酰3 个活性基团,作用与烷化剂相似,与DNA 链形成交联,抑制DNA 复制,对RNA 也有抑制作用。膀胱灌注可用于预防浅表性膀胱癌术后复发[2]。《2011 年NCCN 膀胱癌诊断治疗指南》指出,MMC 膀胱内灌注可以预防原位癌、Ta 和T1期膀胱癌经尿道膀胱肿瘤切除术后的复发。BCG 是一种良好的免疫增强剂,能刺激免疫细胞释放白介素-2(interleukin-2,IL-2)、干扰素(interferon,IFN)等淋巴因子,活化局部免疫效应细胞,直接杀死肿瘤细胞或诱导肿瘤细胞凋亡;BCG 被列为高危的非肌层浸润膀胱癌的首选药物[3],但由于BCG 有引起机体类结核病反应的可能,其在临床上的应用受到一定限制。因此本研究对原有的系统评价进行更新,参照Cochrane 系统评价方法,对MMC 与BCG 膀胱灌注预防浅表性膀胱癌的有效性和安全性进行评价,以期为临床实践提供参考。
1 资料与方法
1.1 纳入与排除标准
1.1.1 纳入与研究类型:本研究仅纳入随机对照临床试验(randomized clinical trials,RCT),无论其是否采用分配隐藏或采用盲法进行处理,文种限中、英文。
1.1.2 纳入研究对象:(1)纳入标准。①明确诊断的浅表性膀胱癌行肿瘤切除术后的患者;②所有病例均经肿瘤组织病理学明确诊断为移行细胞癌,所有病例均为初发;③所有病例均行手术切除;④所有病例年龄均<80 岁。(2)排除标准。①明显肝肾等内脏器官功能不全或有难以控制的泌尿道感染者;②不能按计划接受治疗和随访。
1.1.3 干预措施:试验组采用MMC 单独进行膀胱灌注,对照组采用BCG 单独进行膀胱灌注。
1.1.4 结局指标:(1)复发率;(2)进展率;(3)死亡率;(4)药物不良反应(adverse drug reaction,ADR)发生率。
1.2 检索策略
计 算 机 检 索 PubMed、MEDLINE (Ovid)、EMBASE、Cochrane Library、CNKI、维普、万方等数据库,英文检索词包括:superficial bladder cancer、Bacillus Calmette Guerin、BCG、Mitomycin、MMC、Meta-analysis、systematic review;中文检索词包括:浅表性膀胱癌、丝裂霉素、卡介苗、Meta 分析、系统评价。检索时限为各数据库建库至2013 年6 月。检索策略采用主题词与自由词相结合的方式,并辅以手工检索会议资料和追溯纳入文献的参考文献。以PubMed 为例,具体检索策略见图1。

图1 PubMed 检索策略Fig 1 PubMed search strategy
1.3 文献筛选与资料提取
2 位研究者交叉核对纳入研究的结果,对有分歧、难以确定其是否纳入的研究通过讨论或第3 位研究者决定是否纳入。首先通过Endnote 3.0 软件自动剔除各数据库重复的文献,其次阅读题目和摘要进行初步筛选,排除明显不符合纳入标准的文献,然后再对不确定的文献进行复筛,复筛后通过数据库查找全文再次进行筛选。如试验报告不详或资料缺乏,通过电子邮件与作者进行联系获取。提取数据主要内容包括:(1)一般资料:题目、作者、姓名、发表日期和文献来源;(2)研究特征:研究对象的一般情况、各组患者的基线可比性及干预措施;(3)结局指标。
1.4 质量评价
采用Cochrane 系统评价员手册5.0.1 推荐工具评价纳入RCT 的偏倚风险[4],包括:具体随机分配方法、分配方案隐藏、是否采用盲法、结果数据的完整性、选择性报告研究结果及其他偏倚来源。
1.5 数据分析
采用Cochrane 协作网提供的RevMan 5.2 对提取的相关数据进行Meta 分析。分类变量采用相对危险度(relative risk,RR),连续性变量采用均数差(mean difference,MD),各效应量均以95%CI表示。采用χ2检验并计算统计量I2对纳入研究的数据行异质性分析,若组间无异质性(P>0.10,I2≤50%)则采用固定效应模型分析。反之,则采用随机效应模型。
2 结果
2.1 文献检索结果
初筛得到相关文献738 篇,通过Endnote 去重和阅读文章题目与摘要,从中筛选出膀胱癌术后单独使用MMC 和BCG 相关文献44 篇,通过仔细阅读全文,严格按照本研究中的纳入、排除标准,排除了其中非随机性研究文献32 篇,纳入研究12 篇(英文7 篇,中文5 篇)。纳入研究的膀胱癌术后患者共计2 602 例。其中单独使用MMC 例数为1 344 例,单独使用BCG 例数为1 258 例。纳入研究的基本特征与文献筛选流程见表1、图2。纳入研究的方法学质量评价结果见图3。
2.2 结果
2.2.1 首次复发率:7 个研究均报告了首次复发率,各研究间同质性较好(P=0.11,I2=42%)[5-11],采用固定效应模型进行Meta 分析,结果显示,MMC 组与BCG 组的差异无统计学意义[RR=0.99,95%CI(0.85,1.14),P=0.86],见图4。

图2 文献筛选流程及结果Fig 2 Study flow diagram
2.2.2 3 年复发率:3 个研究均报告了3 年复发率,各研究间同质性较好(P=0.81,I2=0%)[9,12-13],采用固定效应模型进行Meta 分析,结果显示,MMC 组与BCG 组的差异无统计学意义[RR=0.89,95%CI(0.71,1.13),P=0.35],见图5。
2.2.3 6个关于对肿瘤进展影响的研究[5-6,8,12,14-15]:均报告了MMC 与BCG 对疾病进展的影响,各研究间同质性较好(P=0.34,I2=12%),采用固定效应模型进行Meta 分析,结果显示MMC 组与BCG 组的差异无统计学意义[RR=0.85,95%CI(0.64,1.13),P=0.27],见图6。
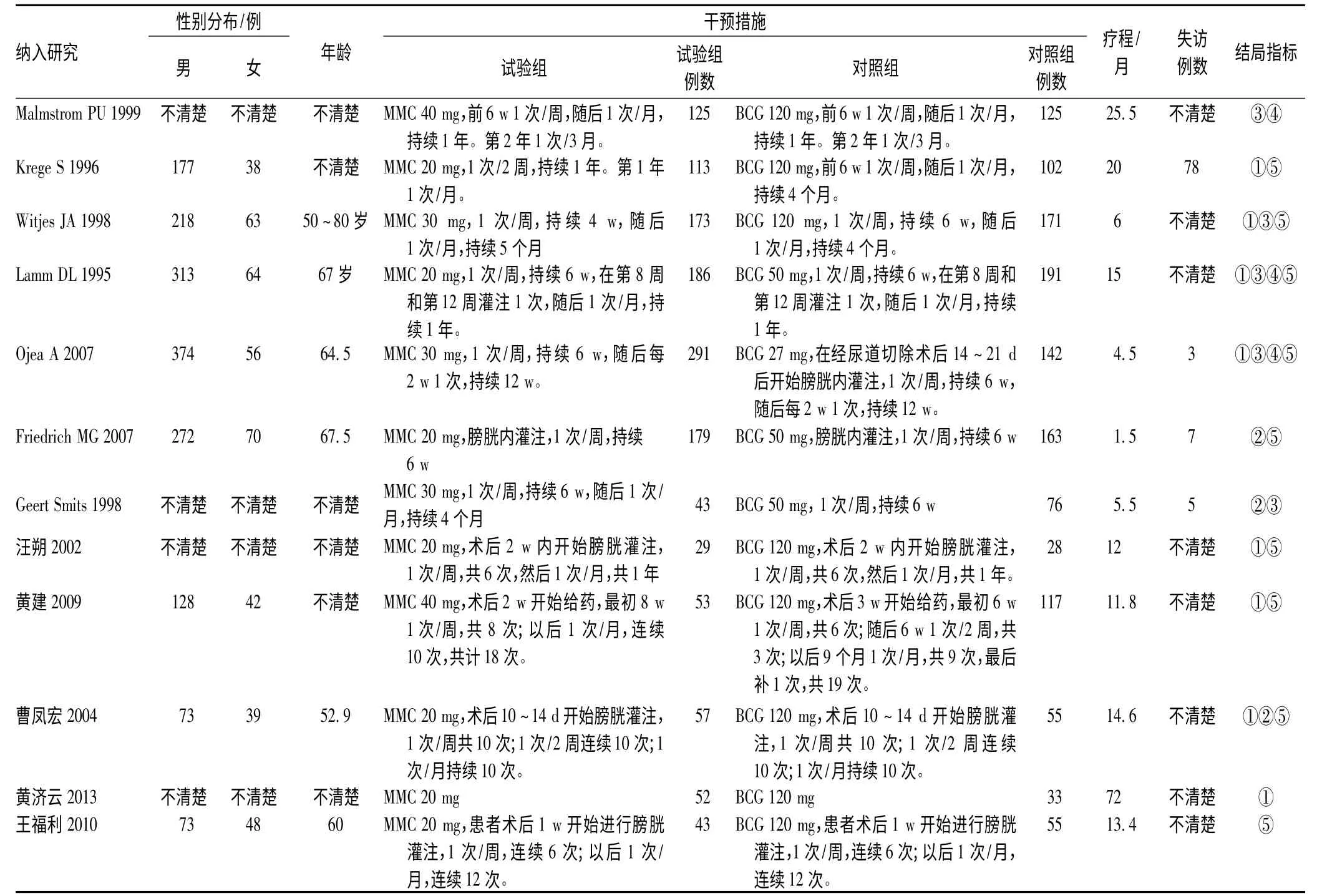
表1 纳入研究的基本特征Tab 1 Basic characteristics of included studies

图3 纳入研究的偏倚风险评估结果Fig 3 Risk of bias in included studies
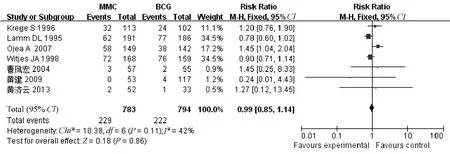
图4 MMC 与BCG 对首次复发率比较的Meta 分析Fig 4 Meta analysis of the first time recurrence rate in MMC group versus BCG group

图6 MMC 与BCG 对疾病进展影响比较的Meta 分析Fig 6 Meta analysis of disease progression in MMC group versus BCG group
2.2.4 死亡率:4 个研究均报告了死亡率,各研究间同质性较好(P=0.39,I2=1%)[5-6,8,14],采用固定效应模型进行Meta分析,结果显示MMC 组与BCG 组的死亡率差异无统计学意义[RR=1.12,95%CI(0.76,1.64),P=0.57],见图7。
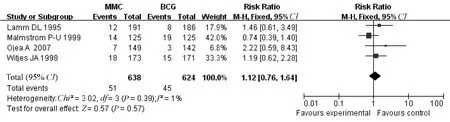
图7 MMC 与BCG 对死亡率比较的Meta 分析Fig 7 Meta analysis of mortality in MMC group versus BCG group
2.2.5 ADR 发生率:9 个研究均报道了 ADR 发生率[5-10,13,15-16],结果见表2。
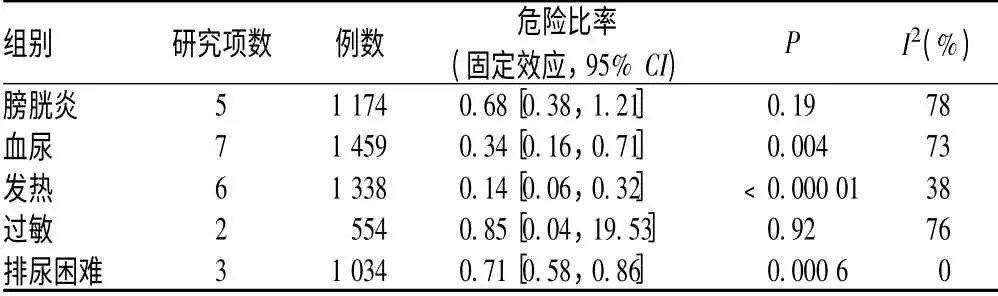
表2 MMC 组和GCB 组ADR 发生率的Meta 分析Tab 2 Meta analysis on the incidences of ADR in MMC group versus BCG group
3 讨论
本组系统评价结果显示,浅表性膀胱癌首次复发率、3 年复发率、进展率、死亡率两组相似,差异无统计学意义,与既往的Meta 分析结果不完全一致[2,17-19]。兰卫华等[2]和Bohle等[17]的Meta 分析结果为BCG 预防肿瘤复发效果显著优于MMC;Malmstrom 等[18]的研究指出,BCG 与MMC 首次复发的时间、肿瘤进展、患者总死亡率两组差异无统计学意义,但BCG 灌注且持续治疗组复发危险性较MMC 组降低32%(P<0.000 1)。Shelley 等[19]研究指出,两组在肿瘤复发率、进展率、生存率上差异无统计学意义,但在高风险肿瘤复发的亚组中BCG 预防肿瘤的复发率效果显著优于MMC。安全性方面本研究与既往的Meta 分析结果相似:BCG 组血尿、发热、排尿困难的ADR 发生率显著高于MMC 组。
本系统评价剔除国内外的非随机试验,共纳入12 个研究,3个研究提及具体随机分组方法[6-7,13];12 个研究提及采用分配隐藏[5-16];12 个研究均未提及是否采用盲法。各研究样本量较小、纳入标准存在一定的差异,治疗方案疗程也不尽一致,均提示可能存在不同程度的的选择性偏倚、测量偏倚和实施偏倚。
由于国内外缺乏高质量的大样本RCT,各研究间缺乏统一规范,可能导致不同的Meta 分析结果不完全一致,对于MMC与BCG 在膀胱灌注预防浅表性膀胱癌中的应用,仍需设计严谨的大样本、多中心的研究加以验证。因此,本组研究结果及既往的Meta 分析,提示临床上对这两种治疗药物,应根据具体情况做出选择。MMC 能降低术后肿瘤短期复发率,其ADR 较BCG 轻,适合于低、中风险的浅表性膀胱癌灌注治疗;BCG 能降低术后肿瘤复发率,但其ADR 限制了其临床应用,适合于高风险的浅表性膀胱癌持续灌注治疗。
[1] 陈涤平,张宇.三种不同化疗药物膀胱灌注预防浅表性膀胱癌术后复发的疗效比较[J]. 现代泌尿外科杂志,2008,13(2):121-123.
[2] 兰卫华,靳风烁,王洛夫,等. 卡介苗与丝裂霉素C 膀胱灌注预防浅表性膀胱癌复发疗效及毒性比较的Meta 分析[J]. 中华泌尿外科杂志,2006,21(1):29-32.
[3] Witjes JA,Hendricksen K. Intravesical pharmacotherapy for nonmuscle-invasive bladder cancer:a critical analysis of currently available drugs,treatment schedules,and long-term results[J].Eur Urol,2008,53(1):45-52.
[4] 何安仁,宋洪飞,万齐福,等. 卡介苗联合丝裂霉素灌注预防浅表性膀胱癌复发的疗效观察[J]. 临床和实验医学杂志,2013,12(12):948-949.
[5] Ojea A,Nogueira JL,Solsona E,et al. A multicentre,randomised prospective trial comparing three intravesical adjuvant therapies for intermediate-risk superficial bladder cancer: low-dose bacillus Calmette-Guerin (27 mg)versus very low-dose bacillus Calmette-Guerin (13.5 mg)versus mitomycin C[J]. Eur Urol,2007,52(5):1398-1406.
[6] Lamm DL,Blumenstein BA,David Crawford E,et al. Randomized intergroup comparison of bacillus Calmette-Guerin immunotherapy and mitomycin C chemotherapy prophylaxis in superficial transitional cell carcinoma of the bladder[J].Urol Oncol,1995,1(3):119-126.
[7] Krege S,Giani G,Meyer R,et al. A randomized multicenter trial of adjuvant therapy in superficial bladder cancer: transurethral resection only versus transurethral resection plus mitomycin C versus transurethral resection plus bacillus Calmette-Guerin[J]. J Urol,1996,156(3):962-966.
[8] Witjes JA,Meijden AP,Collette L,et al.Long-term follow-up of an EORTC randomized prospective trial comparing intravesical bacille Calmette-Guerin-RIVM and mitomycin C in superficial bladder cancer[J].Urology,1998,52(3):403-410.
[9] 曹凤宏,浦践一,高伟兴,等. 羟喜树碱膀胱灌注预防膀胱癌术后复发[J].中国煤炭工业医学杂志,2004,7(6):49.
[10] 黄建,王国治,许纯兰,等. 国产治疗用卡介苗预防浅表性膀胱癌术后复发及不良反应的观察[J]. 中国生物制品学杂志,2010,23(4):419-421.
[11] 黄济云.丝裂霉素和卡介苗灌洗治疗膀胱癌的疗效对比观察和护理[J].临床合理用药杂志,2013,6(34):122.
[12] Smits G,Schaafsma E,Kiemeney L,et al. Microstaging of pT1 transitional cell carcinoma of the bladder:identification of subgroups with distinct risks of progression.[J].Urology,1998,52(6):1009-1014.
[13] Friedrich MG,Pichlmeier U,Schwaibold H,et al. Long-term intravesical adjuvant chemotherapy further reduces recurrence rate compared with short-term intravesical chemotherapy and short-term therapy with bacillus calmette-guérin (BCG)in patients with nonmuscle-invasive bladder carcinoma[J]. Eur Urol,2007,52(4):1123-1130.
[14] Malmstrom PU,Wijkstrom H,Lundholm C,et al.5-year followup of a randomized prospective study comparing mitomycin C and bacillus Calmette-Guerin in patients with superficial bladder carcinoma[J].J Urol,1999,161(4):1124-1127.
[15] 汪朔,余家琦,夏丹,等.表阿霉素单次膀胱灌注预防浅表性膀胱癌术后复发的前瞻性随机对照研究[J].中华泌尿外科杂志,2003,24(7):454-456.
[16] 王福利,秦卫军,王禾,等.鸦胆子和丝裂霉素及卡介苗膀胱灌注预防浅表性膀胱癌术后复发的前瞻性临床研究[J].中华肿瘤防治杂志,2010,17(8):622-624.
[17] Bohle A,Jocham D,Bock RP. Intravesical bacillus Calmette-Guerin versus mitomycin C for superficial bladder cancer:a formal meta-analysis of comparative studies on recurrence and toxicity[J].J Urol,2003,169(1):90-95.
[18] Malmstroma PU,Sylvester JR,Crawford ED,et al. An individual patient data meta-analysis of the long-term outcome of randomised studies comparing intravesical mitomycin C versus bacillus Calmette-Guerin for nonmuscle-invasive bladder cancer[J]. Eur Urol,2009,56(2):247-256.
[19] Shelley M,Court JB,Kynaston H,et al. Intravesical Bacillus Calmette-Guérin versus mitomycin C for Ta and T1 bladder cancer[J]. Cochrane Database Syst Rev,2003,(3):CD003231.

