肥胖、IGT、2型糖尿病患者与健康人血浆胰多肽水平的观察
何 雷,年碧霄,赵星辰,周 斌,谭泽世,尹翰鹏,欧阳奋竞,叶仁青
(南方医科大学珠江医院内分泌科,广州 510282)
论著·临床研究
肥胖、IGT、2型糖尿病患者与健康人血浆胰多肽水平的观察
何 雷,年碧霄,赵星辰,周 斌,谭泽世,尹翰鹏,欧阳奋竞,叶仁青△
(南方医科大学珠江医院内分泌科,广州 510282)
目的 探讨肥胖、糖耐量异常(IGT)、2型糖尿病患者与健康人血浆胰多肽(PP)水平的变化及意义。方法肥胖、IGT、2型糖尿病患者及健康对照者共47例,测定其基础、标准蛋白餐后15、30、60、120 min血浆PP及空腹血糖、胰岛素,比较并观察在肥胖、IGT、2型糖尿病患者中不同水平PP的意义。结果单纯肥胖组PP水平最低,肥胖伴糖耐量异常组及2型糖尿病组PP水平升高。结论肥胖、IGT、2型糖尿病患者中可能出现了影响PP分泌的自主神经功能改变。
糖尿病,2型;胰多肽;胰岛素;自主神经
研究显示,早在糖尿病自主神经病变发生之前,2型糖尿病患者已经出现自主神经功能的改变,自主神经负责机体脂肪代谢、影响胰岛细胞的分泌功能。在脂肪代谢方面:交感神经促进脂肪分解、副交感神经促进脂肪合成,文献报道干涉迷走神经功能可明显降低肥胖大鼠的脂肪积累[1],切断迷走神经可有效控制胃旁路术后患者血糖[2]。在胰岛内分泌方面:交感神经抑制胰岛β细胞分泌胰岛素,促进胰岛α细胞分泌胰高血糖素,副交感神经促进β细胞分泌胰岛素,抑制胰岛α细胞分泌胰高血糖素;另外副交感神经兴奋亦会促使胰岛pp细胞分泌胰多肽(pancreatic polypeptide,PP)。
PP是胰岛pp细胞分泌的36个氨基酸的多肽,PP的释放为迷走-胆碱能依赖性[3],受迷走神经调节并可被迷走神经干切除术和抗胆碱能药物所抑制。除迷走神经外,运动和饮食影响也会影响pp的分泌,蛋白质类食物刺激PP释放的作用最强,脂肪次之,葡萄糖最弱,PP的分泌几乎不受葡萄糖影响;另外也受激素,如胃泌素、胰泌素、胆囊收缩素、蛙皮素、血管活性肠肽、抑胃肽等的影响,其中胆囊收缩素是PP释放的主要调节剂[4]。假饲促进PP的释放,可被迷走神经切断术阻断。由于PP的分泌主要受副交感神经支配,上世纪80年代以来PP被认为是判断副交感神经功能变化的金标准[5]。
1 资料与方法
1.1 一般资料 本院门诊或住院男性患者47例,年龄40~45岁(排除性别与年龄对PP基础水平的影响),体质量指数(BMI)≥26 kg/m2,根据葡萄糖耐量试验分为单纯肥胖组(11例)、肥胖伴糖耐量异常组(IGT,12例)、2型糖尿病组(12例),健康对照组(12例),见表1。其中糖尿病诊断符合世界卫生组织1999 年糖尿病的诊断标准。各组均无吸烟史,无心血管、呼吸、消化系统疾病史,无肝肾功能障碍及其他内分泌代谢性疾病史。排除消化道溃疡、慢性胰腺炎(十二指肠溃疡刺激迷走神经,PP升高,胃溃疡时迷走神经张力降低,PP降低;慢性胰腺炎者外分泌功能受损,PP肽对餐后胰泌素的反应受损,对胆囊收缩素的刺激作用反应减弱,PP值下降)、肝肾功能不全、其他消化系统疾病(胃癌、胰腺炎、肝硬化等)、pp细胞瘤及抑郁症等影响PP分泌的疾病。
1.2 方法 抽取受检者空腹肘静脉血4 mL,并予以标准蛋白餐(75 g烤肉,1个水煮蛋),采集餐后15、30、60、120 min血清,分别检测血液生化、PP、胰岛素、葡萄糖等指标。利用美国RD公司人PP酶联免疫分析试剂盒检测PP,血糖采用葡萄糖氧化酶法,胰岛素采用美国RD公司生产的人血清胰岛素试剂盒,总胆固醇(TC)采用胆固醇氧化酶法,三酰甘油(TG)采用甘油磷酸氧化酶法,高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)采用一步清除法,高效液相柱色谱法检测糖化血红蛋白(HbA1c)。
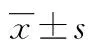
2 结 果
单纯肥胖组PP水平最低,与其他3组比较差异有统计学意义(P<0.05);IGT组及2型糖尿病组PP较健康对照组及单纯肥胖组升高;2型糖尿病组与IGT组在标准蛋白餐后30 min PP水平有差异,2型糖尿病组PP较IGT组低(P<0.05),见表2。
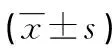
表1 各组人群一般资料比较
*:方差不齐,使用近似F检验Welch法;#:不符合正态分布,经自然对数转换;a:P<0.05,与健康对照组比较;b:P<0.05,与单纯肥胖组比较。
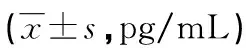
表2 各组标准餐后PP水平比较
#:不符合正态分布,经自然对数转换;a:P<0.05,与健康对照组比较;b:P<0.05,与单纯肥胖组比较;c:P<0.05,与IGT组比较;d:P<0.05,与2型糖尿病组比较。
3 讨 论
长期以来,2型糖尿病自主神经病变被认为是发生于糖尿病出现之后的一种并发症,由于高血糖所致的代谢障碍引起,然而上世纪80年代,已有人注意到早在糖尿病发生之前,机体就已出现了自主神经功能的改变,自主神经可影响机体脂肪代谢和胰岛细胞的内分泌功能。研究证实,干涉副交感神经功能可减少胰岛素介导的葡萄糖和脂肪酸的摄取,减少腹部脂肪的合成[6],副交感神经亦通过乙酰胆碱与毒蕈样受体结合,促使胰岛素和PP释放[7]。而交感神经则通过去甲肾上腺素、肾上腺素激活在B细胞膜上的α2受体抑制胰岛素的分泌,刺激胰高血糖素的分泌[8]。
PP的生理作用主要是抑制餐后胰液和胆汁分泌、抑制胆囊收缩素和胰酶的排放,也可抑制胃酸分泌,抑制消化道肌电活动。既往PP在肥胖患者升高或降低都有报道[9-11],本试验发现单纯性肥胖患者PP水平较对照组明显降低,肥胖合并糖耐量异常及糖尿病的患者PP水平出现升高,提示在肥胖而无血糖改变的患者可能出现了副交感神经功能降低,从而减少脂肪积累;而血糖升高的IGT和糖尿病患者,PP升高提示机体可能出现副交感神经功能亢进,刺激胰岛β细胞分泌胰岛素。
自主神经与机体脂肪代谢和胰岛细胞的内分泌功能密切相关,可能参与了2型糖尿病的发生,近年新开发的预测及检测糖尿病的人体生物监测仪(EZSCAN)即是根据自主神经功能变化预测和检测机体的IGT及糖尿病的发生[12]。本研究发现肥胖、糖尿病前期及糖尿病患者PP水平均有不同程度的改变,提示自主神经功能改变并不仅发生在糖尿病期的血糖改变之后,可能与机体脂肪代谢、血糖调节有关。此外,本试验还发现2型糖尿病组与IGT组相比PP水平在标准蛋白餐后30 min结果有差异,2型糖尿病组PP较IGT组低(P<0.05),可能与糖尿病自主神经功能改变有关,机体进入糖尿病后升高的血糖对自主神经造成影响,出现自主神经功能紊乱[13]——交感神经功能亢进、迷走神经功能减退现象,也不排除高血糖对胰岛pp细胞分泌功能的影响,有待进一步研究。
2型糖尿病的发生是多因素的,其中自主神经影响机体脂肪代谢,影响胰岛细胞的内分泌功能,与2型糖尿病的发生密切相关,目前2型糖尿病发病过程中自主神经功能变化的研究较少,值得探讨。
[1]Stearns AT,Balakrishnan A,Radmanesh A.Relative contributions of afferent vagal fibers to resistance to diet-induced obesity[J].Dig Dis Sci,2012(57):1281-1290.
[2]王平瑜,白雪峰,常乐,等.迷走神经切断协同改良胃旁路术治疗正常体重糖尿病研究应用[J].中华普外科手术学杂志,2012,6(2):38-43.
[3]Simpson K,Parker J,Plumer J,et al.The control of energy balance[J].Handb Exp Pharmacol,2012(209):209-230.
[4]矫叔华,杜宝恒.胰多肽与糖尿病性自主神经病变[J].国外医学:内分泌学分册,1990,10(2):75-77.
[5]Schwartz TW.Pancreatic polypeptide:a unique model for vagal control of endocrine systems[J].J Auton Nerv Syst,1983,9(1):99-111.
[6]Kreier F,Fliers E,Voshol PJ,et al.Selective parasympathetic innervation of subcutaneous and intra-abdominal fatfunctional implications[J].J Clin Invest,2002,110(9):1243-1250.
[7]Ahren B.Autonomic regulation of islet hormone secretion:implications for health and disease[J].Diabetologia,2000,43(4):393-410.
[8]Wierup N,Richards WG,Bannon AW,et al.CART knock out mice have impaired insulin secretion and glucose intolerance,altered beta cell morphology and increased body weight[J].Regul Pept,2005,129(1/2/3):203-211.
[9]邓尚平,汪秀琼,周文璧,等.单纯性肥胖者和糖尿病患者血清胰多肤水平观察[J].中内分泌杂志,1989,5(4):199-200.
[10]Glaser B,Zoghlin G,Pienta K,et al.Pancreatic polypeptide response to secretin in obesity:effects of glucose intolerance[J].Horm Metab Res,1988,20(5):288-292.
[11]Glasbrenner B,Dominguez-Munoz E,Riepl RL,et al.Cholecystokinin and pancreatic polypeptide release in diabetic patients with and without autonomic neuropathy[J].Dig Dis Sci,1995,40(2):406-411.
[12]Ramachandran A,Moses A,Shetty S,et al.A new non-invasive technology to screen for dysglycaemia including diabetes[J].Diabetes Res Clin Pract,2010(88):302-306.
[13]黄娅茜,王宪,孔炜.糖尿病心肌病发病机制的研究进展[J].生理科学进展,2010,41(1):31-36.
Observation on plasma pancreatic polypeptide level in patients with obesity,IGT and T2DM and healthy persons
HeLei,NianBixiao,ZhaoXingchen,ZhouBin,TanZeshi,YinHanpeng,OuyangFengjing,YeRenqing△
(DepartmentofEndocrinology,ZhujiangHospital,SouthernMedicalUniversity,Guangzhou,Guangdong510282,China)
Objective To explore the changes and significance of plasma pancreatic polypeptide(PP) levels in the patients with obesity or impaired glucose tolerance(IGT) or type 2 diabetes mellitus(T2DM) and the healthy controls.Methods Forty-seven persons of T2DM or IGT or obesity or normal control were determined plasma PP in the basic condition,at 15,30,60,120 min after standard protein dinner and the signiifcance of different levels of PP in the patients with obesity,IGT and T2DM was observed and compared.Results The plasma PP level in the obesity group was lowest and which in the IGT group and the T2DM group was increased.Conclusion The autonomic nervous function change affecting the PP secretion could be appeared in the patients with obesity,IGT and T2DM.
diabetes mellitus,type 2;pancreatic polypeptide;insulin;autonomic nerve
何雷(1978-),硕士,主治医师,主要从事内分泌代谢方面的研究。
△通讯作者,E-mail:99313984@qq.com。
:10.3969/j.issn.1671-8348.2015.13.017
R587.1;R446
A
1671-8348(2015)13-1777-02
2014-10-27
2015-02-17)

