体外共培养体系中胆管癌细胞对人脐静脉内皮细胞b-FGF和VEGF表达的影响
李 薇,杨 芸,宋富强,冯亚星,李 昆
(成都军区总医院临床实验医学研究与保障中心,成都 610083)
论著·基础研究
体外共培养体系中胆管癌细胞对人脐静脉内皮细胞b-FGF和VEGF表达的影响
李 薇,杨 芸,宋富强,冯亚星,李 昆△
(成都军区总医院临床实验医学研究与保障中心,成都 610083)
目的 探讨体外共培养体系中胆管癌细胞(QBC939)对人脐静脉内皮细胞(HUVEC)、碱性成纤维细胞生长因子(b-FGF)和血管内皮生长因子(VEGF)表达的影响。方法建立胆管癌QBC939细胞与HUVEC体外共培养体系,采用CCK-8法检测共培养不同时相HUVEC的增殖;ELISA检测共培养上清液中b-FGF含量;qRT-PCR 和Western blot 检测共培养不同时相点HUVEC细胞VEGF mRNA和蛋白质的表达。结果共培养后12、24、48 h和72 h,HUVEC增殖较对照组显著增高(P<0.01)。与0 h组比较,共培养12、24、48 h 上清液中b-FGF含量显著增高(P<0.05)。共培养12 h时VEGF mRNA 表达显著增加,并持续至72 h(P<0.01),VEGF蛋白表达在共培养12 h后显著增高,24、48、72 h 时与对照组比较差异有统计学意义(P<0.05)。结论人胆管癌QBC939细胞可促进血管内皮细胞增殖、增加b-FGF分泌和VEGF表达。b-FGF和VEGF表达增加与肿瘤血管新生,以及肿瘤的生长和转移可能具有相关性。
胆管肿瘤;内皮细胞;脐静脉;血管内皮生长因子A
胆管癌是来源于肝内或肝外胆管上皮的恶性肿瘤,早期临床症状不典型,易向周围组织、血管和神经浸润[1]。肿瘤内部血管生成对肿瘤生长、转移具有重要作用,肿瘤血管的生成涉及多种促血管生成因子,其中碱性成纤维细胞生长因子(b-Fibroblast growth factor,b-FGF)和血管内皮生长因子(vascular endothelial growth factor,VEGF)是最强有力的血管生成因子。研究表明肿瘤细胞与正常内皮细胞共培养体系能够在体外有效诱导正常内皮细胞的瘤化发展及血管新生。本研究通过建立体外胆管癌细胞QBC939和人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)共培养体系,观察共培养时HUVEC细胞增殖,以及b-FGF分泌和VEGF表达的变化,探讨胆管癌细胞对正常内皮细胞功能的影响。
1 材料与方法
1.1 材料 人胆管癌细胞株QBC939由第三军医大学西南医院王曙光教授惠赠;HUVEC购于武汉大学典型物种保存中心。胎牛血清、DMEM培养基、双抗(penicillin/streptomycin)、0.25%胰蛋白酶购于HyClone公司;TRIzol试剂(R0016)、CCK-8试剂盒购自碧云天生物技术有限公司;人VEGF抗体(AB52916)购于Abcam公司,免疫印迹试剂盒(KC-5G5)购于康成生物公司;一步法实时定量PCR试剂盒(DRR086A)购自TAKARA公司;ELISA试剂盒(DFB50)购于R&D公司。美国Thermo 3111二氧化碳孵箱、日本Olympus CKX41-A32PH倒置显微镜,美国Thermo Multiskan GO全自动酶标仪、美国UVP BioSpectrum410化学发光凝胶成像系统、美国BIO-RAD CFX96型实时定量PCR仪等。
1.2 方法
1.2.1 细胞共培养 取对数生长期的QBC939细胞置于24孔Transwell共培养系统下室,HUVEC加入共培养系统上室,QBC939细胞和HUVCE在含10%胎牛血清的DMEM培养基共培养,细胞初始浓度比为2∶1。同时另外单独培养QBC939和HUVEC细胞于共培养系统的下室和上室,上、下室为相同培养基。以共培养0 h为对照组,共培养12、24、48和72 h时,分别检测培养上清液b-FGF的分泌,各组HUVEC细胞增殖,以及VEGF mRNA和蛋白质的表达。
1.2.2 CCK-8比色法检测HUVEC增殖 取HUVEC按1×103加入96孔Transwell共培养系统的上室,QBC939 细胞接种于共培养系统的下室,QBC939细胞和HUVEC共培养细胞浓度比例为2∶1,同时按相同浓度接种HUVEC单独培养于上室,每孔加入DMEM培养液100 μL,CCK-8 10 μL,于37 ℃、5%CO2培养箱中分别共培养0 h和12、24、48、72 h,酶标仪上选定450 nm为测定波长,630 nm为参考波长,检测每孔光密度值(OD值),以共培养各时相OD值减去相应单独培养HUVEC的OD值,得出共培养QBC939对HUVEC增值的影响。
1.2.3 ELISA检测共培养上清液中b-FGF 取100 μL收集的上清液,检测步骤按试剂盒说明书进行,显色后酶标仪450 nm测OD值,共培养各时相OD值减去相应单独培养QBC939和HUVCE各组的OD值,根据绘制的标准曲线求出b-FGF含量。
1.2.4 实时定量聚合酶链反应(qRT-PCR)检测VEGF-mRNA VEGF扩增引物(540 bp):上游5′-GGA GTA CCC TGA TGA GAT CGA G-3′;下游5′-CAT TTG TTG TGC TGT AGG AAG C-3′。内参GAPDH 扩增引物(715bp):上游5′-CAA ATT CCA TGG CAC CGT CA-3′;下游5′-GGA GTG GGT GTC GCT GTT GA-3′均由上海生物工程有限公司合成。Trizol法提取RNA,取40 ng RNA行qRT-PCR扩增,步骤按试剂盒说明书进行。共培养各时相mRNA的相对表达量减去相应单独培养HUVEC各组mRNA的相对表达量,得出共培养QBC939对HUVEC VEGF-mRNA 表达的影响。
1.2.5 Western blot检测VEGF蛋白表达 常规提取蛋白质,BCA法定量,取50 μg样品加入5×SDS-PAGE样品缓冲液,沸水煮5 min,行SDS-PAGE蛋白电泳,内参为GAPDH。其后转移至PVDF膜,按免疫印迹试剂盒说明书操作,化学发光凝胶成像系统检测VEGF表达量。共培养各时相蛋白的相对表达量减去相应单独培养HUVEC各组蛋白相对表达量,得出共培养QBC939对HUVEC细胞VEGF 蛋白表达的影响。
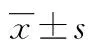
2 结 果
2.1 CCK-8法检测QBC939和HUVEC共培养对HUVEC细胞增殖的影响 共培养12、24、48 h和72 h时,HUVEC增殖较对照组显著增加(P<0.01)。共培养72 h HUVEC细胞增殖能力较12 h显著增加(P<0.01),和24、48 h差异无统计学意义(P>0.05)。
2.2 共培养不同时间b-FGF的分泌变化 共培养0、12、24、48、72 h,b-FGF分别为0.665 3±0.070 8、0.814 8±0.061 7、0.806 6±0.063 1、0.800 2±0.034 3、0.700 4±0.092 5。与0 h组比较,共培养12、24、48 h时HUVEC细胞b-FGF显著增加(P<0.05);72 h时b-FGF较0 h有所增加,但差异无统计学意义(P>0.05)。
2.3 共培养不同时间HUVEC的VEGF mRNA及蛋白表达变化 共培养0、12、24、48、72 h,VEGF mRNA分别为1.000 0±0.177 6、1.258 6±0.086 9、1.492 2±0.124 7、1.611 2±0.079 9、1.719 5±0.099 3。共培养12 h时HUVEC的VEGF mRNA表达升高,持续至72 h(P<0.01);共培养72 h和12、24 h比较显著增高(P<0.01),和48 h比较有所增高,但差异无统计学意义(P>0.05)。VEGF蛋白表达在共培养12 h时亦显著升高,持续至72 h(P<0.01);共培养72 h较12 h时显著增高(P<0.01),和24、48 h比较有所增高,但差异无统计学意义(P>0.05)(图1)。
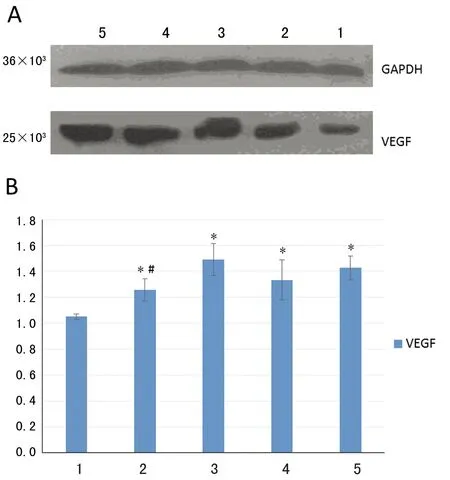
*:P<0.01,与共培养0 h组比较;#:P<0.01,与共培养72 h组比较。1:共培养0 h组;2:共培养12 h组;3:共培养24 h组;4:共培养48 h组;5:共培养72 h组。
图1 共培养不同时间HUVEC的VEGF蛋白表达
3 讨 论
肿瘤微环境中各类细胞相互接触、相互依存、相互作用,共同维持着肿瘤的各种特性。血管新生是肿瘤生长和转移的重要病理基础和条件[2-3]。肿瘤细胞和周边宿主细胞分泌表达多种细胞因子,这些因子所形成的微环境有利于新生血管的生成,其中b-FGF和VEGF是最重要的血管生成因子,对内皮细胞具有高度特异性。研究显示[4-6],肿瘤细胞的条件培养液可刺激血管内皮细胞的增殖,增加黏附力和侵袭力,促进血管形成。本研究采用共培养方式,观察胆管癌细胞株QBC939对HUVEC增殖及促血管生成因子分泌的影响,结果表明体外共培养胆管癌细胞和HUVEC,可促进HUVEC的增殖及b-FGF分泌与VEGF的表达增加。
b-FGF是FGF家族中的重要成员,诱导内皮细胞萌芽、增殖,增加血管通透性,促进血管新生[7]。有研究[8]证实,丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)是b-FGF和VEGF共同信号通路中的一个重要信号蛋白,通过激活MAPK可促使内皮细胞间的连接和增殖。早在1998年,Seghezzi等[9]就提出b-FGF主要通过细胞的自分泌机制上调VEGF在内皮细胞中的表达。随后的研究发现,b-FGF可通过刺激VEGF的表达及肿瘤血管内皮细胞的增殖作用激活血管新生[10]。bFGF通过与靶细胞上的受体结合而发生作用,因此细胞内合成的b-FGF须分泌到细胞外才能发挥其生物学功能。本实验结果中,b-FGF的分泌在共培养12 h即显著升高,24、48 h亦显著高于对照组;VEGF mRNA和蛋白的表达在共培养各时相点均较对照组显著升高。VEGF 能特异性促进血管内皮细胞分裂增殖,同时增加血管通透性,使血管内成分渗漏,为血管内皮的迁移及血管形成提供基质。本研究共培养72 h时,HUVEC增殖虽显著高于对照组和12 h组,但较24、48 h时差异无统计学意义;共培养72 h时,b-FGF分泌较对照组差异不显著,而VEGF的表达显著高于对照组,推测可能与共培养72 h时HUVEC增殖减缓及细胞分泌b-FGF能力降低有关。此外,VEGF的表达还可能受到其他因子的调控[11-12]。
本研究表明,胆管癌细胞能促进血管内皮细胞的增殖,以及b-FGF分泌和VEGF表达,增强内皮细胞血管生成的能力,为肿瘤发生、发展和转移提供条件和环境。实验结果可为胆管癌治疗中抗血管生成积累资料,在此基础上,有待进一步研究其机制。
[1]汪华霖.肝门部胆管癌的诊治进展[J].重庆医学,2013,42(9):1072-1074.
[2]Ribatti D,Moschetta M,Vacca A,et al.Microenvironment and multiple myeloma spread [J].Thromb Resi,2014,133(2):102-106.
[3]Wahl ML,Moser TL,Pizzo SV.Angiostatin and anti-angiogenic therapy in human disease [J].Endo Soci,2004(59):73-104.
[4]Cao Y,E G,Wang EF,et al.VEGF Exerts an Angiogenesis-Independent function in cancer cells to promote their malignant progression[J].Cancer Res,2012,72(16):3912-3918.
[5]Chaitanya GV,Cromer WE,Wells SR,et al.Gliovascular and cytokine interactions modulate brain endothelial barrier in vitro [J].J Neuro inflammation,2011,8(1):162-178.
[6]Gavalas NG,Liontos M,Trachana SP,et al.Angiogenesis-related pathways in the pathogenesis of ovarian cancer [J].Int J Mol Sci,2013,14(8):15885-15909.
[7]Fontijn D,Bosch LJ,Duyndam MC,et al.Basic fibroblast growth factor-mediated overexpression of vascular endothelial growth factor in 1F6 human melanoma cells is regulated by activation of PI-3K and p38MAPK[J].Cell Oncol,2009,31(3):179-190.
[8]Eriksson K,Magnusson P,Dixelius J,et al.Angiostatin and endostatin inhibit endothelial cell migration in response to FGF and VEGF without interfering with specific intracellular signal transduction pathways[J].FEBS Lett,2003,536(1):19-24.
[9]Seghezzi G,Patel S,Ren CJ,et al.Fibroblast growth factor-2 (FGF-2) induces vascular endothelial growth factor(VEGF) expression in the endothelial cells of forming capillaries:an autocrine mechanism contributing to angiogenesis [J].J Cell Biol,1998,141(7):1659-1673.
[10]Eichholz A,Merchant S,Gaya AM.Anti-angiogenesis therapies:their potential in cancer management[J].Onco Targets Ther,2010,3(3):69-82.
[11]Eveno C,Pocard M.VEGF levels and the angiogenic potential of the microenvironment can affect surgical strategy for colorectal liver metastasis[J].Cell Adh Migr,2012,6(6):569-573.
[12]Andreas P,Michael M,Joachim D.Liver cancer:Targeted future options[J].World J Hepatol,2011,3(2):38-44.
Influence of cholangiocarcinoma cell lines on expression of b-FGF and VEGF in HUVEC in a co-culture system*
LiWei,YangYun,SongFuqiang,FengYaxing,LiKun△
(CenterofLaboratoryMedicine,ChengduMilitaryGeneralHospital,Chengdu,Sichuan610083,China)
Objective To study the influence of cholangiocarcinoma cell lines on the expression of b-FGF and VEGF in human umbilical vein endothelial cell (HUVEC) in a co-culture system.Methods A co-culture system of cholangiocarcinoma cell lines QBC939 and HUVEC were established in vitro.QBC939 cells and HUVCE were co-cultured for 12,24,48 and 72 h respectively,the proliferation of HUVEC was detected by CCK-8 assay.The b-FGF level in cell culture supernatant was detected by ELISA assay.The mRNA and protein expression levels of VEGF were detected by qRT-PCR and Western blot analysis.Results The proliferation of HUVEC was significantly increased at 12,24,48 and 72 h after incubation in a co-culture system (P<0.01).The mRNA expression level of VEGF in HUVEC was gradually increased after 12 h incubation with a time-dependent manner.It showed that the protein level of b-FGF and VEGF was also significantly increased at 12,24,48 h after incubation as compared to the control(P<0.05).Conclusion Human cholangiocarcinoma cells can promote the proliferation of endothelial cells,increase the secretion of b-FGF and upregulate the expression of VEGF,suggesting that the expressions of b-FGF and VEGF may be correlated with the tumor angiogenesis.
bile duct neoplasms;endothelial cells;umbilical veins;vascular endothelial growth factor A
:10.3969/j.issn.1671-8348.2015.13.008
四川省卫生厅科学研究项目(100091)。
李薇(1986-),硕士,主管技师,主要从事细胞生物学方面的研究。
△通讯作者,E-mail:kunli2005@sina.com。
R575.7
A
1671-8348(2015)13-1749-03
2014-10-28
2015-01-13)

