酒石酸氢可酮片的人体药代动力学研究
郝光涛,曲恒燕,张丽娟,李媛媛,高洪志,董瑞华,王晓芳,梁宇光,张媛媛,刘泽源,张 宏(.军事医学科学院附属医院临床药理研究室,北京 0007;.安徽医科大学,安徽 合肥 3003)
·实验研究·
酒石酸氢可酮片的人体药代动力学研究
郝光涛1,曲恒燕1,张丽娟1,李媛媛1,高洪志1,董瑞华1,王晓芳1,梁宇光1,张媛媛2,刘泽源1,张宏1(1.军事医学科学院附属医院临床药理研究室,北京 100071;2.安徽医科大学,安徽 合肥 230032)
目的:研究酒石酸氢可酮片的人体药代动力学。方法:本研究采用单次给药、平行设计试验方法,按照给药剂量5、10、15 mg(低、中、高)分为三组,每组10人。通过高效液相色谱串联质谱(HPLC-MS/MS)法测定血浆中氢可酮及其两种代谢产物(去甲基氢可酮和氢吗啡酮)的浓度。采用WinNonlin 6.1分析软件计算药代动力学参数。结果:氢可酮、去甲基氢可酮的线性范围均为0.05 ~ 50.00 μg·L-1,氢吗啡酮的线性范围为0.01 ~ 10.00 μg·L-1;受试者口服酒石酸氢可酮片后体内氢可酮、去甲基氢可酮的Cmax、AUC0-t和AUC0-∞随剂量增加而增加与给药剂量呈良好线性关系。研究过程中无严重不良事件发生。结论:HPLC-MS/MS测定法灵敏、准确、简便,适用于血浆中氢可酮及其代谢产物浓度的测定以及人体药代动力学研究。
酒石酸氢可酮;药代动力学;高效液相色谱串联质谱;血药浓度
氢可酮(hydrocodone,HC)是一种常见、半合成的阿片类麻醉性镇咳、镇痛药,主要作用于中枢神经系统和平滑肌,适用于咳嗽以及重度疼痛的治疗。
目前已报道几种检测血浆或者血液中氢可酮或氢吗啡酮的方法[1],主要采用高效液相色谱法或液相色谱串联质谱法[2],气相色谱-质谱法[3],然而,尚未有同时检测氢可酮、去甲基氢可酮及氢吗啡酮方法的建立。此外,酒石酸氢可酮片在中国非癌性疼痛患者体内药代动力学的研究较少。本文在参考文献[4]的基础上,建立了同时检测氢可酮及其代谢产物去甲基氢可酮和氢吗啡酮的HPLC-MS/MS法,研究酒石酸氢可酮在中国非癌性疼痛患者体内的药代动力学过程,为临床合理应用本品提供参考。
1 材料
1.1仪器
1200高效液相色谱-串联质谱联用仪(美国Agilent公司):高效液相色谱系统包括二元输液泵、自动进样器、柱温箱;串联质谱仪为API 3000型三重四极杆串联质谱仪,含电喷雾离子化源以及串联三重四极杆质谱检测器。色谱工作站:Analyst 1.4.2 数据处理软件(美国AB公司)。GL-88B漩涡混合仪(海门市其林贝尔仪器制造有限公司);AB104电子分析天平(瑞士Mettler Toledo公司);3-18K型高速低温离心机(德国Sigma公司);Milli-Q Plus 纯水器(美国密理博中国有限公司);Empore MPC-SD 固相萃取盘(美国LabTech有限公司)。
1.2药品与试剂
酒石酸氢可酮片(青海制药厂有限公司,批号20100454);氢可酮(含量:99%,青海制药厂有限公司,批号02-01682,);盐酸去甲基氢可酮(含量:1.000±0.003 mg·mL-1,青海制药厂有限公司,批号FE010908-01);氢吗啡酮(含量:1.000±0.006 mg·mL-1,青海制药厂有限公司,批号FE080509-02);氢可酮-D3(含量:101.2±0.8 µg·mL-1,青海制药厂有限公司,批号FE060208-01);去甲基氢可酮-D3(含量:99.6±0.8 µg·mL-1,青海制药厂有限公司,批号FE082708-02);氢吗啡酮-D3(含量:96.9±0.7 µg·mL-1,青海制药厂有限公司,批号FE092507-01);甲酸、乙腈、二氯甲烷、异丙醇、三氟乙酸、氨水、甲酸铵均为色谱纯,均由DIMA公司提供;试验用水为去离子水,本实验室自制;其它试剂为AR试剂。
2 方法
2.1研究对象
30例非癌性疼痛受试者(男性15名,女性15名)参加本试验,年龄(36.2 ± 4.15)岁,身高(166 ± 5) cm,体质量(61.2 ± 6.81) kg,BMI(21.94 ± 1.21) kg·m-2。在给药前的第7天至给药前第1天对受试者进行检查来决定是否符合入选标准,符合入选标准的受试者,入住军事医学科学院附属医院临床药理学研究室Ⅰ期实验病房,整个实验过程由医生及护士监护。本实验的方案、知情同意书及其它相关实验文件都已递交军事医学科学院附属医院药物临床试验伦理委员会备案,并获得该伦理委员会的批准(审批号:2010-1-10,备案号:2011-03-34)。下列检测在受试者签署书面知情同意书之后进行。
检查项目包括:入选/排除标准、体格检查、生命体征(血压、脉搏、体温、呼吸频率)、心电图、实验室检查(血常规、血生化、尿常规)、尿妊娠检查(女性受试者)、酒精呼吸检查、烟检、尿液药物筛查,无精神病及遗传病史,如果怀疑有食物或其它影响因素影响了筛选期的化验结果,可以在除去影响因素的情况下重新检查,要求记录重复检查的结果和原因。
2.2给药方案及血样采集
本研究采用单次给药设计,共计30例受试者[5-6],每10例受试者分为一组,共3组,采用平行试验方法进行试验。
试验前后24 h内不得饮酒及咖啡类饮品。给药当日受试者空腹,由研究者和护士按试验设计给予受试者相应剂量的药物(5、10、15 mg),并做记录。给药完成后在“试验药品使用登记表”上记录给药剂量及给药时间并由受试者签字,最后由研究者和临床医生共同签字确认。受试者用200 mL的温开水送服药物。
分别于给药前及给药后15 min、30 min、45 min、1 h、1.5 h、2 h、4 h、6 h、8 h、12 h、24 h、36 h,采集上肢静脉血5 mL,肝素抗凝血样,静置0.5 h左右,3000 r·min-1离心10 min ,分离上层血浆,置于– 40 ℃冰箱保存待测。
实验结束出院前(给药后36 h),对受试者进行相关检查,包括体格检查、生命体征(血压、脉搏、体温、呼吸频率)、心电图、实验室检查(血常规、血生化、尿常规),并记录在此期间的合并用药及不良事件。如有检查项目异常且有临床意义,应追踪随访至检查项目恢复正常或可接受的稳定范围。以实验前后各项实验室检查和实验期间的生命体征为指标进行安全性评价[7]。
2.3血浆样品的处理与测定
精密量取200 μL血浆样品置1.5 mL离心管中,加100 μL内标工作溶液,及300 μL 0.1%三氟乙酸溶液,涡旋混合,待做固相萃取。
SPE:(1)活化:依次用400 μL洗脱液(含2%氨水的二氯甲烷-异丙醇混合溶液(80∶20)、400 μL甲醇、400 μL三氟乙酸溶液(0.1%甲酸)进行柱活化;(2)上样:取待上样样品600 μL至SPE小柱上;(3)淋洗:依次用400 μL水、400 μL 0.1%三氟乙酸溶液、400 μL乙腈、400 μL二氯甲烷-异丙醇混合溶液(80 : 20)淋洗;(4)洗脱:用400 μL洗脱液分2次连续洗脱。
收集洗脱液800 μL,通氮气流40 ℃蒸发至干燥。
用200 μL的流动相溶液(A∶B = 90∶10)复溶,涡旋15 s,取50 μL进样,进行HPLC-MS/MS分析。
2.4色谱和质谱条件
色谱柱:Kromasil 100-5 SIL-Dimensions柱 (2.1 mm×100 mm,5.0 μm,Thermo Hypersil-Keystone,USA);流动相A:含20 mmol甲酸铵的0.2%甲酸溶液,流动相B:0.1%甲酸的乙腈溶液;流速:0.75 mL·min-1;柱温:20 ℃;进样量:50 μL。梯度洗脱,分别在0、0.3、1、3.6、3.7、6.5 min将流动相A/B(v/v)调整为(5 : 95)、(5 : 95)、(12 : 88)、(12 : 88)、(5 : 95)、(5 : 95)。
离子源:电喷雾离子化源(ESI源);离子极性:正离子(positive);离子检测方式:多反应监测(MRM)方式;喷射电压:2000 V;离子源温度:540 ℃;源内气体1(GS1,N2)压力:7 psi;源内气体2(GS2,N2)压力:12 psi;气帘气体(N2)压力:6 psi;碰撞气(CAD,N2)压力:6 psi;CE电压:氢可酮38 V,去甲基氢可酮40 V,氢吗啡酮39 V;DP电压(解簇电压):35 V。
2.5数据分析
采用WinNonlin 6.1药代动力学分析软件标准,非房室模型方法根据所测的受试者血药浓度时间数据计算药代动力学参数,对各剂量组Cmax和AUC与给药剂量进行线性回归分析。
3 结果
3.1氢可酮、去甲基氢可酮和氢吗啡酮的色谱行为及专一性
氢可酮、氢吗啡酮、去甲基氢可酮和内标氢可酮-D3、氢吗啡酮-D3、去甲基氢可酮-D3的保留时间以及Q1、Q3选择离子详见表1,典型的MRM色谱图见图1 ~ 3。结果表明,空白血浆中的内源性物质不干扰氢可酮、氢吗啡酮、去甲基氢可酮和内标氢可酮-D3、氢吗啡酮-D3、去甲基氢可酮-D3的测定。
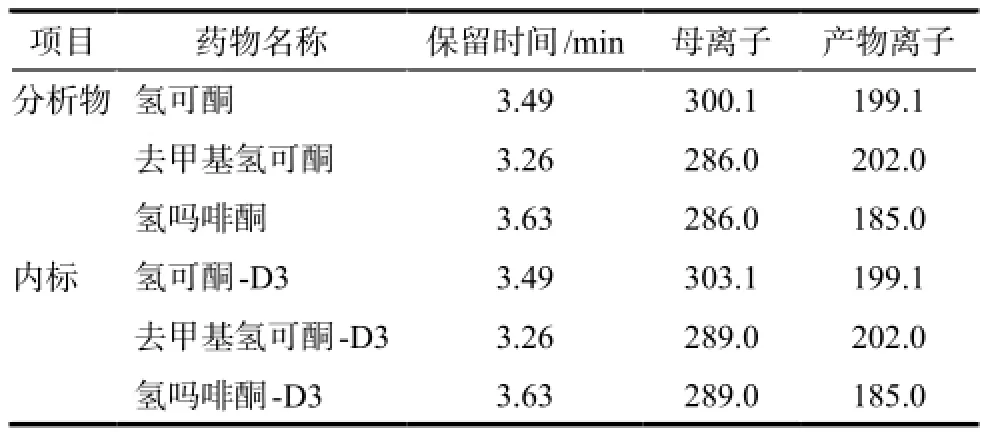
表1 分析物和内标的保留时间及质谱m/z选择Tab 1 The retention time of analyte and internal standard and the selection ofm/z
3.2血浆样品标准曲线
取6名受试者的空白血浆(由军事医学科学院附属医院提供)混合,分别精密加入标准系列溶液的混合对照品溶液,涡旋混匀,配成含氢可酮、去甲基氢可酮的浓度各分别为0.05、0.10、0.20、0.50、2.00、5.00、20.00、50.00 µg·L-1的标准含药血浆,氢吗啡酮的浓度各分别为0.01、0.02、0.04、0.10、0.40、1.00、4.00、10.00 µg·L-1的标准含药血浆,按上述血浆样品处理方法进行测定。以血浆中待测物浓度(X)为横坐标,待测物与内标的峰面积比值(Y)为纵坐标,用加权(权重系数w = 1/x2)最小二乘法进行回归运算,求得回归方程:氢可酮:Y = 0.377 X + 2.15×10-4,r = 0.998 7,定量下限为0.05 µg·L-1;去甲基氢可酮:Y = 0.384 X + 3.21×10-4,r = 0.999 2,定量下限为0.05 µg·L-1;氢吗啡酮:Y = 0.467 X + 7.25×10-4,r = 0.999 4,定量下限为0.01 µg·L-1。

图1 血浆中氢可酮和内标氢可酮-D3的典型MRM色谱图A – 空白血浆,B – 空白血浆中加入氢可酮(2 µg·L-1)和内标氢可酮-D3(2 µg·L-1),C – 1号受试者口服5 mg酒石酸氢可酮片0.75 h后血浆药物浓度;1 – 氢可酮,2 – 内标氢可酮-D3Fig 1 Typical MRM chromatograms of hydrocodone and D3-hydrocodone (IS) in plasmaA – blank plasma, B – blank plasma adding hydrocodone (2 µg·L-1) and D3-hydrocodone (IS) (2 µg·L-1), C – oral dose of hydrocodone tartrate 5 mg after 0.75 h in subject No.1; 1 – hydrocodone, 2 – D3-hydrocodone
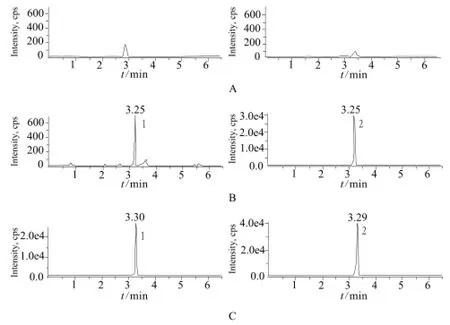
图2 血浆中去甲基氢可酮和内标去甲基氢可酮-D3的典型MRM色谱图A – 空白血浆,B – 空白血浆中加入去甲基氢可酮(2 µg·L-1)和内标去甲基氢可酮-D3(2 µg·L-1),C – 1号受试者口服5 mg酒石酸氢可酮片0.75 h后血浆药物浓度;1 – 去甲基氢可酮,2 – 内标去甲基氢可酮-D3Fig 2 Typical MRM chromatograms of demethylation of hydrocodone and D3-demethylation of hydrocodone (IS) in plasmaA – blank plasma, B – blank plasma adding demethylation of hydrocodone (2 µg·L-1) and D3-demethylation of hydrocodone (IS) (2 µg·L-1), C – oral dose of hydrocodone tartrate 5 mg after 0.75 h in subject No.1; 1 – demethylation of hydrocodone, 2 – D3- demethylation of hydrocodone
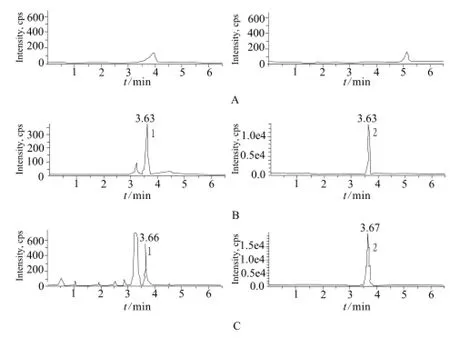
图3 血浆中氢吗啡酮和内标氢吗啡酮-D3的典型MRM色谱图A – 空白血浆,B – 空白血浆中加入氢吗啡酮(2 µg·L-1)和内标氢吗啡酮-D3(2 µg·L-1),C – 1号受试者口服5 mg酒石酸氢可酮片0.75 h后血浆药物浓度;1 – 氢吗啡酮,2 – 内标氢吗啡酮-D3Fig 3 Typical MRM chromatograms of hydromorphone and D3-hydromorphone (IS) in plasmaA – blank plasma, B – blank plasma adding hydromorphone (2 µg·L-1) and D3-hydromorphone (IS) (2 µg·L-1), C – oral dose of hydrocodone tartrate 5 mg after 0.75 h in subject No.1; 1 – hydromorphone, 2 – D3-hydromorphone
3.3方法学考察
制备含氢可酮、去甲基氢可酮分别为0.125、3.000、40.000 μg·L-1的标准含药血浆,氢吗啡酮为0.025、0.600、8.000 μg·L-1的标准含药血浆(每个浓度做6份样品)及一条随行标准曲线,按上述处理血浆的方法操作。每天做一批及一条随行标准曲线,连续做3 d,共3批,每批每个浓度做6份样品,计算回收率、批内和批间精密度,结果见表2。
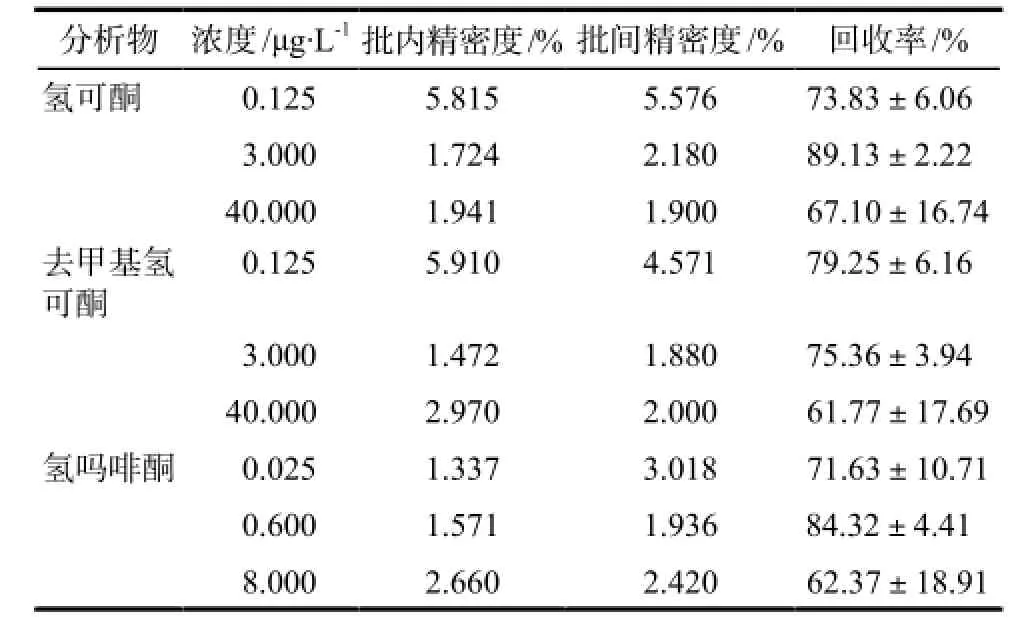
表2 HPLC-MS/MS法测定血浆中氢可酮、去甲基氢可酮和氢吗啡酮的精密度和回收率.n= 18Tab 2 Accuracy and recovery of hydrocodone, hydromorphone and demethylation of hydrocodone in plasma with HPLC-MS/MS.n= 18
3.4血药浓度测定结果和主要药代动力学参数
受试者单次口服酒石酸氢可酮片5、10、15 mg后氢可酮平均血药浓度-时间曲线见图4;酒石酸氢可酮的代谢产物去甲基氢可酮、氢吗啡酮的平均血药浓度-时间曲线见图5和图6。
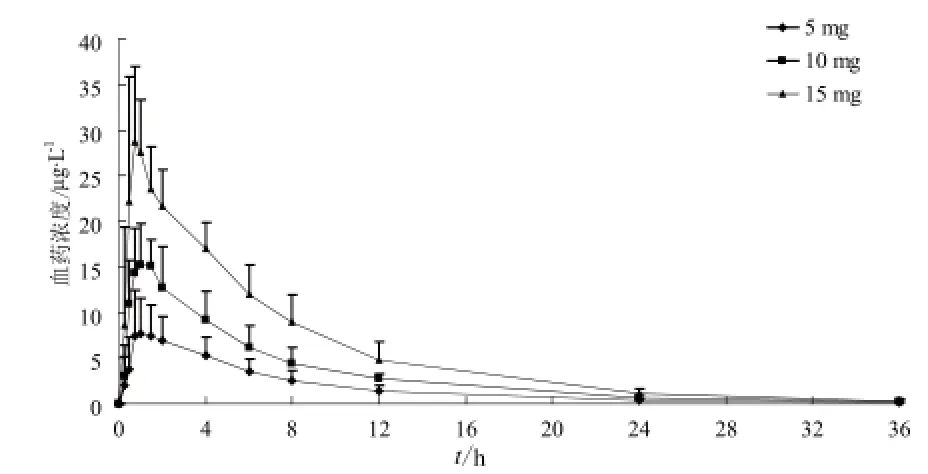
图4 受试者单次口服酒石酸氢可酮片5、10、15 mg后氢可酮平均血药浓度-时间曲线.n= 10Fig 4 Mean plasma concentration-time curve of hydrocodone in subjects after the oral dose of 5, 10, 15 mg of hydrocodone tartrate.n= 10
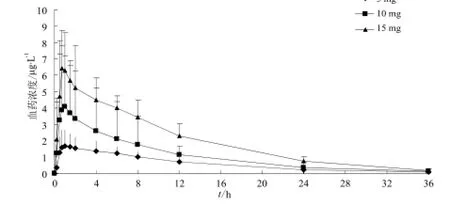
图5 受试者单次口服酒石酸氢可酮片5、10、15 mg后去甲基氢可酮平均血药浓度-时间曲线.n= 10Fig 5 Mean plasma concentration-time curve of demethylation hydrocodone in subjects after the oral dose of 5, 10, 15 mg of hydrocodone tartrate.n= 10
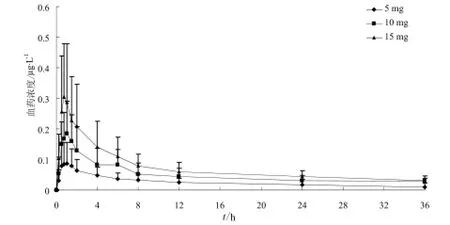
图6 受试者单次口服酒石酸氢可酮片5、10、15 mg后氢吗啡酮平均血药浓度-时间曲线.n= 10Fig 6 Mean plasma concentration-time curve of hydromorphone in subjects after the oral dose of 5, 10, 15 mg of hydrocodone tartrate.n= 10
采用WinNonlin 6.1药代动力学分析软件标准非房室模型方法根据血药浓度数据计算每个受试者的药代动力学参数,受试者给予不同剂量酒石酸氢可酮后,氢可酮、去甲基氢可酮、氢吗啡酮的平均药代动力学参数见表3。
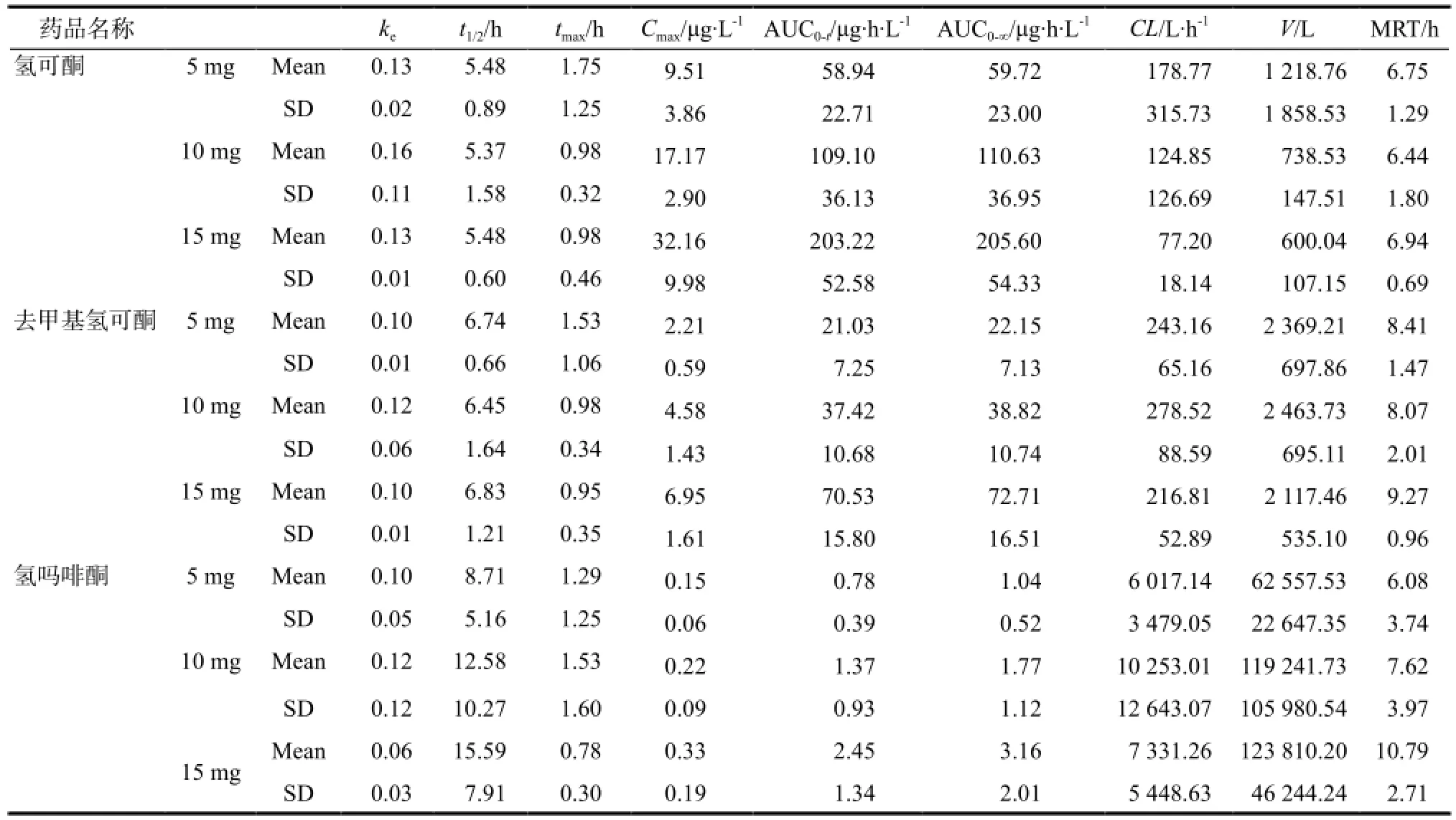
表3 受试者单次口服各剂量酒石酸氢可酮片后氢可酮、去甲基氢可酮和氢吗啡酮的平均药代动力学参数Tab 3 Main pharmacokinetic parameters of hydrocodone, demethylation of hydrocodone and hydromorphone in subjects after the oral dose of hydrocodone tartrate
从主要药代动力学参数可以看出,氢可酮的Cmax、AUC0-t随剂量增加而增加,将氢可酮Cmax、AUC0-t和AUC0-∞平均值分别与剂量进行线性回归,Cmax、AUC0-t和AUC0-∞与给药剂量的相关系数分别为0.983 0、0.984 9和0.985 1。去甲基氢可酮的Cmax、AUC0-t随剂量增加而增加,将去甲基氢可酮Cmax、AUC0-t和AUC0-∞平均值分别与剂量进行线性回归,Cmax、AUC0-t和AUC0-∞与给药剂量的相关系数分别为1、0.981 5和0.981 2。氢吗啡酮的Cmax、AUC0-t随剂量增加而增加,将氢吗啡酮Cmax、AUC0-t和AUC0-∞平均值分别与剂量进行线性回归,Cmax、AUC0-t和AUC0-∞与给药剂量的相关系数分别为0.991 9、0.991 0和0.984 2。
3.5不良事件
本研究过程中,对中国非癌性疼痛的患者单次经口服给予5、10和15 mg酒石酸氢可酮片,共入选了30例受试者,男女各半。共有15例受试者发生不良事件22例次,主要表现为嗜睡5例次(22.73%)、头晕9例次(40.91%)、恶心4例次(18.18%)、呕吐2例次(9.09%)、乏力1例次(4.55%)、胸闷1例次(4.55%);其中与试验药物可能相关的不良事件16例次(72.73%),很可能相关的6例次(27.28%);严重程度为:轻度22例次(100%);没有对受试者采取对症处置。无受试者因不良事件而退出试验。
4 讨论
Valtier等[8]通过HPLC-MS/MS法测定血浆中氢可酮、氢吗啡酮和未经酶代谢的氢可酮的浓度,相比于该方法,本实验建立的HPLC-MS/MS法同时检测人血浆中氢可酮及其代谢产物去甲基氢可酮和氢吗啡酮的浓度,灵敏度高,结果可靠,样品分析时间短(仅需6.5 min),定量下限最低达到0.01 μg·L-1。固相萃取的血浆样品前处理法可同时完成样品富集与净化,大大提高了检测灵敏度,该法比液液萃取更快,更节省溶剂,具有重现性好的优点。本法经方法学考察得出的批内、批间精密度和回收率均符合人体药代动力学要求。
从本研究所得的主要药代动力学参数可以看出,对于中国非癌性疼痛的患者单次经口服给予5、10和15 mg酒石酸氢可酮片,氢可酮、去甲基氢可酮、氢吗啡酮的平均Cmax和AUC0-t随剂量增加而增加,呈良好线性关系。代谢产物去甲基氢可酮和氢可酮的半衰期相似,氢吗啡酮的半衰期较长。代谢产物的血浆半衰期均较母体的半衰期长。同时,各剂量组氢可酮、去甲基氢可酮、氢吗啡酮的平均Cmax和AUC0-t的标准差较大,说明此类药物及其代谢产物的药代动力学过程存在较大的个体差异。
单次使用酒石酸氢可酮片治疗的受试者所发生的常见不良事件与使用阿片类药物后所报告的常见不良事件相吻合。无受试者因不良事件退出试验。研究过程中无严重不良事件发生。结果表明对中国非癌性疼痛的患者单次经口服给予5、10和15 mg酒石酸氢可酮片,安全性良好。据报道[7],美国食品药品监督管理局(FDA)于2013年10月批准重酒石酸氢可酮缓释胶囊上市,该药可为疼痛治疗提供新的处方选择。
[1] Otton SV, Schadel M, Cheung SW, et al. CYP2D6 phenotype determines the metabolic conversion of hydrocodone to hydromorphone[J]. Clin Pharmacol Ther, 1993, 54(5): 463-472.
[2] Dahn T, Gunn J, Kriger S, et al Quantitation of morphine, codeine, hydrocodone, hydromorphone, oxycodone, oxymorphone, and 6-monoacetylmorphine (6-MAM) in urine, blood, serum, or plasma using liquid chromatography with tandem mass spectrometry detection[J]. Methods Mol Biol, 2010, 603: 411-422 .
[3] Tiscione NB, Shan X, Alford I, et al. Quantitation of opioids in whole blood by electron impact-gas chromatography-mass spectrometry[J]. J Anal Toxicol, 2011, 35(2): 99-107.
[4] 郝光涛,马蒙,曲恒燕,等.国产氨酚氢可酮片人体生物等效性研究[J].中国药物应用与监测,2011,8(5):268-271.
[5] SFDA.药物临床试验质量管理规范[S]. 2003.
[6] SFDA.化学药物临床药代动力学研究技术指导原则[S].2004-03-17.
[7] 本刊译.FDA批准重酒石酸氢可酮单一成分缓释制剂[J].世界临床药物,2013,34(11):39.
[8] Valtier S, Mueck, RL, Bebarta VS. Quantitative method for analysis of hydrocodone, hydromorphone and norhydrocodone in human plasma by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2013, 925: 40-45.
Pharmacokinetics of hydrocodone tartrate tablets in human
HAO Guang-tao1, QU Heng-yan1, ZHANG Li-juan1, LI Yuan-yuan1, GAO Hong-zhi1, DONG Rui-hua1, WANG Xiao-fang1, LIANG Yu-guang1, ZHANG Yuan-yuan2, LIU Ze-yuan1, ZHANG Hong1(1. Department of Clinical Pharmacology, Affiliated Hospital, Academy of Military Medical Sciences, Beijing 100071, China; 2. Anhui Medical University, Hefei 230032, China)
Objective:To study the pharmacokinetics of hydrocodone tartrate tablets in human.Methods:We carried out single dose, parallel design study. Subjects were divided into three groups according to the dose of 5 mg, 10 mg, 15 mg (low, medium, high), and each group contained ten subjects. HPLC-MS/MS method was used for analysis of hydrocodone and its two metabolites (demethylation of hydrocodone and hydromorphone). WinNonlin 6.1 software was used to calculate the pharmacokinetic parameters.Results:Linearity was established in the range of 0.05 – 50.00 μg·L-1for hydrocodone and demethylation of hydrocodone, and 0.01 –10.00 μg·L-1for hydromorphone. After the oral dose of hydrocodone tartrate tablets, Cmax, AUC0-tand AUC0-∞increased with the dose and showed a good linear relationship. There were no serious adverse events during the course of this study.Conclusion:HPLCMS/MS is a sensitive and accurate method, which is suitable for the analysis of hydrocodone and its two metabolites (demethylation of hydrocodone and hydromorphone) in plasma and the pharmacokinetics study of hydrocodone tartrate tablets in human.
Hydrocodone tartrate; Pharmacokinetics; HPLC-MS/MS; Blood drug concentration
R969.1
A
1672 – 8157(2015)02 – 0076 – 06
张宏,男,副研究员,研究方向:生物医药工程。E-mail:13601192278@126.com
郝光涛,男,主管药师,主要从事人体药代动力学研究。E-mail:power822@126.com
(2014-05-16
2014-12-21)

