酵母多糖对免疫抑制小鼠的免疫调节作用
王书全
(辽宁医学院畜牧兽医学院,辽宁 锦州 121001)
酵母多糖对免疫抑制小鼠的免疫调节作用
王书全
(辽宁医学院畜牧兽医学院,辽宁 锦州 121001)
为研究酵母多糖(YPS)对免疫抑制小鼠的免疫调节作用,将180只小鼠随机分成5组,分别为空白对照组、CY模型组、试验Ⅰ组(低剂量组)、试验Ⅱ组(中剂量组)、试验Ⅲ组(高剂量组),每组3个重复,每个重复12只。除空白对照组外,其余各组小鼠均按40 mg/(kg·w)连续3 d腹腔注射环磷酰胺制备免疫力低下小鼠模型,造模后,试验Ⅰ、Ⅱ、Ⅲ组给小鼠分别每天灌服0.2、0.5、1 mg/m L的YPS 0.1 m L/10g体重,空白对照组和CY模型组灌服等量生理盐水。30 d后,检测各组小鼠免疫学指标。结果表明,试验Ⅰ组可显著提高免疫抑制小鼠的脾淋巴细胞增殖能力、迟发型变态反应、巨噬细胞吞噬率、巨噬细胞吞噬指数、NK细胞活性、血清中IL-4和IFN-γ的水平。试验Ⅱ、Ⅲ组显著提高免疫器官指数、抗体生成细胞溶血空斑数和血清溶血素抗体积数,极显著地提高免疫抑制小鼠的脾淋巴细胞增殖能力、迟发性变态反应、巨噬细胞吞噬率、巨噬细胞吞噬指数、NK细胞活性、血清中IL-4和IFN-γ的水平。说明YPS能不同程度的提高免疫抑制小鼠的免特异性和非特异性免疫功能。
酵母多糖;小鼠;免疫抑制;免疫调节
酵母多糖(Yeast polysaccharide,YPS)是从酵母细胞壁提取的大分子多糖复合物,主要为葡聚糖和甘露聚糖。作为一种全新的天然绿色添加剂,其不仅具有一定的营养价值,还具有促进生长、抗病毒、增强免疫功能、促进免疫器官发育等多种生物学功能。已有研究表明酵母多糖能促进正常动物免疫器官发育、提高机体的特异性及非特异性免疫功能[1-3]。但对免疫抑制动物免疫的影响研究鲜有详尽报道,本研究通过小鼠免疫抑制模型探讨酵母多糖对免疫功能低下小鼠的免疫调节作用,为酵母多糖在生产中的应用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 酵母多糖,购于浙江某生物技术公司,有效物质含量94%,为淡黄色至黄棕色粉末,β-葡聚糖≥20.0%,甘露聚糖≥20.0%,粗蛋白≤35.0%。
1.1.2 试验动物 BALB/C纯系清洁级10~12周龄雄性小鼠,体重为20±2 g,购于辽宁医学院实验动物中心。
1.1.3 主要试剂 四甲基偶氮唑(MTT)、刀豆蛋白A(ConA)(美国Sigma公司)、RPMI 1640培养基(日本Nissui公司)、环磷酰胺(CY)(江苏恒瑞医药股份有限公司)、YAC-1细胞(上海研生生化试剂有限公司)、EZ-SePTMMOUSE IX淋巴细胞分离液、小鼠IL-4和IFN-γ ELISA试剂盒(深圳达科为生物技术有限公司)。
1.2 方法
1.2.1 试验分组 将180只雄性小鼠随机分成5组,每组3个重复,每个重复12只。分别为免疫抑制模型组、空白对照组、试验Ⅰ组(0.2 mg/ mL)、试验Ⅱ组(0.5 mg/mL)、试验Ⅲ组(1 mg/mL)剂量组。免疫抑制模型组、试验Ⅰ组、试验Ⅱ组、试验Ⅲ组,分别腹腔注射环磷酰胺(CY)40 mg/kg,1次/d,连续3 d。第4天起试验Ⅰ、Ⅱ、Ⅲ组给予YPS,空白对照组和CY模型组给予生理盐水,每只小鼠灌服均为0.1 mL/10 g体重,小鼠隔日称重,以调整灌胃量,1次/d,连续给药30 d。
1.2.2 免疫指标测定
1.2.2.1 免疫器官指数的测定 给药30 d后,每组每个重复取2只小鼠称重,解剖摘取免疫器官脾脏和胸腺,去除筋膜和脂肪组织后称重,根据公式计算脾指数和胸腺指数。
免疫器官指数=免疫器官重(mg)/体重(g)
1.2.2.2 IL-4、IFN-γ含量 按照ELISA试剂盒说明书方法检测血清中IL-4和IFN-γ的浓度。
1.2.2.3 细胞免疫指标的测定
1.2.2.3.1 T淋巴细胞转化试验 给药30 d后每组每个重复取2只小鼠,颈椎脱臼处死。无菌取脾,制备脾细胞悬液。应用ConA刺激脾淋巴细胞分化增殖,采用MTT比色法[4]测定脾淋巴细胞增殖能力。
1.2.2.3.2 迟发型变态反应 试验结束前4 d每组每个重复取2只小鼠,用2%(v/v)SRBC(约1× 108个SRBC)腹腔注射0.2 mL进行致敏。4 d后测量左后足跖厚度,然后在测量部位皮下注射20 μL 20%(v/v)SRBC,注射后24 h测量左后足跖厚度,同一部位测量3次,取平均值。计算注射前后厚度的差值[5]。
1.2.2.4 体液免疫指标的测定
1.2.2.4.1 血清溶血素检测 小鼠灌服26 d后每组每个重复取2只小鼠,每鼠腹腔注射0.5%绵羊红细胞悬液0.2 mL进行免疫。免疫4 d后摘除眼球取血制备血清。采用文献[6]方法测定小鼠血清溶血素抗体含量,以样本半数溶血值(HC50)表示,按照以下计算公式计算:
HC50=(样品管OD值/CRBC半数溶血OD值)×稀释倍数
1.2.2.4.2 抗体生成细胞检测 依文献[7]方法(Jeme改良玻片法)测定全脾细胞溶血空斑数。用空斑数/108脾细胞来表示。
1.2.2.5 非特异性免疫指标的测定
1.2.2.5.1 小鼠腹腔巨噬细胞吞噬鸡红细胞试验 给药30 d后,每组每个重复取2只小鼠,每鼠腹腔注射20%鸡红细胞悬液1 mL,30 min后脱颈处死。计数100个巨噬细胞中吞噬有鸡红细胞的巨噬细胞数及所吞噬的鸡红细胞数,按下式计算吞噬百分率和吞噬指数[8]。
吞噬百分率(%)=吞噬鸡红细胞的巨噬细胞数/ 100×100%
吞噬指数=被吞噬的鸡红细胞数/100
1.2.2.5.2 NK细胞活性测定 取1.2.2.1脾细胞悬液,采用乳酸脱氢酶法[9]测定NK细胞活性。
NK细胞活性=试验组OD值-自然释放组OD值/最大释放组OD值-自然释放组OD值×100%
1.3 统计学方法 用SPASS 18.0软件单因素方差分析(one way ANOVA)进行组间差异的比较。数据用(X±S)表示。
2 结果与分析
2.1 YPS对小鼠免疫器官指数的影响 与对照组比较,免疫抑制模型组小鼠脾脏及胸腺指数显著低于正常对照组(P<0.05),表明造模成功。与CY模型组相比,空白对照组、试验试验Ⅱ组和试验Ⅲ组的脾、胸腺指数明显提高,差异显著(P<0.05),空白对照组、试验Ⅰ、Ⅱ、Ⅲ组间差异不显著,试验Ⅰ组与CY模型组间差异亦不显著(P>0.05),说明YPS能促进免疫抑制小鼠免疫器官的生长发育,提高免疫抑制小鼠的免疫功能。详见表1。

表1 YPS对小鼠免疫器官指数的影响(n=6,X±S)Table1 The effect o f YPS on imm une organs index in m ice
2.2 YPS对小鼠血清IL-4和IFN-γ的影响 与CY模型组相比,空白组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠血清中IL-4和IFN-γ的含量均有显著增高,其中试验Ⅰ组和试验Ⅱ组差异显著(P<0.05),空白组和试验Ⅲ组差异极显著(P<0.01),试验Ⅰ组和试验Ⅲ组间差异显著(P<0.05),与试验Ⅱ组间差异不显著(P>0.05)。详见表2。
2.3 YPS对小鼠T细胞的增殖能力和迟发型变态反应的影响 与CY模型组相比,试验Ⅰ组、试验Ⅱ组和试验Ⅲ组均明显提高,试验Ⅰ组差异显著(P<0.05),试验Ⅱ组和试验Ⅲ组差异极显著(P<0.01),试验Ⅰ、Ⅱ、Ⅲ组间差异均显著(P< 0.05),试验Ⅲ组与空白对照组组间差异不显著(P>0.05)。详见表3。
2.4 YPS对小鼠血清溶血素抗体积数和溶血空斑数的影响 与CY模型组相比,空白对照组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠血清溶血素抗体积数和溶血空斑数明显提高,差异显著(P<0.05),且空白对照组、试验Ⅱ组和试验Ⅲ组组间差异不显著(P>0.05);与试验Ⅰ组相比,试验Ⅱ组和试验Ⅲ组差异均显著(P<0.05)。详见表4。2.5 YPS对小鼠腹腔巨噬细胞吞噬鸡红细胞能力和NK细胞活性的影响 与CY模型组相比,空白对照组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠吞噬细胞百分率、吞噬指数、NK细胞活性均有明显提
高,其中试验Ⅰ组各检测指标差异显著(P<0.05);空白对照组、试验Ⅱ组和试验Ⅲ组各检测指标差异极显著(P<0.01),空白对照组、试验Ⅱ组和试验Ⅲ组组间差异不显著(P>0.05);与试验Ⅰ组相比,空白对照组、试验Ⅱ组和试验Ⅲ组的各项检测指标差异均显著(P<0.05)。详见表5。
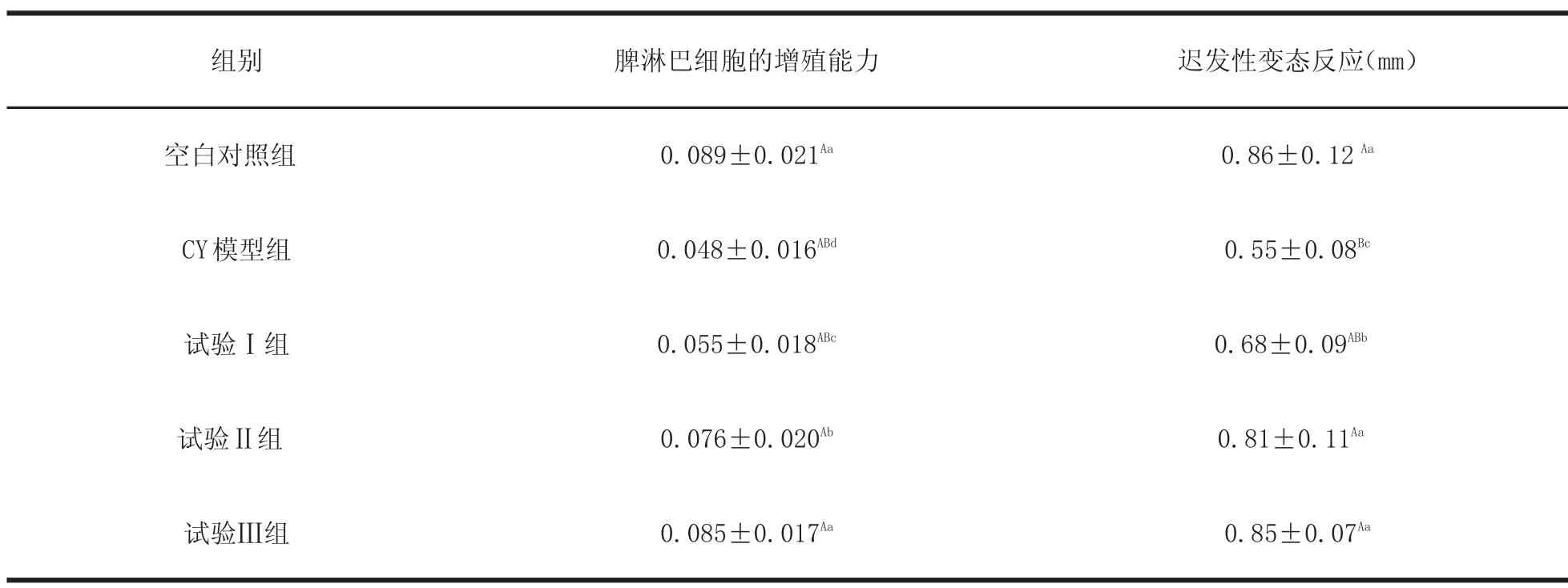
表2 YPS对小鼠血清中IL-4和IFN-γ含量的影响(n=6,X±s)Table2 The effect of YPS on IL-4 and IFN-γcontent in m ice serum(n=6,X±s)
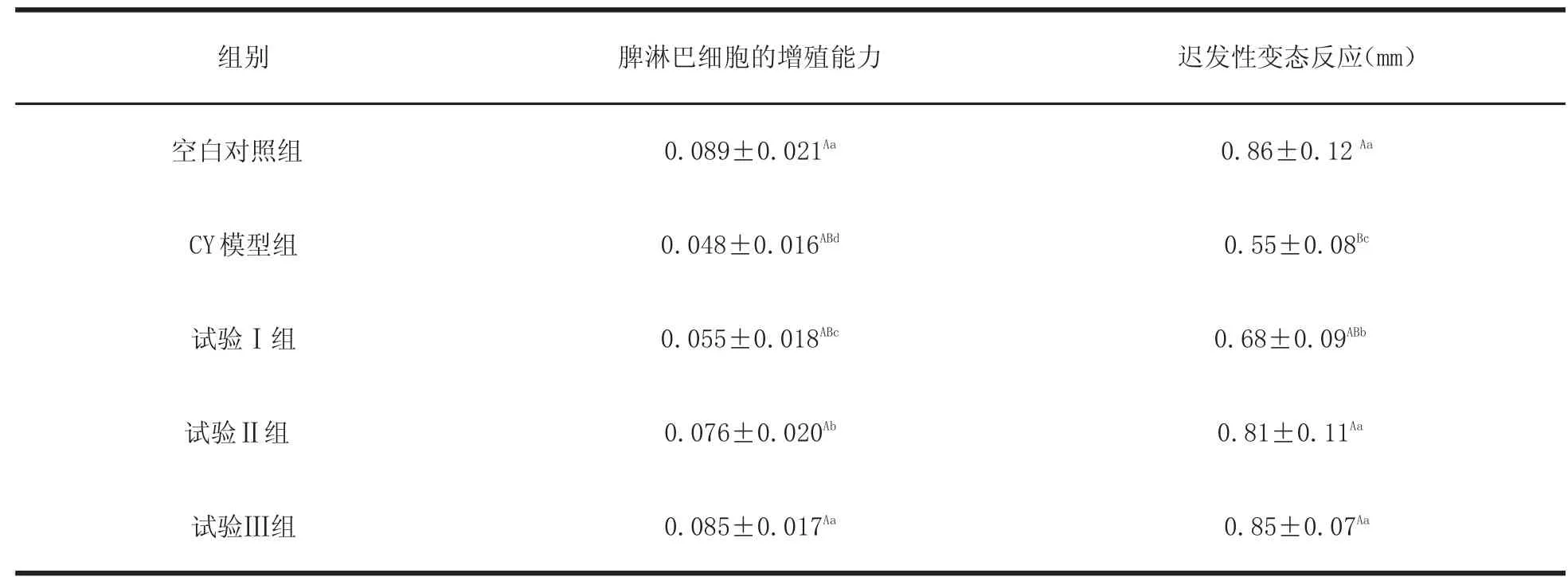
表3 YPS对小鼠淋巴细胞的增殖能力和迟发型变态反应的影响(n=6,X±s)Tab le3 The e ffect of YPS on pro liferation ability o f lym phocytes and de lyed hypersensitivity in m ice(n=6,X±s)

表4 YPS对小鼠血清溶血素抗体积数和溶血空斑数的影响(n=6,X±s)Table4 The effect of YPS on level o f hemo lysin antibody in b lood serum and Hem o lytic plaque number in m ice(n=10,X±s)
3 讨论
3.1 YPS对小鼠免疫器官指数的影响 胸腺和脾脏分别属于中枢和外周免疫器官,其增重往往意味着机体淋巴细胞的增殖,直接体现了免疫应答的强弱[10]。当机体的整体免疫功能增强时,其重量有所增加,机体免疫功能低下时,常表现出脏器萎缩,体积变小等现象。本研究表明,与空白对照组比较,免疫抑制模型组小鼠脾脏及胸腺指数显著低于正常对照组(P<0.05),说明腹腔注射环磷酰胺可致小鼠免疫抑制,造模成功。与模型组相比,试验Ⅱ组和试验Ⅲ组脾指数和胸腺指数有显著提高,而与空白对照组相比,试验Ⅱ组和试验Ⅲ组脾指数和胸腺指数差异不显著(P>0.05),说明酵母多糖能对抗由环磷酰胺所致小鼠胸腺、脾脏的萎缩,使其脏器指数明显增加,并且接近正常值。主要原因可能是酵母多糖中含有β-葡聚糖和甘露聚糖均促使有益菌群在肠道内大量繁殖,不断合成维生素、氨基酸等,可为免疫器官生长提高营养物,促进免疫器官的增长,同时也可促进免疫器官中免疫细胞的分化、增殖。
3.2 YPS对特异性免疫的影响 酵母多糖的主要成分为β-葡聚糖和甘露聚糖,许多研究表明这两种物质均能提高动物机体的特异性免疫功能。郭波等[11]报道,β-葡聚糖免疫组IgG1(P<0.01)、IgG2a(P<0.05)抗体的产生显著高于单纯卵清蛋白(OVA)对照组。王忠等[12]报道在断奶仔猪日粮中添加β-1,3/1,6-葡聚糖14 d后,试验组外周血T、B淋巴细胞转化率极显著高于对照组(P<0.01)。马志红等[13]报道,甘露聚糖能极显著提高免疫抑制小鼠抗体积数和迟发型变态反应(P<0.01)。朱延军等[14]报道酵母多糖能显著提高细胞亚群中T、B细胞数量。T、B淋巴细胞是参与机体特异性免疫应答的主要细胞,也是反映机体特异性免疫的重要标志[15]。本研究表明,与CY模型组相比,试验Ⅰ组小鼠淋巴细胞的增殖能力、迟发型变态反应和IFN-γ水平均显著提高(P<0.05),试验Ⅱ组和试验Ⅲ组差异极显著(P<0.01)。IFN-γ主要通过参与诱导Th细胞向Thl细胞分化,诱导参与和增强机体的细胞免疫,具有重要的免疫调节作用。说明YPS可以逆转免疫抑制小鼠的细胞免疫功能,重建免疫功能低下机体正常的细胞免疫功能。与CY模型组相比,试验Ⅱ组和试验Ⅲ组小鼠的能血清溶血素抗体积数和溶血空斑数明显提高(P<0.05),血清中IL-4水平试验Ⅰ、Ⅱ、Ⅲ组均显著提高,其中试验Ⅰ、Ⅱ组差异显著,试验Ⅲ组差异极显著。IL-4可促进Th2型细胞发育,促进B细胞增殖与活化,参与特异性IgG和IgE的分泌与Ig类别转换,调节Thl和Th2细胞平衡,保持机体的免疫平衡。说明YPS促进B淋巴细胞增殖和抗体合成,能提高免疫抑制小鼠的体液免疫功能。
3.3 YPS对非特异性免疫的影响 非特异性免疫是机体免疫系统的重要组成部分,与特异性免疫间有着极为密切的联系。单核-巨噬细胞系统对保持机体内环境稳定具有重要作用。NK细胞是机体重要的免疫细胞,与抗肿瘤、抗病毒感染和免疫调节有关。单核-巨噬细胞系统对保持机体内环境稳定具有重要作用。NK细胞活力和单核细胞的吞噬能力是衡量机体非特异性免疫功能的重要标准。研究表面β-葡聚糖和甘露寡糖均能提高动物机体的非特异性免疫功能,安尚泽[16]报道给小鼠灌服β-葡聚糖,能显著提高小鼠血清中溶菌酶的活性、碳粒廓清指数和吞噬指数。马志红等[13]报道甘露寡糖能极显著提高免疫抑制小鼠的巨噬细胞的吞噬率和吞噬指数。本研究表明,与CY模型组相比,试验Ⅰ组小鼠的吞噬细胞百分率、吞噬指数、NK细胞活性显著提高,试验Ⅱ组和试验Ⅲ组以上各检测指标差异极显著(P<0.01);试验Ⅰ组与空白对照组、试验Ⅱ组和试验Ⅲ组相比,各项检测指标差异均显著(P<0.05),空白对照组试验Ⅱ组和试验Ⅲ组组间差异不显著(P>0.05)表明YPS能明显提高免疫抑制小鼠的非特异性免疫免疫功能。这与文献[14-16]的报道基本一致。
4 结论
4.1 YPS能提高免疫抑制小鼠的免疫器官指数、血清中IL-4及IFN-γ含量、淋巴细胞的增殖能力、迟发型变态、血清溶血素抗体体积和溶血空斑数,促进淋巴细胞的转化和抗体的生产,进而提高小鼠的特异性免疫功能。
4.2 YPS能增强免疫抑制小鼠腹腔巨噬细胞吞噬鸡红细胞能力,提高NK细胞活性,提高免疫抑制小鼠非特异性免疫功能。
[1]刘丽,郑全辉,张庆波,等.酵母多糖对机体免疫功能的影响[J].河北医药,2013(15):2257-2259.
[2]王元秀,张桂香,李峰,等.酵母多糖的提取及其对雏鸡免疫器官发育的影响[J].食品科学,2011,32(2):256-259.
[3]李桂峰,康裕财,孙际佳,等.母多糖对赤眼鳟非特异性免疫机能的影响[J].中山大学学报(自然科学版),2003,42(4):55-58.
[4]中华人民共和国卫生部.保健食品检验与评价技术规范(2003版)[S].2003.
[5]黄明亮.南瓜叶乙醇提取物对小鼠免疫功能的影响[D].重庆:西南大学硕士毕业论文,2013.
[6]张志广.中药复方多糖的优化提取及其对小鼠免疫功能的影响[D].合肥:安徽农业大学硕士毕业论文,2011.
[7]费建明,赵丽华,占鹏飞,等.桑枝皮多糖对小鼠的免疫调节试验[J].蚕业科学,2009,35(4):907-912.
[8]安利国,邢维贤.细胞生物学实验教程[M].北京:科学出版社,2010:51-53.
[9]颜爱,李波,李润成,等.香菇多糖和黄芪多糖对免疫抑制小鼠免疫功能调节的研究[J].中国免疫性杂志,2012,28(11):999-1001,1005.
[10]傅圣斌,钱建鸿,陈乐意,等.黄精多糖的提取及其对小鼠免疫活性的影响[J].中国食品学报,2013 13(1):68-72.
[11]郭波,李华,郑萍,等.β葡聚糖对小鼠抗体产生的影响[J].第三军医大学学报,2004,26(11):946-948.
[12]王忠,呙于明,袁建敏,等.酵母β-1,3/1,6-葡聚糖对断奶仔猪细胞免疫和体液免疫机能的影响[J].畜牧兽医学报,2007(12):1316-1322.
[13]马志红,张庆波,史相国,等.甘露寡糖对免疫低下小鼠免疫功能的影响[J].安徽农业科学,2009 3716:7462-7463.
[14]朱延军,刘洪荣,边洪荣,等.酵母多糖对小鼠免疫功能影响的体外实验研究[J].安徽农业科学2009,37(28):13636-13637.
[15]李丽,王金莉,董子诚,等.杨树花提取物对免疫抑制小鼠免疫功能影响[J].动物医学进展,2013(6):54-57.
[16]安尚泽.β-葡聚糖对小鼠抗氧化能力及非特异性免疫的影响[D].延吉:延边大学硕士论文,2012.
Effects of Yeast Polysaccharide on Modulating Immune Function in Immunosuppressed Mice
Wang Shuquan
(Liaoning Medical University,Col lege of Animal Husbandry and Veterinary,Liaoning Jinzhou 121001)
To study the ef fects of Yeast Polysaccharide(YPS)on immune modulation in immunosuppressed mice,one hundred and eighty mice were al located to cont rol group,cyclophosphamide(CY) model group,test groupⅠ(low-dose),test groupⅡ(mid-dose)and test groupⅢ(high-dose),3 repl icates in each group and 12 mice in each replicate.the mice in other groups were manufactured immunosuppressed mice model by a three-day 40 mg/kg·w intraperitoneal injection of cyclophosphamide, except for the blank cont rol group.Mice in testⅠ,Ⅱ,Ⅲ oral ly administered by 0.1 ml YPS/10 g body weighty with 0.2、0.5、1 mg/mL respectively,mice in cont rol group and CY model group were orally administered normal sal ine.Af ter 30 days,the indexes of immunity function in immunosuppressed mice were detected.The resul ts show that test groupⅠcan improve distinct ly prol i feration abi l ity,delayed type hypersensitivity reaction,phagocytose percentage,phagocytose index,NK cel l activity,levels of IL-4 and INF-γ in blood serum.Test groupsⅡ,Ⅲ can enhance remarkably index of immune organs,the number of hemolytic plaque and the level of serum hemolysin,very signi f icant ly increase prol i feration abi l ity,delayed type hypersensitivity reaction,phagocytose percentage,phagocytose index,NK cel l activity,levels of IL-4 and INF-γ in blood serum.These resul ts explained that YPS can improve with di f ferent degrees speci f ic and nonspeci f ic immune function in mice.
Yeast Polysaccharide;Mice;Immunosuppression;Immune Modulation
S285.5
1672-9692(2015)05-0001-06
2015-04-03
王书全(1968-),男,硕士,教授,主要从事动物源性病原体分子生化学特性与免疫特性研究。

