米根霉发酵产L-苹果酸的工艺优化
刘 亚,杨 英,孙 婷,汪海涛,张 旻,潘 丽军,姜绍通,李兴江*
米根霉发酵产L-苹果酸的工艺优化
刘 亚,杨 英,孙 婷,汪海涛,张 旻,潘 丽军,姜绍通,李兴江*
(合肥工业大学生物与食品工程学院,安徽 合肥 230009)
以米根霉(Rhizopus oryzae)突变株CICC40503-JST为菌种,葡萄糖为碳源,对其发酵工艺及葡萄糖代谢途径进行初步研究,从而提高L-苹果酸的产量。采用单因素试验和响应曲面法(Box-Behnken设计)对培养基和发酵条件进行优化,研究发酵罐实验对产酸的影响。结果获得最佳培养基配方为:葡萄糖100 g/L、(NH4)2SO44.0 g/L、MgSO40.3 g/L、FeSO4·7H2O 0.025 g/L、KH2PO40.5 g/L、ZnSO40.1 g/L、CaCO380 g/L。发酵条件较好组合为:发酵设备为Sartorius发酵罐、发酵温度32℃、通气量0.20 L/(min·L)、转速500 r/min、孢子悬浮液单独培养48 h、发酵进行48 h后添加培养基进行补料发酵,发酵周期为72 h、L-苹果酸的产量为57.71 g/L。结论:米根霉能够较好地利用葡萄糖发酵产L-苹果酸,其产量得到明显提高。
米根霉;葡萄糖;L-苹果酸;响应曲面法;酶活力
L-苹果酸(L-malic acid,LMA)是细胞三羧酸循环(tricarboxylic acid cycle,TCA)的中间代谢产物[1],主要用作食品添加剂,与其他食用酸相比,具有较强的酸性和口感保持性,是世界第三大通用食用酸,仅次于柠檬酸和乳酸,占有10%的市场份额[2-3]。1967年,美国食品和药品管理局登记确认L-苹果酸为安全、无毒、无害、可食用的有机酸[4-5],目前它也广泛应用在药品,化妆品和治疗肝功能障碍等药物中。
L-苹果酸的生产方法主要有化学合成法、转化法、发酵法[6-7]。化学合成法生产的苹果酸是在催化剂存在下将苯氧化成富马酸,然后加压与水蒸气共热形成DL-苹果酸,再将DL-苹果酸拆分得到L-苹果酸,对于工艺要求高,分离精度难度大,故在应用上受到限制[8]。转化法主要是通过固定化酶和固定化细胞转化[9]。酶与细胞的固定化是将具有化学催化活性的蛋白质固定于一定的空间载体上,从而实现催化的反应,国内外普遍采用的方法是固定延胡索酸酶生产工艺,将底物富马酸配成富马酸钠或者富马酸铵,在延胡索酸酶作用下进行水合生成相应的苹果酸盐,但富马酸盐平均转化率低,产物浓度低,分离成本高[10-12]。在微生物发酵法方面,利用淀粉质原料生产L-苹果酸的微生物目前主要有:黄曲霉(Aspergillus fl avus)、米曲霉(Aspergillus oryzae)、寄生曲霉(Aspergillu parasiticus)等,Battat等[13]以16 L搅拌罐发酵,黄曲霉在搅拌速率350 r/min、Fe2+12 mg/L、氮271 mg/L等条件下从120 g/L葡萄糖中获得113 g/LL-苹果酸,总转化率0.59 g/(L/h)。Takao等[14]报道了先用少根根霉(Rhizopus ahirrizus)或华根霉(Rhizopus chinensis)把糖质原料转化成富马酸,再利用膜醭毕赤酵母(Pichia membranaefaciens)、普通变形杆菌(Proteusbacillus vulgaris)及宛氏拟青霉(Paeciomyces vatioti)之一,把富马酸转化成LMA。Taing等[15]优化耐糖鲁氏酵母(Zygosaccharomyces rouxii)的发酵条件,控制初始糖质量浓度300 g/L、pH 5.0、发酵温度25℃,在培养基中添加谷氨酸、苹果酸和琥珀酸可提高L-苹果酸产量,谷氨酸添加量为0.5%时,L-苹果酸产量最高,达到74.9 g/L,糖酸转化率为32.8%。
本实验以米根霉(Rhizopus oryzae)突变株CICC40503-JST为菌种,葡萄糖为碳源,采用单因素和响应曲面法对发酵培养基和发酵条件进行优化,获得最适发酵培养基和最适发酵培养条件,以期为葡萄糖的生物转化提供参考。
1 材料与方法
1.1菌种、培养基与试剂
米根霉突变株CICC40503-JST,合肥工业大学农产品加工研究院前期选育及保藏菌株。
斜面及平板培养基采用PDA培养基;基础发酵培养基:葡萄糖100 g/L、酵母浸粉1 g/L、(NH4)2SO42 g/L、KH2PO40.2 g/L、MgSO40.1 g/L、ZnSO40.1 g/L、FeSO4·7H2O 0.02 g/L,CaCO380 g/L,自然pH值,121℃条件下灭菌20 min;孢子悬浮液培养基:葡萄糖100 g/L、(NH4)2SO45 g/L、KH2PO40.5 g/L、MgSO40.3 g/L、FeSO4·7H2O 0.025 g/L、ZnSO40.1 g/L,自然pH值,121℃条件下灭菌20 min。
葡萄糖、(NH4)2SO4、KH2PO4、MgSO4、ZnSO4、FeSO4·7H2O、氨水、CaCO3、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、草酰乙酸国药集团化学试剂有限公司;酵母浸粉 北京奥博星生物技术有限公司;乙二胺四乙酸二钠(ethylenediamine tetraacetic acid disodium salt dihydrate,EDTA-Na2)北京索莱宝科技有限公司;氢氧化钠 无锡市展望化工试剂有限公司。
1.2 仪器与设备
全自动高压灭菌锅 日本Tege SANYO公司;恒温气浴摇床 上海申胜生物技术有限公司;恒温培养箱上海一恒科技有限公司;发酵罐 德国Sartorius公司;721型可见分光光度计 上海元析仪器有限公司。
1.3 方法
1.3.1菌株活化与培养
1.3.1.1菌种活化
将斜面保存的菌种转接至PDA培养基上,置于32℃恒温培养箱内培养3~5 d,4℃冰箱保存备用。
1.3.1.2摇瓶发酵培养
以洗孢子的形式将平板培养基上的菌种接入250 mL摇瓶中,装液量20%,接种量10%(孢子悬液浓度为1×107个/mL),32℃、200 r/min的条件下振荡培养3 d。每组实验做4个平行,发酵液用于测定L-苹果酸产量,结果取平均值。
1.3.1.3孢子悬浮液培养
以洗孢子的形式将平板培养基上的菌种接入3 L摇瓶中,装液量30%,接种量3%(孢子悬液浓度为1×107个/mL),32℃、150 r/min条件下振荡培养。
1.3.1.4发酵罐发酵培养
将孢子悬浮液接入发酵罐中,装液量6 L,接种量1 L(孢子悬浮液占10%),发酵罐基本发酵条件为30℃、500 r/min、0.13 L/(min·L),每组实验做4个平行,发酵液用于测定L-苹果酸产量,结果取平均值。
1.3.2 产物含量测定
1.3.2.1L-苹果酸含量的测定
采用EDTA定钙法:取过滤后的发酵液1.0 mL,加蒸馏水100 mL,l mol/L NaOH溶液10.0 mL,钙指示剂2 mg,用0.05 mol/L EDTA-Na2溶液滴定至溶液呈现纯蓝色为滴定终点,并记录消耗的EDTA-Na2体积,按下式计算L-苹果酸产量。
L-苹果酸产量/(g/L)= 134.087 4×c×V
式中:V为滴定所消耗EDTA溶液体积/mL;c为EDTA浓度/(mol/L);134.087 4为苹果酸摩尔质量/(g/mol)。
1.3.2.2生物量测定
发酵液过滤得残渣,用0.01 mol/L的HCl溶液充分洗涤,除去过量CaCO3,再用蒸馏水洗涤,得残留菌体,于80℃烘干至恒质量称量。
1.3.2.3柠檬酸合酶酶活力测定
利用柠檬酸合酶测定试剂盒(CAT # CS0720)。
1.3.2.4 苹果酸酶酶活力测定
利用苹果酸酶测定试剂盒(CAT# SPMALI03)。
1.3.2.5 苹果酸脱氢酶酶活力测定
设定分光光度计温度为25℃,波长340 nm。用移液管吸取0.1 mol/L pH 7.4磷酸盐缓冲液2.6 mL,0.003 75 mol/L NADH的0.2 mL,0.006 mol/L草酰乙酸0.1 mL于比色皿中,然后将装有液体的比色皿放置在分光光度计中3~4 min以达到设定温度,测量吸光度,计算酶活力,酶活力单位定义为25 ℃条件下1 min内转化1μmol底物所需要的酶量为1 个酶活力单位(U)。
1.3.2.6丙酮酸羧化酶酶活力测定
[16]方法测定。
1.3.3工艺优化试验
1.3.3.1培养基配方单因素试验
根据1.3.1.2节的发酵培养条件和1.1节中的基础发酵培养基,进行单因素试验,分别考察不同质量浓度的酵母粉(0、0.5、1.0、1.5、2.0 g/ L)、(NH4)2SO4(1.0、2.0、3.0、4.0、5.0 g/L)、MgSO4(0、0.1、0.2、0.3、0.4、0.5 g/L)、FeSO4·7H2O(0.02、0.025、0.03、0.035、0.04 g/L)、KH2PO4(0.4、0.5、0.6、0.7、0.8 g/L)、ZnSO4(0、0.05、0.1、0.15、0.2 g/L)对L-苹果酸产量的影响,以确定主要的影响因素及水平区间。每组试验进行4次重复,结果取其平均值,采用方差法分析处理实验数据。
1.3.3.2响应面试验优化培养基配方
在单因素试验的基础上,以L-苹果酸产量为响应值,选取对L-苹果酸产量影响显著的因素[17-19](包括(NH4)2SO4、ZnSO4、FeSO4·7H2O、MgSO4),根据Box-Behnken中心组合试验设计原理,采用响应面分析法对发酵培养基参数进行优化,获得最优培养基。每组试验重复4次,结果取其平均值。
1.3.3.3发酵工艺单因素试验
根据1.3.3.2节得到的最优配方配制发酵培养基,分别考察发酵设备、通气量、搅拌桨转速、孢子悬浮液培养时间、连续性发酵,中和剂对L-苹果酸产量的影响,试验重复4次,结果取其平均值,采用方差法分析处理实验数据。
2 结果与分析
2.1 单因素试验结果
2.1.1 酵母粉质量浓度对L-苹果酸产量的影响
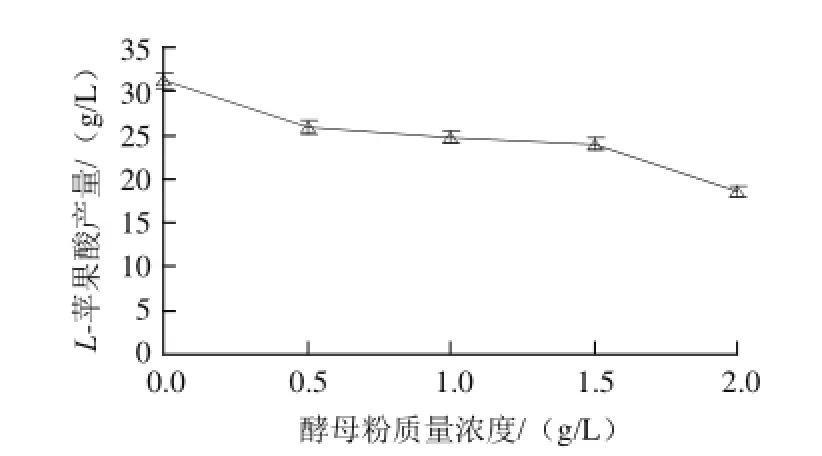
图1 酵母粉质量浓度对L-苹果酸产量的影响Fig.1 Effect of yeast extract powder concentration on the production ofL-malic acid
由图1可知,不添加酵母粉时,L-苹果酸产量最大,为31.16 g/L,添加酵母粉时,L-苹果酸产量逐渐下降。这可能是酵母粉的成分比较复杂,L-苹果酸的产量随着酵母粉质量浓度的增加而减小,当酵母粉质量浓度达到2 g/L时,L-苹果酸产量最小,因为酵母浸粉中除含有丰富的蛋白质、肽类、游离的氨基酸以外,还含有少量的糖类、脂肪和生长因子等,它能有效促进菌体生长,可能会导致菌体过于旺盛,而影响代谢产物的积累[20-21]。方差分析结果表明,酵母粉对L-苹果酸产量影响极显著(P<0.01),因此可以选择不添加酵母浸粉。
2.1.2 (NH4)2SO4质量浓度对L-苹果酸产量的影响
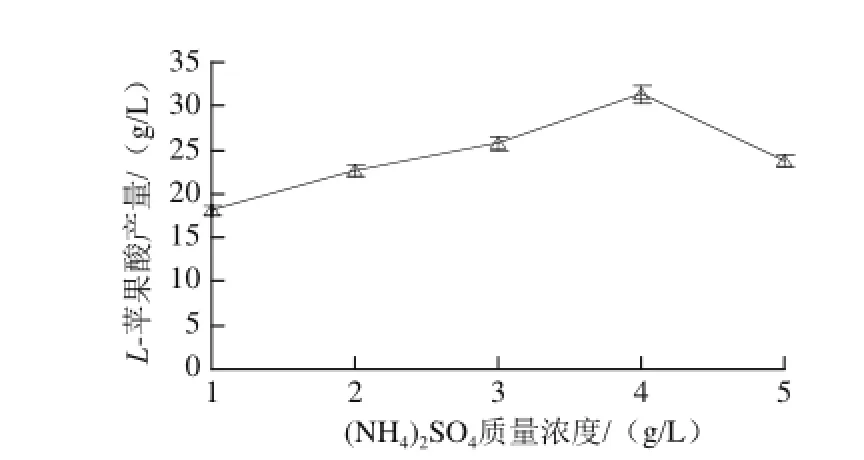
图2 ((NNHH4)2SSOO4质量浓度对L-苹果酸产量的影响Fig.2 Effect of (NH4)2SO4concentration on the production ofL-malic acid
由图2可知,L-苹果酸产量随着(NH4)2SO4质量浓度的增加而增大,当(NH4)2SO4质量浓度达到4 g/L时,L-苹果酸产量最大,为31.34 g/L。当(NH4)2SO4质量浓度高于4 g/L时,L-苹果酸产量呈下降趋势。这是因为发酵液中过高质量浓度的NH4+会抑制菌体的生长,导致产酸水平下降。(NH4)2SO4的初始质量浓度过低时,氮元素和硫元素供应不足,也不利于发酵的正常进行[22-24]。方差分析结果表明,(NH4)2SO4质量浓度对L-苹果酸产量的影响极显著(P<0.01)。(NH4)2SO4的质量浓度为4 g/L左右较为适宜。
2.1.3 MgSO4质量浓度对L-苹果酸产量的影响

图3 MggSSOO4质量浓度对L-苹果酸产量的影响Fig.3 Effect of MgSO4concentration on the production ofL-malic acid
由图3可知,L-苹果酸产量随着MgSO4质量浓度的增加而增大,当MgSO4质量浓度为0.3 g/L时L-苹果酸产量达到最大,为31.84 g/L,当MgSO4质量浓度高于0.3 g/L时,L-苹果酸产量逐渐下降。这是因为镁离子是很多酶的辅酶或激活剂,少量的镁离子可促进微生物生长代谢,而高质量浓度的镁离子会抑制菌种的生长及L-苹果酸的产量[25]。方差分析结果表明,MgSO4对L-苹果酸产量影响极显著(P<0.01)。MgSO4质量浓度为0.3 g/L左右较为适宜。
2.1.4 FeSO4·7H2O质量浓度对L-苹果酸产量的影响
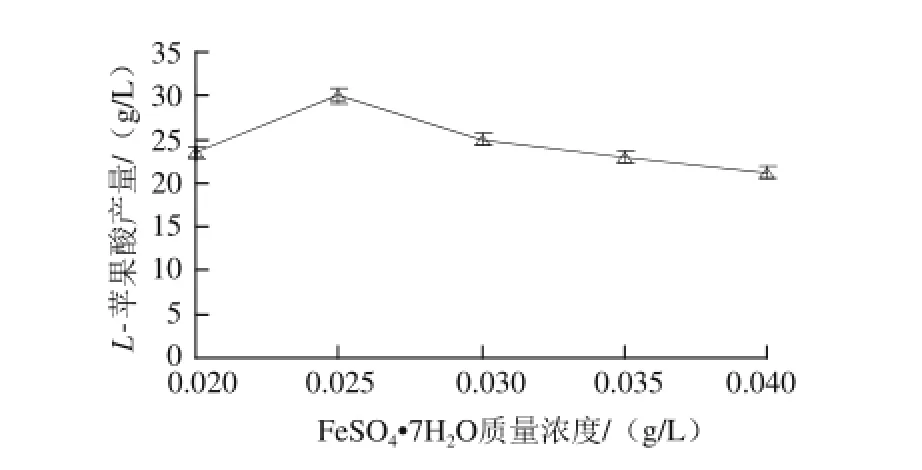
图4 FeeSSOO4·77HH2O质量浓度对L-苹果酸产量的影响Fig.4 Effect of FeSO4·7H2O concentration on the production ofL-malic acid
由图4可知,L-苹果酸的产量随着FeSO4·7H2O质量浓度的增加而逐渐增大,当FeSO4·7H2O质量浓度为0.025 g/L时,L-苹果酸产量达到最大,为29.98 g/L。当FeSO4·7H2O质量浓度高于0.025 g/L时,L-苹果酸产量下降。方差分析结果表明,FeSO4·7H2O对L-苹果酸产量影响极显著(P<0.01)。FeSO4·7H2O质量浓度为0.025 g/L左右较为适宜。
2.1.5 KH2PO4质量浓度对L-苹果酸产量的影响
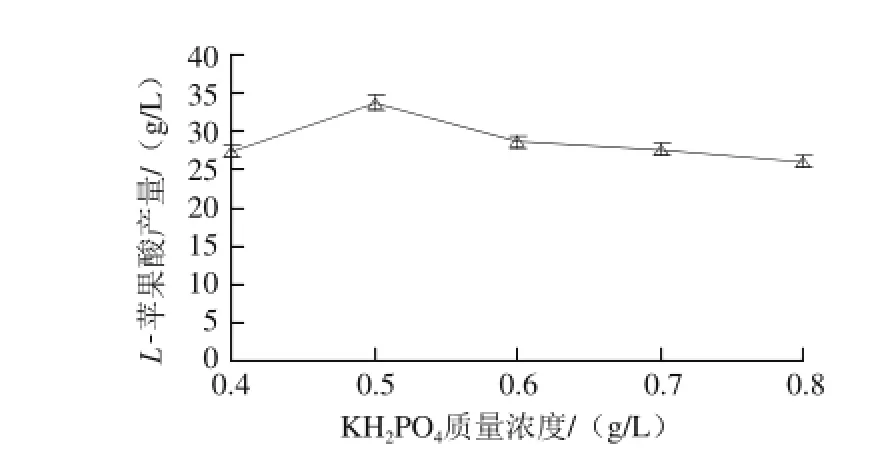
图5 KH 5 KH2POPO4质量浓度对L-苹果酸产量的影响Fig.5 Effect of KH2PO4concentration on the production ofL-malic acid
由图5可知,L-苹果酸产量随着KH2PO4质量浓度的升高而先增大后减小。当其质量浓度为0.5 g/L时,L-苹果酸产量最大,为33.76 g/L。在微生物代谢过程中,磷酸盐的添加可促进菌体生长,影响菌体浓度、合成速率等多个方面,而培养基中添加的复合氮源中也很有可能含有磷元素,添加过量会引起菌体过于旺盛,从而降低了产酸量[26-27]。方差分析结果表明,KH2PO4对L-苹果酸产量影响极显著(P<0.01)。因此,KH2PO4添加的较适质量浓度为0.5 g/L。
2.1.6 ZnSO4质量浓度对L-苹果酸产量的影响
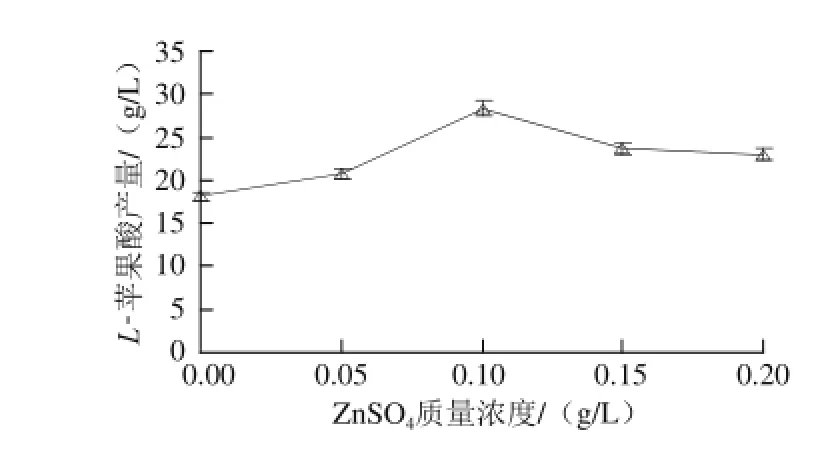
图6 ZnnSSOO4质量浓度对LL--苹果酸产量的影响Fig.6 Effect of ZnSO4concentration on the production ofL-malic acid
由图6可知,L-苹果酸产量随着ZnSO4质量浓度的升高而先增大后减小。当其质量浓度为0.1 g/L时,L-苹果酸产量最大,为28.32 g/L,当ZnSO4质量浓度高于0.1 g/L时,L-苹果酸产量下降。方差分析结果表明,ZnSO4对L-苹果酸产量影响极显著(P<0.01),因此,ZnSO4添加的较适质量浓度为0.1 g/L。
2.2 响应面试验结果
2.2.1 响应面试验结果与分析
中心组合试验设计方案与结果见表1。

表1 中心组合试验设计方案与结果Table 1 Central composite design matrix and corresponding experimental resuullttss
2.2.2 回归模型的建立及其显著性检验
利用Design-Expert软件对试验数据进行多元二次回归拟合,得到的回归方程模型为:
Y=34.64-0.94X1+1.70X2-0.13X3+0.61X4-0.66X1X2+ 1.06X1X3-0.52X1X4+1.45X2X3+0.91X2X4-0.84X3X4-2.95X12-4.52X22-4.72X32-5.58X42。
回归方程及偏回归系数方差分析结果见表2。
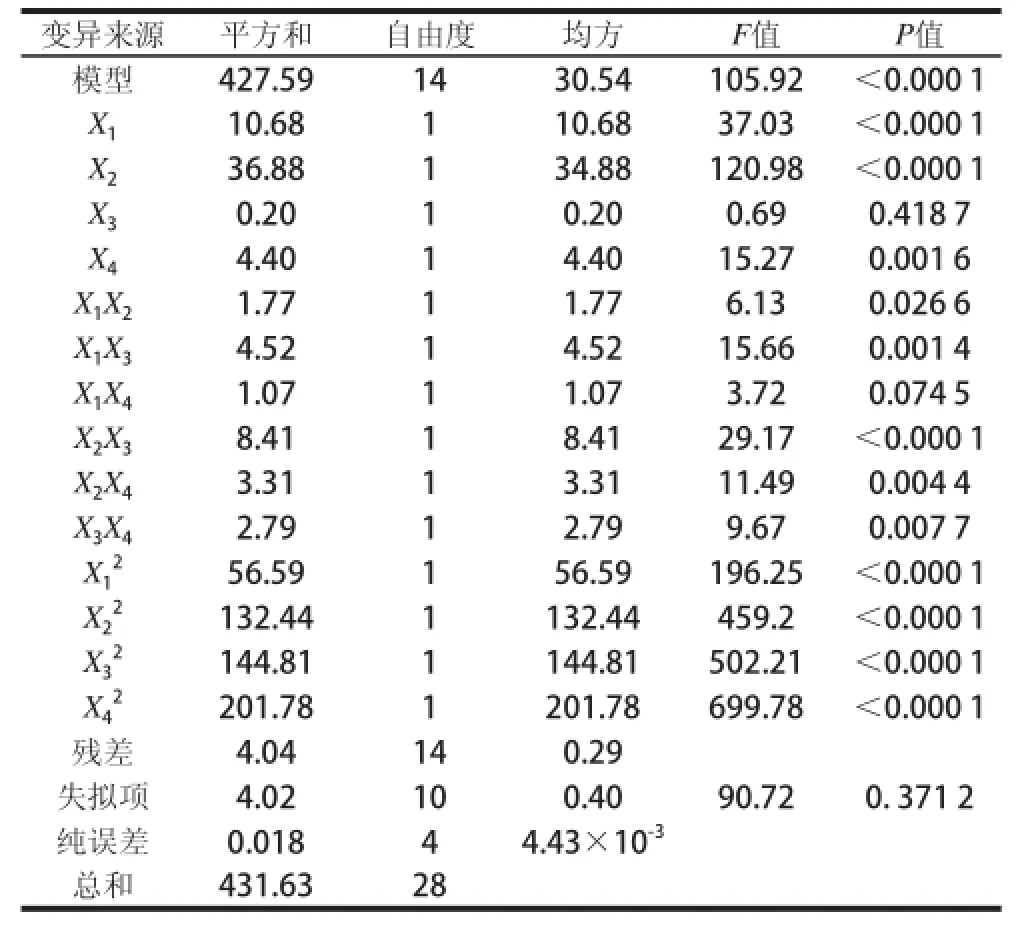
表2 回归方程的方差分析Table 2 Analysis of variance for the fitted quadratic regression equaattiioonn
由表2可知,该回归模型P<0.000 1,失拟项P>0.05,说明该模型回归方程显著,失拟不显著。模型的决定系数R2=0.990 6,说明该模型的拟合程度很好,能较好地反映各因素与响应值变化的关系,可用于葡萄糖发酵产L-苹果酸的理论预测。回归方程中的X1、X2、X4、X1X3、X2X3、X2X4、X3X4、X12、X22、X32、X42对L-苹果酸产量影响高度显著,X1X2对L-苹果酸产量影响显著。
该回归模型的响应面趋势图和等高线图解见图7~11,(NH4)2SO4、ZnSO4、FeSO4·7H2O、MgSO4质量浓度及其交互作用对L-苹果酸产量的影响可以从图中直观地反映出来。


图7 ZnnSSOO4和((NNHH4)2SSOO4的质量浓度对L-苹果酸产量影响的响应面和等高线Fig.7 Response surface and contour plots for the interactive effects ofZnSO4and (NH4)2SO4on the production ofL-malic acid

图8 FeeSSOO4·77HH2OO和((NNHH4)2SSOO4的质量浓度对L-苹果酸产量影响的响应面和等高线Fig.8 Response surface and contour plots for the interactive effects of FeSO4·7H2O and (NH4)2SO4on the production ofL-malic
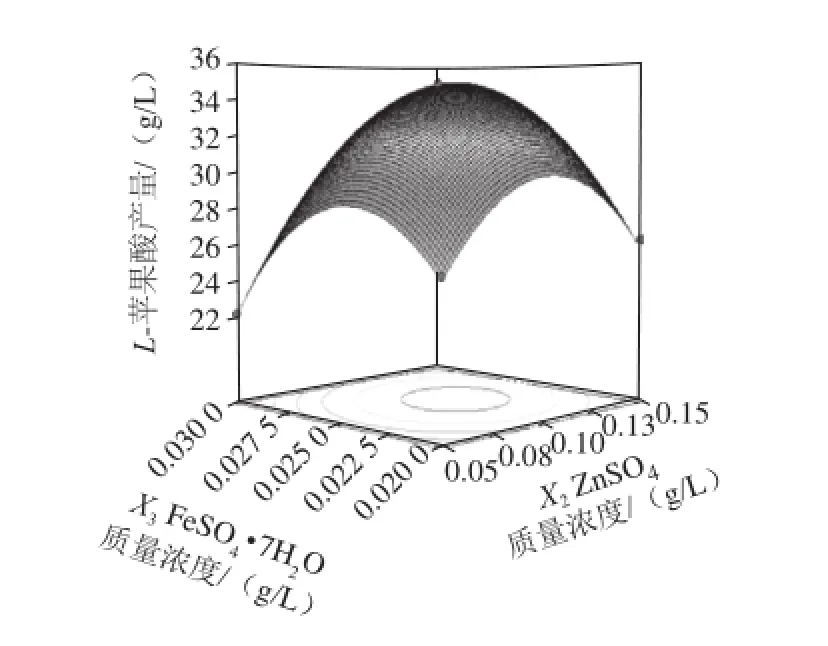
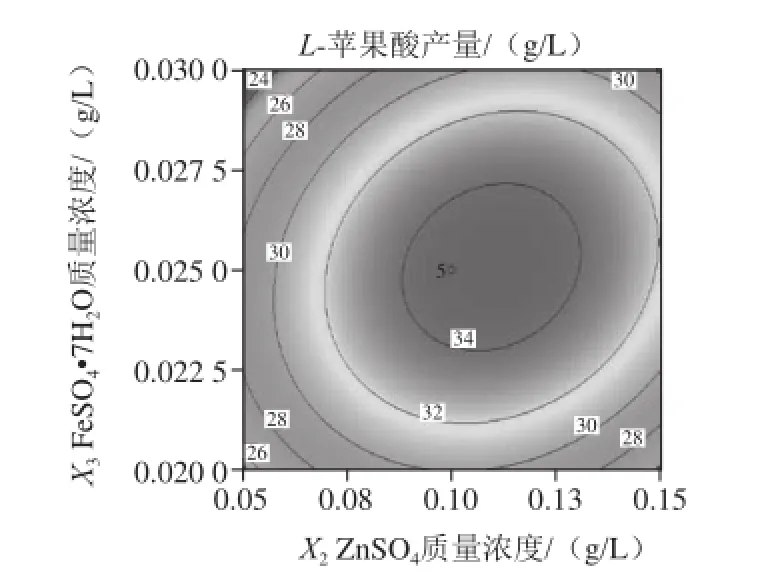
图9 ZnnSSOO4和FFeeSSOO4·77HH2O的质量浓度对L-苹果酸产量影响的响应面和等高线Fig.9 Response surface and contour plots for the interactive effects of ZnSO4 and FeSO4·7H2O on the production ofL-malic acid
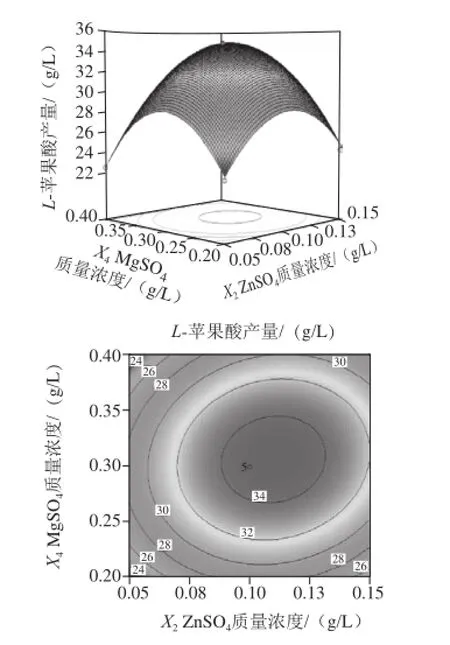
图10 MggSSOO4和ZZnnSSOO4的质量浓度对L-苹果酸产量影响的响应面和等高线Fig.10 Response surface and contour plots for the interactive effects of MgSO4and ZnSO4on the production ofL-malic acid
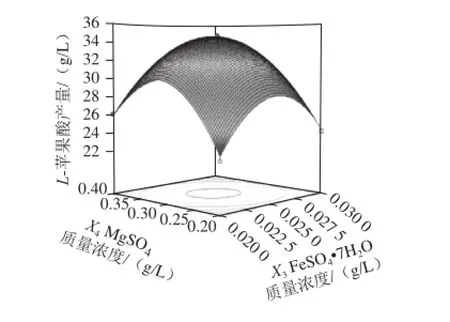
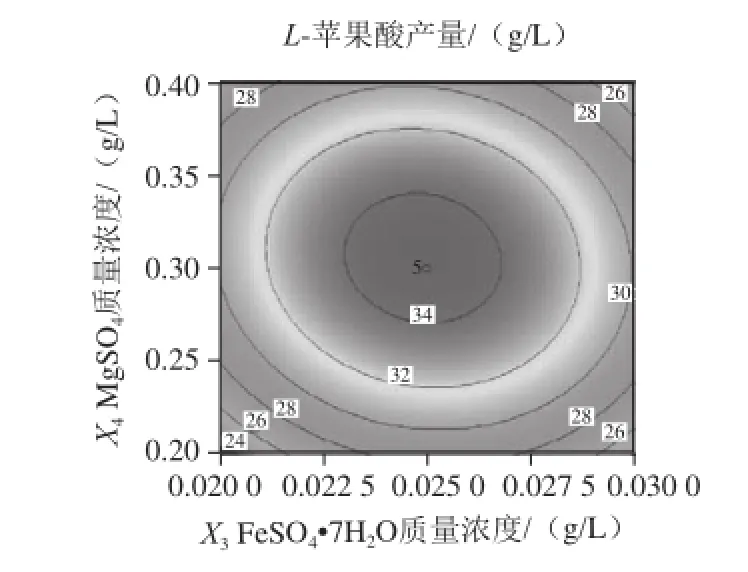
图11 MggSSOO4和FFeeSSOO4·77HH2O的质量浓度对L-苹果酸产量影响的响应面和等高线Fig.11 Response surface and contour plots for the interactive effects of MgSO4 and FeSO4·7H2O on the production ofL-malic acid
由图7可知,当把FeSO4·7H2O、MgSO4固定于零水平时,随着(NH4)2SO4和ZnSO4质量浓度的增加,L-苹果酸产量均呈先增大后减小的趋势,等高线呈椭圆形,说明两因素的交互作用较强。由图8可知,当把ZnSO4和MgSO4固定于零水平时,L-苹果酸产量随着(NH4)2SO4和FeSO4·7H2O质量浓度的增加而先升高后降低,响应曲面的坡度陡峭,表明这两个因素的交互效应显著。同理,由图9~11可知,ZnSO4和FeSO4·7H2O、MgSO4和ZnSO4、MgSO4和FeSO4·7H2O对L-苹果酸产量的交互作用影响类似于图8。
2.2.3 响应面因素水平优化结果及模型验证
对回归模型进行响应面分析,得到L-苹果酸产量预测达到最大值时各因素水平为:(NH4)2SO43.004 g/L,ZnSO40.092 g/L,FeSO4·7H2O 0.025 g/L,MgSO40.343 g/L。预测值为34.644 g/L,当显著性水平α=0.05时,L-苹果酸产量的95%的预测区间为[34.128 9 g/L,35.159 1 g/L]。
为验证回归模型预测值的准确性,将上述最优组合条件圆整为:(NH4)2SO43 g/L,ZnSO40.1 g/L,FeSO4·7H2O 0.025 g/L,MgSO40.3 g/L,进行重复4次验证性实验,得到L-苹果酸产量平均值为(34.87±0.24)g/L,该值落在响应值的95%预测区间[34.128 9 g/L,35.159 1 g/L]内。说明该回归模型可用于米根霉利用葡萄糖糖发酵产L-苹果酸产量的预测。经圆整后的最优组合条件与Box-Behnken中心组合试验设计方案表2中的中心点一致。
2.3 发酵工艺单因素试验结果
2.3.1 发酵设备对L-苹果酸产量的影响
按照1.3.1.4节的条件将接种过孢子悬浮液的培养基在发酵罐中培养,考察利用发酵罐在72 h内对L-苹果酸产量的影响,结果如图12所示。
在发酵罐中反应的产量高于前期摇瓶实验中的苹果酸产量,摇瓶发酵装液量少,发酵一段时间后溶氧不足,同时在培养过程中由于转速不足,CaCO3容易将菌体包裹住,导致发酵效果不佳,苹果酸产量下降,而利用德国Sartorius发酵罐进行实验,该设备具有全自动、可以随时调节温度、转速、通气量等基本发酵条件,探究发酵工艺对产酸的影响。
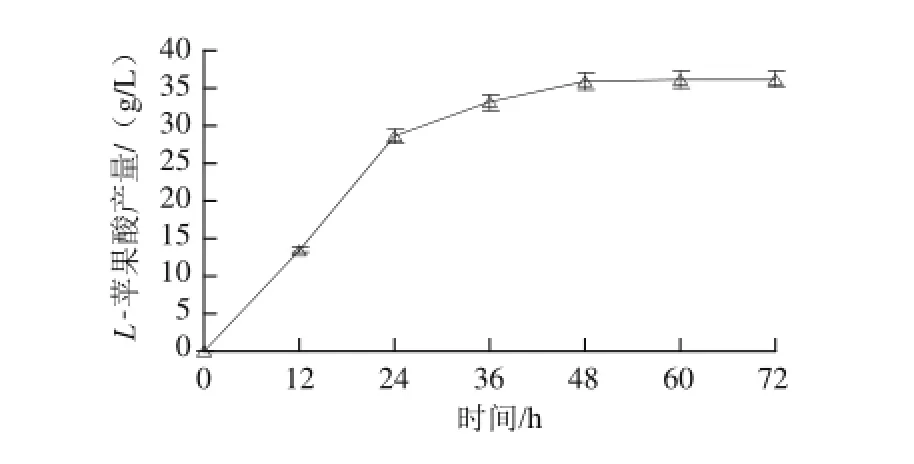
图12 发酵罐72 h内不同时间段LL--苹果酸的产量变化Fig.12 Time course ofL-malic acid yield during fermentation using stirring tank
2.3.2 发酵罐中通气量对L-苹果酸产量的影响
发酵罐中的通气量分别为(0.07、0.13、0.20、0.27 L/(min·L)),考察发酵温度对L-苹果酸产量的影响,结果如图13所示。

图13 通气量对L-苹果酸产量的影响Fig.13 Effect of ventilation on the production ofL-malic acid
随着通气量的增加,L-苹果酸产量逐渐增加,当通气量为0.20 L/(min·L)时,L-苹果酸产量达到最大值,为39.35 g/L;当通气量为0.27 L/(min·L)时,L-苹果酸产量与0.20 L/(min·L)时接近,虽然会增加罐内溶氧量,但由于通气量过大容易造成罐体内泡沫的产生,不利于后期发酵过程的进行,因此,有利于发酵产酸的较适通气量为0.20 L/(min·L)。
2.3.3孢子悬浮液培养时间对L-苹果酸产量的影响
取已培养好的斜面菌种一支,加入20 mL无菌水,轻轻将琼脂表面的孢子刮下,制成孢子悬浮液,再将20 mL孢子悬浮液加入到已经灭菌的1 L孢子悬浮液发酵培养基中,发酵时间分别定为0、24、48、72 h,考察孢子悬浮液培养时间对L-苹果酸产量的影响,结果如图14所示。
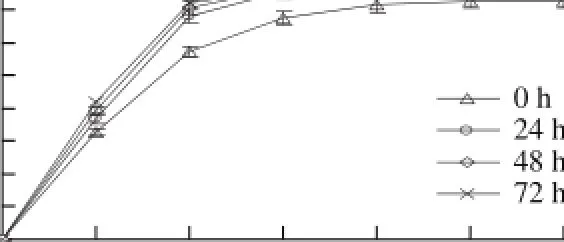
图14 孢子悬浮液培养时间对L-苹果酸产量的影响Fig.14 Effect of the spore suspension on the production ofL-malic acid
由图14可知,随着孢子悬浮液培养时间的增加,L-苹果酸产量逐渐增加,0~24 h的增长速率明显高于其他时间段,当发酵时间达到48 h时,L-苹果酸产量达到最大值,为39.51 g/L,当悬浮液培养时间超过48 h,达到72 h时,L-苹果酸产量略有降低,可能是因为培养时间过长后导致菌体量较大,在发酵过程中消耗营养物质速度加快,在消耗完营养物质后可能会继续消耗利用一部分代谢产物,所以导致最终苹果酸产量有所降低。
2.3.4 发酵罐中搅拌桨转速对L-苹果酸产量的影响
尝试使用300、400、500、600 r/min进行实验,发现300 r/min和400 r/min转速过低,会导致CaCO3在罐体中无法搅拌均匀,容易被菌体包裹,发酵过程无法顺利进行,而达到600 r/min时由于转速过高,泡沫生成量较大,会使发酵罐处于报警状态,发酵过程无法正常进行,所以采用500 r/min转速较为合适。
2.3.5 补料发酵对L-苹果酸产量的影响
在发酵到48 h测量的苹果酸产量趋于稳定,所以在发酵进行48 h后加入培养基进行补料发酵,按照补充培养基成分为40 g/L的葡萄糖、25 g/L CaCO3、1 g/L (NH4)2SO4配制,加入1 L蒸馏水,灭菌处理。考察连续发酵对L-苹果酸产量的影响,结果如图15所示。
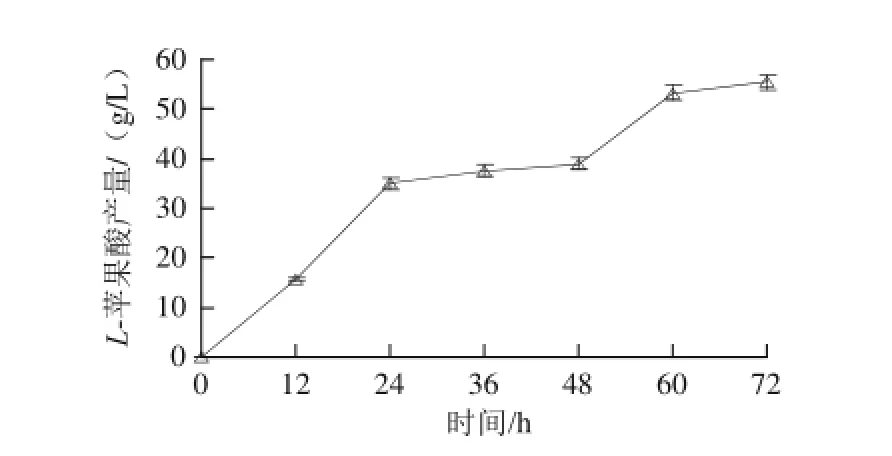
图15 补料发酵对L-苹果酸产量的影响Fig.15 Effect of fed-batch fermentation on the production ofL-malic acid
由图15可知,培养48 h,L-苹果酸产量为39.95 g/L;加入培养基后发酵到72 h,L-苹果酸产量最高,为55.4 g/L。故补料发酵可以有效增加L-苹果酸的产量。
2.4发酵产L-苹果酸发酵罐发酵进程曲线
采用优化的培养基和发酵条件,菌株发酵产L-苹果酸的发酵进程见图16。0~72 h之间生物量一直增长迅速,最终达到9.14 g/L,表明菌体生长旺盛;0~36 h之间苹果酸产量增长迅速,36~48 h之间苹果酸产量增长缓慢,此时罐体内培养基剩余量较少,在48 h时加入培养基进行补料发酵培养,48~72 h苹果酸产量增长迅速,但由于发酵罐容量有限,所以在72 h后不再添加发酵培养基,最终测得L-苹果酸产量达到57.71 g/L。由于米根霉在发酵过程中消耗氧气,所以溶氧量在0~72 h一直在下降,但一直维持在50%以上,也说明发酵罐持续通气会有利于反应的进行,克服了摇瓶发酵供氧不足的缺陷。
2.5 不同中和剂对L-苹果酸产量的影响
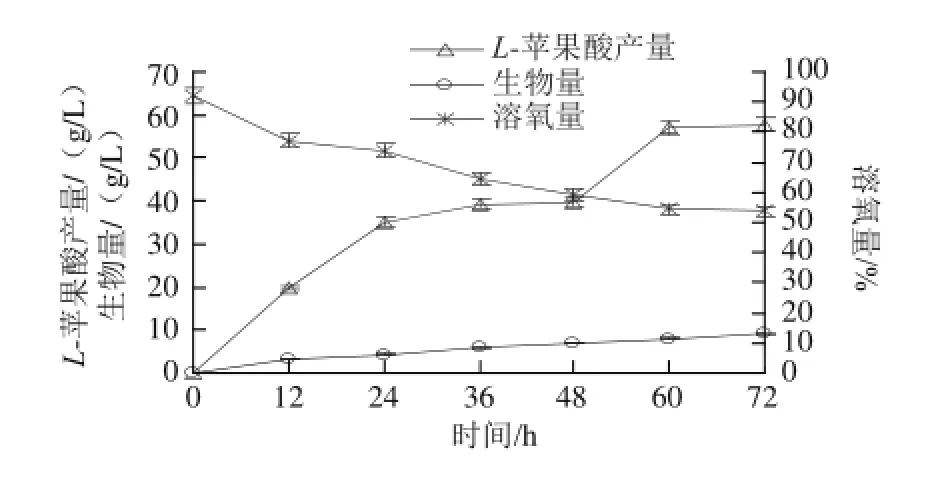
图16 优化条件下的发酵进程曲线Fig.16 Fermentation curve under optimized conditions
在前期摇瓶发酵实验中发现,使用CaCO3作为中和剂时易被菌体包裹,造成无法有效产酸,不利于摇瓶发酵,尝试采用NaOH和氨水代替CaCO3,解决在摇瓶发酵中出现的问题。NaOH的质量浓度为200 g/900 mL,氨水的浓度为10 mol/L,同时采用优化的培养基和发酵条件,pH值设为4.5,考察连续发酵对L-苹果酸产量的影响,结果如图17所示。
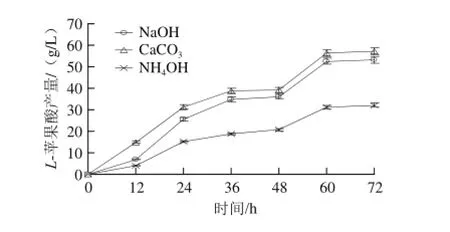
图17 不同中和剂对L-苹果酸产量的影响Fig.17 Effect of different neutralizing agents on the production ofL-malic acid
由图17可知,利用3 种不同的中和剂产酸效率和最终产酸量有明显的不同,CaCO3的产酸量明显高于NaOH和氨水,在48 h时添加培养基进行连续发酵,到72 h时利用不同中和剂进行发酵的产酸量均达到最大,使用CaCO3时的L-苹果酸终产量为57.21 g/L,而利用其他两种中和剂的产酸量分别为53.02 g/L和32.04 g/L,使用发酵罐进行试验时由于较高的转速可以有效避免中和剂被菌体包裹,所以在后期试验中还是建议采用CaCO3作为中和剂,但同时需要控制转速,从而使反应顺利进行。
2.6 代谢途径分析与主要酶活性检测
2.6.1 苹果酸合成主要途径
目前研究发现L-苹果酸在微生物细胞内有4 条合成途径:1)丙酮酸羧化或磷酸烯醇式丙酮酸羧化为草酰乙酸,再还原为L-苹果酸;2)由草酰乙酸与乙酰辅酶A合成柠檬酸后进入三羧酸循环生成L-苹果酸;3)支路乙醛酸循环合成L-苹果酸;4)延胡索酸由延胡索酸酶转化生成L-苹果酸[28]。
2.6.2 酶活力检测结果
根据苹果酸在生物体内的合成途径,选择合成途径中的几种关键酶,通过酶活测定初步判断此发酵过程中可能涉及的苹果酸合成路径。
测定发酵40 h时的柠檬酸合酶,苹果酸酶、苹果酸脱氢酶和丙酮酸羧化酶酶活,其中柠檬酸合成酶催化乙酰辅酶A合成柠檬酸,苹果酸酶催化丙酮酸合成苹果酸,苹果酸脱氢酶催化草酰乙酸合成苹果酸,丙酮酸羧化酶催化丙酮酸合成草酰乙酸。测得各个酶的酶活力分别为:柠檬酸合酶(35.075±1.550)U/mg、苹果酸酶(75.400±1.602)U/mg、苹果酸脱氢酶(626.65±7.58)U/mg、丙酮酸羧化酶(269.525±6.910)U/mg。
2.6.3 可能代谢途径初探
根据反应产物和酶活力测定值,结合TCA绘制了简要的代谢流程图,如图18所示。
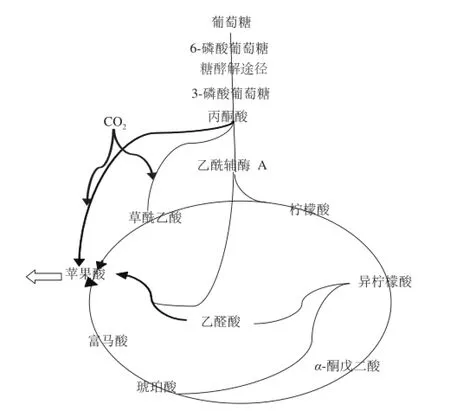
图18 菌株的简易代谢过程图Fig.18 Simple metabolic pathway for the strain
对比近几年其他研究人员开展有机酸发酵实验时测定的相关酶的活性数据,何皓等[29]在研究放线菌酮对米根霉积累L-苹果酸代谢途径的调控作用中测得的苹果酸脱氢酶活性最高为256 U/mg,丙酮酸羧化酶最高活性为101.6 U/mg。在研究曲霉N1-14’胞质酶活性与产L-苹果酸能力的关系中测得苹果酸酶的活性最高约为120 U/mg,苹果酸脱氢酶活性最高约为400 U/mg[30],结合本实验酶活力数据和图18可以看出,此发酵过程中柠檬酸合成酶的活性较强表明柠檬酸合成途径较强,从而得出TCA和乙醛酸循环的反应过程较强,而高溶氧量(dissolved oxygen,DO)会促进TCA和乙醛酸循环的进行,所以增大通气量和转速会提高反应体系的溶氧量,故利用发酵罐提高溶氧量会有效促进发酵反应的进行。
同样,相比其他研究中测得的酶活力比较可以发现,苹果酸酶、苹果酸脱氢酶和丙酮酸羧化酶的活性较强,可以促进苹果酸生成反应的进行,由图17可知,反应中加入的3种中和剂,CaCO3的效果最好,是因为在发酵中CaCO3会和生成的苹果酸反应生成难溶的苹果酸钙,从而达到减弱对关键酶的反馈抑制,使代谢向着生成和积累苹果酸的方向进行[31-32],另外,产生苹果酸的反应体系需要大量CO2作为底物,而CaCO3在作为中和剂时可以释放一部分CO2,促进苹果酸的累积,所以较其他两种中和剂的效果较好。
初步探究得出产苹果酸的主要路径受CO2固定化的影响,其中苹果酸酶催化丙酮酸生成苹果酸,苹果酸脱氢酶催化草酰乙酸生成苹果酸两个途径为CO2羧基化的主途径。
3 讨 论
采用响应面分析法对米根霉发酵产L-苹果酸的培养基进行优化,得到的最优培养基配方为:葡萄糖100 g/L、(NH4)2SO44.0 g/L、MgSO40.30 g/L、FeSO4·7H2O 0.025 g/L、KH2PO40.5 g/L、ZnSO40.1 g/L、CaCO380 g/L,L-苹果酸产量为(34.87±0.24)g/L,该值在模型响应值的95%预测区间[34.128 9 g/L,35.159 1 g/L]范围内,表明所建回归方程对米根霉利用葡萄糖发酵产L-苹果酸产量具有较好的预测效果。但是由于利用摇瓶发酵实验中转速、溶氧等条件限制,会出现部分CaCO3被菌体包裹住,导致产酸量偏低的现象,所以又利用发酵罐来对实验工艺进行改进,获得较优发酵条件为:发酵温度32℃、通气量0.20 L/(min·L)、转速500 r/min、孢子悬浮液单独培养48 h、发酵进行48 h后添加培养基进行补料发酵,发酵周期为72 h、L-苹果酸的产量为57.71 g/L。通过酶活性检测表明TCA和乙醛酸循环途径活跃,其中的苹果酸酶和苹果酸脱氢酶的酶活性较强,促进了苹果酸生成反应的进行,初步探究得出产苹果酸的主要路径受CO2固定化的影响(苹果酸酶催化丙酮酸生成苹果酸,苹果酸脱氢酶催化草酰乙酸生成苹果酸,这两个途径为CO2羧基化主途径),以及部分受TCA及乙醛酸循环涉及的耗氧的影响。米根霉突变株CICC40503-JST能够较好地以葡萄糖发酵产L-苹果酸,其产量得到有效提高,研究结果可为该菌株利用单糖或多糖发酵进行生物转化提供参考。在后期实验中,中和剂的有效利用、对代谢的调控和菌种的高产选育仍然是我们的研究重点。
参考文献:
[1]刘建军,姜鲁燕,赵祥颖,等.L-苹果酸的应用及研究进展[J].中国食品添加剂, 2003(3): 53-56.
[2]何皓,李霜,徐晴,等.积累L-苹果酸的米根霉突变株酶活性初探[J].微生物学通报, 2009, 6(3): 316-319.
[3]王锐清.L-苹果酸的生产及应用研究进展[J].化工时刊, 2002(5): 1-6. [4]吴军林,吴清平,张菊梅,等.L-苹果酸的生理功能研究进展[J].食品科学, 2008, 29(11): 692-695.
[5] MARIOD A A, IBRAHIM R M, ISMAIL M, et al. Antioxidant activity and phenolic content of phenolic rich fractions obtained from black cumin (Nigella sativa) seedcake[J]. Food Chemistry, 2009, 116(1): 306-312.
[6] GOLDBERG I, ROKEM J S, PINES O. Organic acids: old metabolites, new themes[J]. Journal of Chemical Technology and Biotechnology, 2006, 81(10):1601-1611.
[7]田三德,吴艳娜,解尚云,等.L-苹果酸一步发酵法的工艺研究及浅析[J].食品科技, 2008(6): 106-108.
[8]郝夕祥,刘建军,赵祥颖,等.黄曲霉积累L-苹果酸代谢机制初探[J].中国酿造, 2011, 30(6): 122-124.
[9]刘建龙,刘建军,杨连生,等.酶转化法及微生物发酵法生产L-苹果酸的研究进展[J].中国酿造, 2005, 24(7): 5-7.
[10]胡永红,欧阳平凯,沈树宝,等.反应分离耦合技术生产L-苹果酸工艺过程的优化研究[J]. 生物工程学报, 2001, 17(5): 503-505.
[11] ZAJKOSKA P, REBRO☒ M, ROSENBERG M. Biocatalysis with immobilizedEscherichia coli[J]. Applied Microbiology and Biotechnology, 2013, 97(4): 1441-1455.
[12] CAO Weifeng, LUO Jianquan, ZHAO Juan, et al. Intensification ofβ-poly(l-malic acid) production byAureobasidium pullulansipe-1 in the late exponential growth phase[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(7): 1073-1080.
[13] BATTAT E, PELEG Y, BERCOVITZ A, et al.Optimization ofL-malic acid production byAspergillus fl avusin a stirred fermentor[J]. Biotechnology and Bioengineering, 1991, 37: 1108-1116.
[14] TAKAO S, TANIDA M, KUWABARA H.L-malic acid production from non-sugar carbon sources byPaecilomyces varioti[J]. Journal of Fermentation Technology, 1977, 55(2): 196-199.
[15] TAING O, TAING K. Production of malic and succinic acids by sugar-tolerant yeastZygosaccharomyces rouxii[J]. European Food Research and Technology, 2007, 224(3): 343-347.
[16] PAYNE J, MORRIS J G. Pyruvate carboxylase inRhodopseudomonas spheroids[J]. Journal of General Microbiology, 1969, 59: 97-101.
[17] FERREIRA S L C, BRUNS R E, FERREIRA H S, et al. Box-Behnken design: an alternative for the optimization of analytical methods[J]. Analytica Chimica Acta, 2007, 597(2): 179-186.
[18] MARANA J P, MANIKANDAN S, THIRUGNANASAMBANDHAM K, et al. Box-Behnken design based statistical modeling for ultrasoundassisted extraction of corn silk polysaccharide[J]. Carbohydrate Polymers, 2013, 92(1): 604-611.
[19] MARUYAMA S A, PALOMBINI S V, CLAUS T,et al. Application of Box-Behnken design to the study of fatty acids and antioxidant activity from enriched white bread[J]. Journal of the Brazilian Chemical Society, 2013, 24(9): 1520-1529.
[20]纪德彬,王磊,周雍进,等.利用人工氧还酶体系催化L-苹果酸氧化脱羧反应[J].催化学报, 2012, 33(3): 530-535.
[21] SAFARI R, MOTAMEDZADEGAN A, OVISSIPOUR, et al. Use of hydrolysates from yellowfin Tuna (Thunnus albacares) heads as a complex nitrogen source for lactic acid bacteria[J]. Food and Bioprocess Technology, 2001, 5(1): 73-79.
[22] DURAN N, SEABRA A B. Microbial syntheses of metallic sulfide nanoparticles: an overview[J]. Current Biotechnology,2012, 1(4): 287-296.
[23] MANITCHOTPISIT P, SKORY C D, PETERSON S W, et al. Poly (β-L-malic acid) production by diverse phylogenetic clades ofAureobasidium pullulans[J]. Journal of Industrial Microbiology & Biotechnology, 2012, 39(1): 125-132.
[24]李永成,蒙诗奎.蔗糖糖蜜发酵生产L-苹果酸的研究[J].安徽农业科学, 2011, 39(1): 234-235; 249.
[25]刘建军,赵祥颖,田延军,等.糖质原料直接发酵生产L-苹果酸的工艺条件[J].食品与发酵工业, 2005, 31(1): 5-9.
[26] WU Y Y, DING L, XIA H L, et al. Analysis of the major chemical compositions in Fuzhuan brick-tea and its effect on activities of pancreatic enzymesin vitro[J]. African Journal of Biotechnology, 2010, 9(40): 6748-6754.
[27]张居尚,杨新文,雷萍,等.利用苹果渣发酵生产L-苹果酸工艺研究[J].食品科学, 2009, 30(2): 127-129.
[28]吴军林,吴清平,张菊梅.L-苹果酸生物合成研究进展[J].食品科学, 2014, 35(3): 238-242. doi: 10.7506/spkx1002-6630-201403048.
[29]何皓,李霜,徐晴,等.放线菌酮对米根霉积累L-苹果酸代谢途径的调控作用[J].过程工程学报, 2009, 9(1): 153-156.
[30]周小燕,吴清平,蔡芷荷,等.曲霉N1-14胞质酶活性与产L-苹果酸能力的关系[J].微生物学报, 2000, 40(5): 500-506.
[31]程媛媛,郑谊丰,王丽燕,等.响应面法优化β-聚苹果酸发酵培养基的研究[J].食品工业科技, 2011, 32(5): 197-199.
[32]吴艳丽,马霞,刘长虹,等.聚苹果酸发酵条件的优化[J].中国酿造, 2012, 31(9): 46-49.
Optimization of Medium Components and Fermentation Conditions for L-Malic Acid Production by Rhizopus oryzae
LIU Ya, YANG Ying, SUN Ting, WANG Haitao, ZHANG Min, PAN Lijun, JIANG Shaotong, LI Xingjiang*(School of Biotechnology and Food Engineering, Hefei University of Technology, Hefei 230009, China)
In order to improve the yield ofL-malic acid, the fermentation process and glucose metabolism pathways forRhizopus oryzaemutant strain CICC40503-JST were preliminary studied in this paper. The culture medium and fermentation conditions were optimized by using combination of single factor method and response surface methodology with central composite design. Meanwhile, the production and possible metabolic pathway ofL- malic acid were explored using stirred tank fermentor. The results showed that the optimal medium composition for malate production were determined as follows: glucose, (NH4)2SO4, MgSO4, FeSO4·7H2O, KH2PO4, ZnSO4and CaCO3100, 4.0, 0.3, 0.025, 0.5, 0.1 and 80 g/L, respectively. The fermentation conditions were optimized to be spore suspension incubation for 48 h and subsequent fermentation in a Sartorius fermentor at 32℃for 48 h followed by another 24 h after addition of fresh culture medium with a ventilation rate of volume of 0.20 L/(min·L) and a rotation rate of 500 r/min. Under these conditions, the yield ofL-malic acid was 57.71 g/L. In conclusion, the yield of malate could be improved significantly through effective utilization of glucose under the optimized culture conditions.
Rhizopus oryzae; glucose;L-malic acid; central composite design; enzyme activity
TS201.3
1002-6630(2015)11-0100-10
10.7506/spkx1002-6630-201511020
2014-05-13
国家自然科学基金青年科学基金项目(31101352);国家自然科学基金面上项目(31470002)
刘亚(1990—),男,硕士研究生,研究方向为食品微生物发酵。E-mail:liuya@mail.hfut.edu.cn
*通信作者:李兴江(1978—),男,副教授,博士,研究方向为食品微生物发酵。E-mail:lixingjiang1978@hfut.edu.cn

