动态高压微射流对牛血清白蛋白糖基化反应的影响
涂宗财,余 莉,黄小琴
动态高压微射流对牛血清白蛋白糖基化反应的影响
涂宗财,余 莉,黄小琴
(江西师范大学生命科学学院,江西 南昌 330022)
以牛血清白蛋白(bovine serum albumin,BSA)-葡萄糖为研究对象,通过比色法、差示扫描量热仪、红外光谱及圆二色谱研究动态高压微射流(dynamic high pressure microfluidization,DHPM)不同处理压力(40、80、120、160 MPa)对BSA-葡萄糖干热糖基化反应产物性质和结构的影响。结果表明:BSA-葡萄糖经DHPM处理后,其糖基化产物游离氨基含量明显减少,且随着压力的增加先减少后增加;经差示扫描量热仪分析得出其热稳定性随处理压力增大先升高后降低;红外光谱和圆二色谱分析表明,BSA-葡萄糖经DHPM预处理后,糖基化产物二级结构发生变化。这些结果说明DHPM促进了BSA-葡萄糖体系的糖基化反应。
牛血清白蛋白;动态高压微射流;糖基化;结构
蛋白质的糖基化反应是指亲水性的糖类物质以共价键接入食品蛋白质分子中,使糖基化产物既具有蛋白质的大分子特性,又具有糖类物质的亲水特性。影响蛋白质糖基化反应的因素很多,包括内在反应条件,如温度、反应时间、水分活度和反应物的性质等[1];超高压、超声波、微波和脉冲电场等外场辅助法也都有助于促进糖基化反应的进行。Schwarzenbolz等[2]研究发现600 MPa的高静压可以影响酪蛋白或氨基酸与糖的糖基化反应,减少某些副产物的产生;Guan Junjun等[3]采用微波加热大豆蛋白-糖溶液体系,发现微波加热明显加快大豆蛋白-糖共聚物的形成;Shi Wenhui等[4]发现牛血清白蛋白(bovine serum albumin,BSA)与葡萄糖溶液体系的美拉德反应程度随着超声强度的增大而提高,从而改变蛋白质的高级结构,并提高其抗氧化活性;Guan Yongguang等[5]研究发现脉冲电场可以促进BSA-葡聚糖溶液体系的糖基化反应。
动态高压微射流技术(dynamic high pressure microfluidization,DHPM)是集输送、混合、超微粉碎、加压、膨化等多种单元操作于一体的一门全新技术[6]。DHPM可以有效改善蛋白质、淀粉、膳食纤维等的结构和功能性质,是一种前景很好的食品生物大分子改性技术[7]。目前关于DHPM对蛋白质糖基化反应的影响相关研究少见报道。BSA作为一种常用的模式蛋白,也是牛奶中乳清蛋白的一种组成成分[8],以其为原料研究美拉德反应产物的功能特性,可以作为动物来源的代表性蛋白,对其他动物蛋白的糖基化改性可提供理论参考[9]。本课题组前期采用DHPM与糖基化反应相结合改性蛋白质,研究 发现DHPM预处理诱导BSA的结构发生变化,从而促进BSA的糖基化反应,提高BSA的糖基化程度并增加其糖基化位点[10]。DHPM诱导的蛋白质去折叠进而促进蛋白质的糖基化反应,表明DHPM为食品加工过程中糖基化反应的促进提供了一种有效方法。因此,本实验室在前期研究的基础上,以BSA-葡萄糖体系为研究对象,研究DHPM对反应体系游离氨基、热稳定性、二级结构和三级结构的影响,为DHPM在蛋白质-糖类反应体系中的应用提供一定的理论依据。
1 材料与方法
1.1材料与试剂
牛血清白蛋白(BSA)上海蓝季科技发展有限公司。
邻苯二甲醛(o-phthalic dicarboxaldehyde,OPA)国药集团化学试剂有限公司;十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)、β-巯基乙醇美国Sigma公司;葡萄糖、磷酸盐缓冲液、甲醇等均为分析纯。
1.2仪器与设备
M-110EH微射流均质机美国Microfluidics公司;MOS-450/AF-CD圆二色谱仪法国Bio-Logic SAS公司;UV-3200型紫外-可 见分光光度计上海美谱达仪器有限公司;Nicolet 6700红外光谱仪美国热电尼高利仪器有限公司;DSC 200 F3差示扫描量热仪德国耐驰仪器制造有限公司。
1.3方法
1.3.1样品制备
将BSA溶于蒸馏水中配成10 mg/mL的溶液,BSA溶液与葡萄糖按质量比1∶1混合后,采用DHPM均质机在0、40、80、120、160 MPa条件下分别处理3次,冷冻干燥,然后根据Ledesma[11]和Li Zheng[12]等的方法稍作修改,样品在55℃条件下干热反应20 h,4℃储存备用,所得样品分别表示为BSA、BSAG(BSA-葡萄糖)、BSAG40(BSA-葡萄糖经DHPM 40 MPa处理)、BSAG80(BSA-葡萄糖经DHPM 80 MPa处理)、BSAG120(BSA-葡萄糖经DHPM 120 MPa处理)、BSAG160(BSA-葡萄糖经DHPM 160 MPa处理)。
1.3.2游离氨基含量的测定
准确称取80 mg的OPA溶解于2 mL甲醇中,再加入20 g/100 mL SDS 5 mL,0.1 mol/L的硼砂50 mL及200μLβ-巯基乙醇,最后用蒸馏水定容到100 mL。测定时,配制0.5 mg/mL的样品溶液,取4.0 mL OPA试剂于试管中,加入200μL样品,混合均匀,放入35℃水浴中反应2 min后在340 nm波长处测定吸光度(A340nm),另取4.0 mL OPA试剂于试管中,加入200μL水作为空白对照。用相同的方法,以赖氨酸代替样品做出标准曲线,根据曲线计算样品中游离氨基的含量[13]。
1.3.3热稳定性
采用差示扫描量热仪的方法测定糖基化产物的变性温度,用样品铝盒称取6.0 mg左右的样品(精确到0.1 mg)。扫描温度范围为30~120℃,扫描速率为10℃/min。空盘作参比,记录峰值温度[14]。
1.3.4红外光谱测定
准确称量2 mg的样品,加入一定量的溴化钾至200 mg,用研钵研磨成均匀粉末,压制成薄片,再用红外光谱仪做全波段扫描(4 000~400 cm-1),扫描次数32次[15]。
1.3.5圆二色谱分析
根据Choi等[16]的方法,将样品采用10 mmol/L磷酸盐缓冲溶液(pH 7.0)配制成质量浓度为0.15 mg/mL的溶液,用1 mm的比色皿装样,置于圆二色谱仪测定。检测波长:190~250 nm,扫描速率:50 nm/min,宽度:1.0 nm,圆二色谱数据用平均椭圆率表示。采用圆二色谱分析网站计算不同二级结构含量。
1.4数据处理
样品测定均重复3次,实验数据采用Origin 8.0处理并用SPSS 20.0软件进行显著性差异分析(P<0.05)。
2 结果与分析
2.1游离氨基含量测定结果
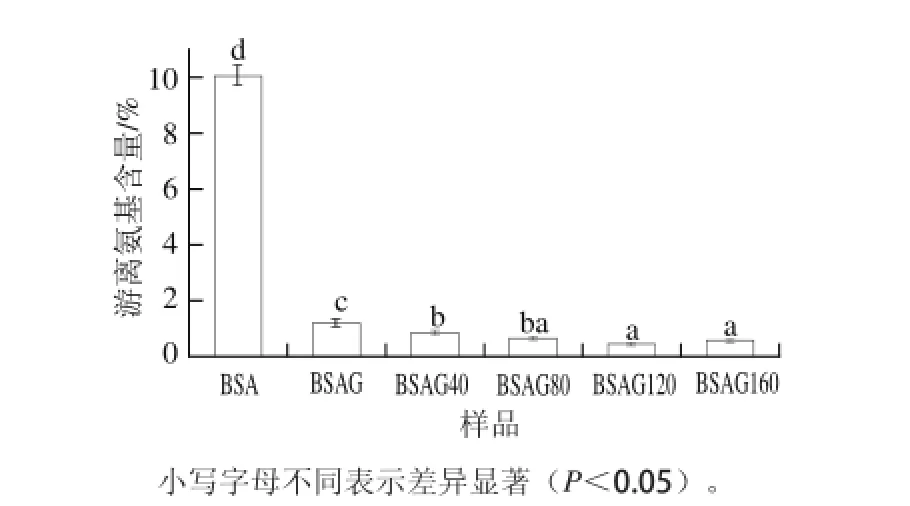
图1 DHPM不同压力对BSA-葡萄糖体系游离氨基含量的影响Fig.1 Effect of DHPM at various pressures on the free amino group content of BSA-glucose system
由图1可知,BSA经葡萄糖糖基化后游离氨基含量明显减少,与文献[9]结果相同。经DHPM均质处理后,BSA糖基化产物游离氨基含量随着压力的增加先减少后增加,在120 MPa时游离氨基含量最低,说明DHPM促进了BSA糖基化反应,这可能是因为压力诱导BSA构象发生变化,使其结构变得更为分散,糖基化反应位点增多,使得美拉德反应更加充分,游离氨基含量更少,当DHPM压力低于某个值时,蛋白质趋于去折叠状态,当压力继续升高,达到更大的值后,蛋白质将会聚集,使得糖基化产物的游离氨基含量又有所增加,这与Huang Xiaoqin等[10]研究结果相同。
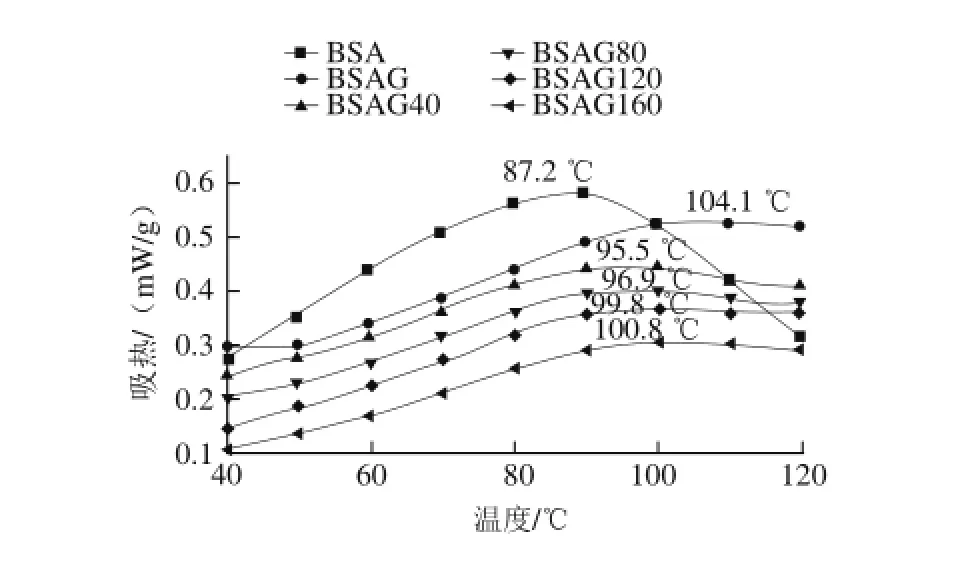
图2 DHPM不同压力对BSA-葡萄糖体系热稳定性的影响Fig.2 Effect of DHPM at various pressures on the thermal stability of BSA-glucose system
2.2热稳定性测定结果
由图2可知,原样BSA的热变性温度最低,经糖基化后明显提高,变性温度达到104.1℃,与文献[17-18]
报道相同。经DHPM均质处理后,BSA糖基化产物的热稳定性降低,随着处理压力的增大,热稳定性呈升高趋势,这是因为DHPM使BSA的构象发生变化,结构更为松散,部分相互作用力遭到破坏[19-20],说明DHPM降低了BSA的热稳定性,但糖基化又使得BSA的热稳定性明显提高,糖基化增强BSA热稳定性比DHPM降低BSA
热稳定性要显著,所以BSA糖基化产物的热稳定性随着DHPM压力的增大而增大,且都高于原样,低于未经DHPM处理的糖基化产物。
2.3红外光谱分析

图3 DHPM不同压力下BSA-葡萄糖体系的红外光谱Fig.3 Infrared spectra of BSA-glucose system after DHPM at various pressures
当蛋白质和糖共价结合后,在红外图谱上的典型特征是在1 360~1 250 cm-1范围内和在1 260~1 000 cm-1范围内出现吸收,这分别是C—N和C—O的伸缩振动引起的[21]。由图3可知,BSA经糖基化后红外图谱在1 360~1 250 cm-1范围内相对吸收增强,表明产物分子中新形成了C—N共价键[22],在1 260~1 000 cm-1范围内峰的吸收强度明显大于原蛋白,是因为葡萄糖的接入,引入了更多的C—O,使得对应吸收峰相对强度增大。1 500~1 350 cm-1波段的吸收峰强度增加,这说明接枝反应能引起C—H的弯曲振动及C—OH弯曲振动的增加。经DHPM处理的BSA糖基化产物的吸收峰随压力不同而发生不同程度的变化,有略微的红移或蓝移,峰位和峰面积有所变化,与文献[20]报道相同。
2.4圆二色谱分析
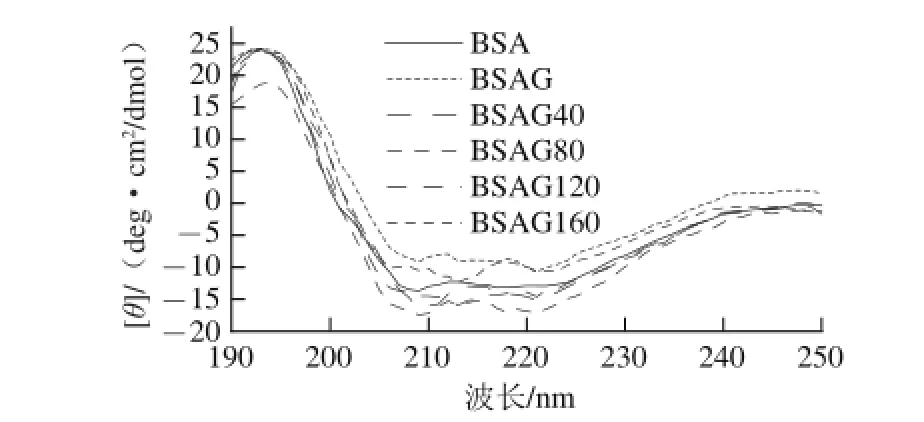
图4 DHPM不同压力下BSA-葡萄糖体系的圆二色谱图Fig.4 CD of BSA-glucose system after DHPM at various pressures
由图4可知,糖基化后BSA的二级结构遭到破坏,192、208 nm和222 nm的吸收较原蛋白明显减弱,表明产物中α-螺旋结构显著减少[23],说明蛋白质二级结构发生显著变化。由表1可知,BSA的二级结构主要为α-螺旋,没有β-折叠,与文献[24]报道相同,经糖基化后,α-螺旋显著减少,而β-折叠、β-转角和无规卷曲含量增加,这是由于蛋白质肽链中引入葡萄糖,其空间位阻效应引起无规卷曲含量增加[9];另一方面,游离氨基参与反应,分子间氢键遭到破坏,减弱了蛋白质分子间的相互作用力,导致蛋白质分子充分伸展。经不同压力DHPM处理后BSA糖基化产物的α-螺旋向β-折叠和无规卷曲转变,这是因为BSA经高压处理后结构更为松散,与Zhang Min等[25]报道相同。
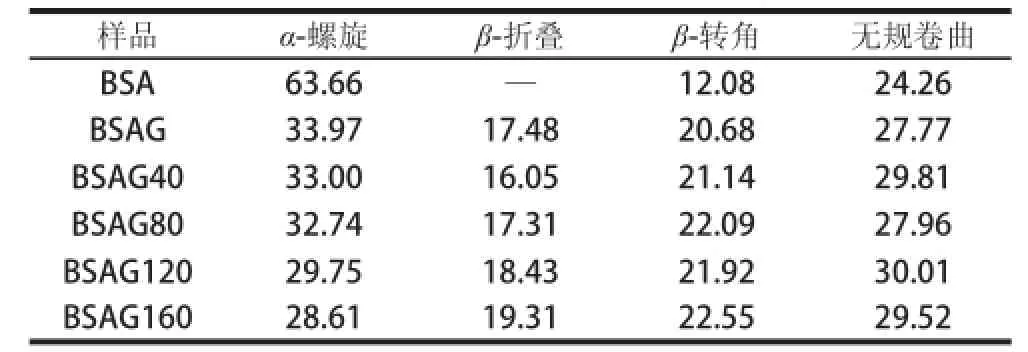
表1 DHPM不同压力下BSA-葡萄糖体系的二级结构含量Table 1 Secondary structure contents of BSA-glucose system after DHPM at various pressureess%
3 结 论
BSA-葡萄糖经DHPM处理后糖基化产物的游离氨基、热稳定性和结构发生了一定变化。BSA糖基化后游离氨基明显减少,随着压力的增大游离氨基含量先减少后增加;糖基化后BSA的热稳定性显著提高,变性温度由原来87.2℃升高到104.1℃,经DHPM不同压力处理后,其热变性温度随压力增大逐渐升高;利用红外光谱和圆二色谱分析表明二级结构发生变化。这些变化说明BSA与葡萄糖发生共价交联时改变了蛋白质结构,导致游离氨基含量明显减少,DHPM不同压力处理,造成BSA聚集状态不同程度的破坏,同时使蛋白质构象发生变化,使得游离氨基随着压力增加有略微下降趋势,以上结果说 明DHPM预处理促进了BSA-葡萄糖体系的糖基化反应。
[1] LIU Jianhua, RU Qiaomei, DING Yuting. Glycation a promising method for food protein modification: physicochemical properties and structure, a review[J]. Food Research International, 2012, 49(1): 170-183.
[2] SCHWARZENBOLZ U, KLOSTERMEYER H, HENLE T. Maillard reaction under high hydrostatic pressure: studies on the formation of protein-bound amino acid derivatives[J]. International Congress Series, 2002, 1245: 223-227.
[3] GUAN Junjun, QIU Aiyong, LIU Xiaoya, et al. Microwave improvement of soy protein isolate-saccharide graft reactions[J]. Food Chemistry, 2006, 97(4): 577-585.
[4] SHI Wenhui, SUN Weiwei, YU Shujuan, et al. Study on the characteristic of bovine serum albumin-glucose model system, treated by ultrasonic[J]. Food Research International, 2010, 43(8): 2115-2118.
[5] GUAN Yongguang, LIN Hua, HAN Zhong, et al. Effects of pulsed electric field treatment on a bovine serum albumin-dextran model system, a means of promoting the Maillard reaction[J]. Food Chemistry, 2010, 123(2): 275-280.
[6] LIU Wei, LIU Jianhua, LIU Chengmei, et al. Activation and conformational changes of mushroom polyphenoloxidase by high pressure microfluidization treatment[J]. Innovative Food Science & Emerging Technologies, 2009, 10(2): 142-147.
[7] LIU Wei, ZHANG Zhaoqin, LIU Chengmei, et al. The effect of dynamic high-pressure microfluidization on the activity, stability and conformation of trypsin[J]. Food Chemistry, 2010, 123(3): 616-621.
[8] CONSIDINE T, PATEL H, ANEMA S, et al. Interactions of milk proteins during heat and high hydrostatic pressure treatments: a review[J]. Innovative Food Science & Emerging Technologies, 2007, 8(1): 1-23.
[9]林花.牛血清白蛋白-葡聚糖接枝改性及机理研究[D].广州:华南理工大学, 2010: 8; 19; 32.
[10] HUANG Xiaoqin, TU Zongcai, WANG Hui, et al. Glycation promotedby dynamic high pressure microfluidisation pretreatment revealed by high resolution mass spectrometry[J]. Food Chemistry, 2013, 141(3): 3250-3259.
[11] LEDESMA O, ANA I, RAMOS C, et al. Characterization of bovine serum albumin glycated with glucose, galactose and lactose[J]. Acta Biochimica Polonica, 2008, 55(3): 491-497.
[12] LI Zheng, LUO Yongkang, FENG Ligeng. Effects of Maillard reaction conditions on the antigenicity ofα-lactalbumin andβ-lactoglobulin in whey protein conjugated with maltose[J]. European Food Research and Technology, 2011, 233(3): 387-394.
[13] SERPEN A, GOKMEN V. Evaluation of the Maillard reaction in potato crisps by acrylamide, antioxidant capacity and color[J]. Journal of Food Composition and Analysis, 2009, 22(6): 589-595.
[14] WANG Qian, ISMAIL B. Effect of Maillard-induced glycosylation on the nutritional quality, solubility, thermal stability and molecular configuration of whey proteinv[J]. International Dairy Journal, 2012, 25(2): 112-122.
[15] GARCIA B, ANA B, CARDELLE C, et al. Effect of drying methods on the reactivity of chitosan towards Maillard reaction[J]. Food Hydrocolloids, 2012, 29(1): 27-34.
[16] CHOI S J, MOON T W. Influence of sodium chloride and glucose on the aggregation behavior of heat-denatured ovalbumin investigated with a multiangle laser light scattering technique[J]. Journal of Food Science, 2008, 73(2): C41-C49.
[17] BROERSEN K, VORAGEN A G, HAMER R J, et al. Glycoforms ofβ-lactoglobulin with improved thermostability and preserved structural packing[J]. Biotechnology and Bioengineering, 2004, 86(1): 78-87.
[18] JAFARI-AGHDAM J, KHAJEH K, RANJBAR B, et al. Deglycosylation of glucoamylase fromAspergillus niger: effects on structure, activity and stability[J]. Biochimica et Biophysica Acta (BBA)-Proteins and Proteomics, 2005, 1750(1): 61-68.
[19]钟俊桢.动态高压微射流技术对乳清蛋白性质和结构的影响[D].南昌:南昌大学, 2009: 50-52.
[20]黎鹏.动态超高压微射流技术对花生球蛋白功能性质的影响及其机理研究[D].南昌:南昌大学, 2007: 46-50; 61-65.
[21]孙炜炜.乳清分离蛋白-葡聚糖接枝改性及功能性质研究[D].广州:华南理工大学, 2012: 25.
[22]杜廷发,刘静宇,胡慎信.汉英对照有机波谱分析纲要[M].长沙:国防科技大学出版社, 2001: 5.
[23] PELTON J T, MCLEAN L R. Spectroscopic methods for analysis of protein secondary structure[J]. Analytical Biochemistry, 2000, 277(2): 167-176.
[24] BOUHEKKA A, BURGI T. Photodegradation of adsorbed bovine serum albumin on TiO2anatase investigated byin-situATR-IR spectroscopy[J]. Acta Chimica Slovenica, 2012, 59(4): 841-847.
[25] ZHANG Min, DANG Yongqiang, LIU Tianying, et al. Pressure-induced fluorescence enhancement of the BSA-protected gold nanoclusters and the corresponding conformational changes of protein[J]. The Journal of Physical Chemistry C, 2012, 117(1): 639-647.
Effect of Dynamic High Pressure Microfluidization on Glycation of Bovine Serum Albumin
TU Zongcai, YU Li, HUANG Xiaoqin
(College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
The effect of dynamic high pressure microfluidization (DHPM) with different pressure (40, 80, 120, and 160 MPa) on the properties and structure of bovine serum albumin (BSA)-glucose dry glycosylation reaction products was investigated by colorimetry, differential scanning calorimetry, infrared spectroscopy, and circular dichroism spectrum. After DHPM treatment, the content of free amino group in BSA-glucose glycosylation products was significantly reduced, which first decreased and then increased with increasing pressure. Differential scanning calorimetry analysis showed that the thermal stability of glycosylation products first increased and then decreased as the pressure increased. Infrared spectroscopy and circular dichroism spectrum analysis showed changed secondary structure. These results indicate that DHPM can promote the glycosylation of BSA-glucose system.
bovine serum albumin; dynamic high pressure microflu idization; glycosylation; structure
TS201.2
1002-6630(2015)11-0017-04
10.7506/spkx1002-6630-201511004
2014-06-30
国家自然科学基金地区科学基金项目(2007DA105064)
涂宗财(1965—),男,教授,博士,主要从事极端条件下食品蛋白质营养与安全研究。E-mail:tuzc_mail@aliyun.com

