偏钒酸铵的热分解行为和影响因素
谌晓玲 王 莉 王小莉 陈晓华 陶川东
(西南化工研究设计院有限公司,四川成都,610225)
偏钒酸铵(NH4VO3)是白色或带淡黄色的结晶粉末,微溶于冷水、热乙醇和乙醚,溶于热水及稀氢氧化铵,熔点200℃。主要用作化学试剂、催化剂、催干剂、媒染剂等,陶瓷工业广泛用作釉料[1],也是铵盐沉钒法生产五氧化二钒过程中,重要的过程产物[2]。
偏钒酸铵作为生产五氧化二钒的重要中间产物,尽管其热分解过程已有文献报道,且人们就氩气气氛下反应机理进行了研究[3],但在空气气氛下的热分解行为和影响因素研究尚不清楚,因此,开展偏钒酸铵在空气气氛下的热分解行为和影响因素探究对制备五氧化二钒具有重要的意义。
在此,本文用热分析技术对偏钒酸铵在空气中的热行为进行研究,并利用Kissinger法和Flynn-Wall-Ozawa对热分解过程的反应热,以及样品取样量的等影响因素进行探究。
1 试验部分
1.1 试样情况
实验所采用的偏钒酸铵:分析纯AR(≥99.0%),成都市科龙化工试剂厂。
1.2 实验设备
热重分析采用德国NETZSCH-STA449-F3型热分析仪,样品质量为4-10mg,升温速率β分别为5,10,15和20K/min,测量温度范围为40-550K,空气气氛和高纯氦气氛,流速为50mL/min。DSCTG支架。Al坩埚。
1.3 实验过程
热分析:仪器维稳后,按测定试样条件分别较定不同升温速率下的DSC基线。取空的Al坩埚作参比,将干燥过后的试样,放入铝坩埚中,经封样器封好后,放入DSC支架上,使用仪器天平称量后,开始测定。
2 实验结果与讨论
2.1 热行为和热分解
偏钒酸钠在空气气氛中不同升温速率下的DSC和TG曲线见下图1和图2。
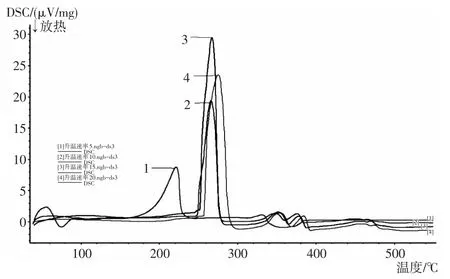
图1 5,10,15,20K/min升温速率下的DSC曲线

图2 5,10,15,20K/min升温速率下的TG曲线
由图1、图2可知,在温度200-300℃之间,DSC出现一个吸热峰,TG出现一个失重平台,约为15.34%-15.71%。随着升温速率的增大,偏钒酸钠分解温度逐步升高。但在不同升温速率下,TG曲线的失重趋势基本相同,说明其质量损失率基本一致。
由图3可知,空气气氛下,DSC曲线的4个峰与TG曲线上的质量损失台阶一一对应。本文主要从偏钒酸铵升温速率为10K/min的DSC/TG曲线进行分析。

图3 10K/min升温速率下的DSC、TG曲线
由计算升温速率为10K/min的DSC/TG曲线可知,偏钒酸铵在空气中的分解过程为4步分解:第一个质量损失台阶出现在220-280℃,是一个明显的分解峰,为主要的分解阶段,其质量损失率为15.47%;在320-340℃出现第二个质量损失台阶,质量损失率为3.36%,应该是进一步的分解;340-390℃出现第三个质量损失台阶,质量损失率为1.83%;460-500℃出现第四个质量损失台阶,质量损失率为6.37%。
可见偏钒酸铵分解为四步,总质量损失为27%。通过对热分解过程中,尾气经pH试纸测定,从分解开始至结束均有氨气生成,则可以确定,热分解最终产物为氨气、水、五氧化二钒,反应总方程式为:
2NH4VO3=V2O5+2NH3↑+H2O
2.2 热分解反应活化能的计算
固体分解反应动力学方程一般可表示为[4-5]:

根据Arrhenius公式k=Aexp[E/(RT)],将其代入式(1)得:
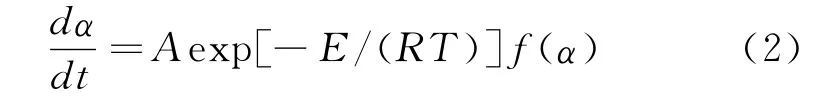
式中:α为转化率;dα/dt为分解速率;A为指前因子,s;E为活化能,kJ/mo1;T为热力学温度,K;f(α)为机理函数的微分形式。
对于程序升温过程,升温速率β=dT/dt恒定,则得Kissinger方程:

Flynn-Wall-Ozawa方程[6]:

式中:R为气体摩尔常数;TP为峰顶热力学温度;g(α)为机理函数的积分形式。
在多重升温速率条件下,当转化率α一定时,g(α)为常数,则lnβ=常数-1.052E/RTP;ln(β/T2)=常数-E/RT。以lnβ或ln(β/T2)对1/T作图,由斜率求的活化能E。
在5,10,15和20K/min不同升温速率下,偏钒酸铵热分解第1阶段的DSC峰顶温度分别为494.3K、519.4K、540.2K 和552.1K,用 Kissinger法和Flynn-Wall-Ozawa法处理这些数据,如表1所示。
以ln(β/TP2)对1/TP 作图4,斜率=-1.052E/R,由此求活化能E。
线性回归结果:

热分解活化能:
E=-K R/1.052=45.34kJ/mol
以lnβ对1/TP作图5,斜率=-E/R,由此求的活化能E。
线性回归结果为:

热分解反应活化能:
E=-KR=50.94kJ/mol
由上面可知,平均活化能E=48.14kJ/mol
由 Kissinger法和Flynn-Wall-Ozawa法计算所得的活化能E为48.14kJ/mol。

表1 偏钒酸铵不同升温速率下的峰顶温度数据处理汇总

图4 以ln(β/TP2)对1/TP 作图

图5 以lnβ对1/TP作图
2.3 不同气氛条件的影响
实验过程中采用高纯氦的气氛与空气气氛进行对比实验,由图6可知,在同样的10K/min升温速率下,不同气氛,空气和氦气的TG曲线基本相吻合,第一台阶质量损失率为15.1%-16.0%,吸热峰峰值为265℃。

图6 10K/min升温速率下空气和氦气气氛的DSC、TG曲线
2.4 样品量的影响
试验中发现,称取试样量的多少对反应温度和反应热的结果均有影响。称取不同样品量(4.2-10.2mg)的偏钒酸铵,均以10K/min升温速率的条件测定其反应温度和反应热,试验结果见表2。以反应峰温和反应热的方差来比较不同样品量对测量结果精密度的影响,试验结果数据处理汇总见表3。

表2 不同样品量偏钒酸铵反应温度和反应热测定结果

表3 不同样品量偏钒酸铵反应温度数据处理结果汇总
由表4可知,样品量较少的偏钒酸铵反应温度和反应热测量结果的方差较大,因此从实验精密度考虑,在做偏钒酸铵的测定时应选取较大的样品量。

表4 不同样品量偏钒酸铵反应热数据处理结果汇总
3 结论
(1)在空气气氛中,偏钒酸铵的热分解过程分4个阶段,其最终分解产物为V2O5,NH3,H2O。
(2)不同升温速率下,偏钒酸钠分解温度逐步升高。但TG曲线的失重趋势基本相同,说明其质量损失率基本一致。
(3)用 Kissinger法和 Flynn-Wall-Ozawa法计算所得的活化能E为48.14kJ/mol。
(4)在空气和氦气的气氛下,主要分解过程,250-280℃,第一台阶质量损失率为15.4%-16.2%,吸热峰峰值为265℃。
(5)样品量的大小对反应温度和反应热的测量结果有影响。从实验精密度考虑,在做偏钒酸铵的测定时应选取较大的样品量。
[1]刘国红.ICP-OES法同时测定偏钒酸铵中的 Al,Fe,Cd,As,Na,K,Si含量[J].中国西部科技,2011,10(22):19-20.
[2]高峰,颜文斌,李佑稷,等.偏钒酸铵的制备及沉钒动力学[J].硅酸盐学报,2011,39(9):1423-1427.
[3]储绍彬,周丽珍,王忠敏.偏钒酸铵热分解研究[J].化工冶金,1991,12(1):69-70.
[4]Brown M E,Dollimore D,Galwey,et a1.Reactions in the solid state in comprehensive chemical kinetics[M].Amsterdam:Elsevier,1980:41-113.
[5]Galwey A K,Brown M E.Thermal decomposition of Ionic solids[M].Amsterdam:Elsevier,1999:75-77.
[6]胡荣祖,史启祯.热分析动力学[M].北京:科学出版社,2001:125-126.

