红薯叶不同溶剂提取物抗氧化性及活性成分鉴定
涂宗财,傅志丰,王 辉,张 露,温庆辉,李金林,段邓乐,李如一
(1.南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学生 命科学学院,江西 南昌 330022)
红薯叶不同溶剂提取物抗氧化性及活性成分鉴定
涂宗财1,2,傅志丰1,王 辉1,张 露1,温庆辉1,李金林2,段邓乐1,李如一1
(1.南昌大学食品学院,食品科学与技术国家重点实验室,江西 南昌 330047;2.江西师范大学生 命科学学院,江西 南昌 330022)
研究不同极性溶剂对红薯叶中酚类化合物的提取以及提取物抗氧化性的影响,并鉴定提取物中的主要抗氧化成分组成。分别采用极性不同的7种溶剂(蒸馏水、甲醇、无水乙醇、丙酮、正丁醇、乙酸乙酯和氯仿)从红薯叶中提取多酚,并评价提取物中总酚、总黄酮和花青素的含量,以及对1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力和还原能力,最后运用高效液相色谱-串联质谱(high performance liquid chromatography tandem mass spectroscopy,HPLC-MS/MS)技术分析抗氧化活性最好的提取物中多酚的主要组成成分。结果表明:提取溶剂的极性对红薯叶中多酚类化合物的提取效率和提取物抗氧化活性有很大的影响,水提物具有最高的粗提物得率((37.13±1.60)%),而甲醇提取物中总酚含量(13.80 mg GAE/g)和总黄酮含量((5.68±0.35)mg QE/g)最高,且具有最好的DPPH自由基清除能力(IC50为0.32 mg/mL)与还原能力(ρ0.5为0.95 mg/mL)。采用HPLC-MS/MS从红薯叶甲醇提取物中鉴定9种、初步鉴定3种酚类化合物,鉴定的化合物为咖啡酸、对羟基苯甲酸、1-咖啡酸奎宁酸、3-咖啡酸奎宁酸、异绿原酸A、异绿原酸B、异绿原酸C、3,4,5-三咖啡酰奎尼酸和金丝桃苷。
红薯叶;多酚;溶剂提取;抗氧化活性;高效液相色谱-串联质谱
红薯(Ipomoea batatas(L.)Lam.),学名番薯,又名甘薯、甜薯,是世界第七大粮食作物,也是我国主要的粮食作物之一。2011年,我国红薯年产量达7 560万t,占世界总产量的76.07%[1]。红薯叶作为红薯的副产品之一,富含多酚、蛋白质、维生素和矿物质等营养成分,营养价值高,具有提高免疫力、抗氧化、促进新陈代谢等多种保健功效[2]。在日本、台湾等地区,红薯叶已经成为了一种新型的蔬菜[3]。然而,我国大部分地区对红薯叶的开发利用非常有限,绝大部分红薯叶都被当作牲畜饲料,或者直接被遗弃,造成了巨大的资源浪费[4]。因而有必要对红薯叶中有效成分进行开发利用,提高红薯叶的附加值。
多酚是红薯叶中重要的活性成分,具有清除自由基、降血糖、抑菌等功效[5]。多酚的有效提取一直是食品领域的研究热点。目前多酚常用的提取方法有溶剂萃取法、超声提取法、微波提取法和吸附分离提取法等[6],其中水-有机溶剂萃取法是目前应用最广的方法[7]。提取多酚常用的有机溶剂有甲醇、乙醇、丙酮、乙酸乙酯以及这些溶剂与水的混合溶剂等[8],但是不同植物的化学组成差异导致不同植物中多酚的最适提取溶剂不同。陆健等[9]研究不同溶剂对大麦多酚的提取效率时发现,80%丙酮水溶液比乙醇或水具有更高的多酚提取效率,而在另外一个报道中,Singh等[10]发现提取石榴果肉多酚的最好溶剂为乙醇。目前提取红薯叶多酚的溶剂主要是甲醇、乙醇的水溶液[11],但有关不同溶剂对红薯叶多酚的提取效率及提取物抗氧化性影响的研究未见报道。因此,本实验以红薯叶为原料,研究极性不同的7种溶剂(蒸馏水、甲醇、无水乙醇、丙酮、正丁醇、乙酸乙酯和氯仿)对红薯叶中多酚类化合物提取效果的影响,并比较提取物抗氧化活性的差异,最后采用高效液相色谱-串联质谱技术(high performance liquid chromatography tandem mass spectroscopy,HPLC-MS/MS)鉴别红薯叶提取物中主要的抗氧化成分,旨在为红薯叶中多酚类物质的研究开发及工业化生产提供有益参考。
1 材料与方法
1.1 材料与试剂
红薯叶,于2013年11月上旬采自江西省南昌县番薯种植基地,经南昌大学食品学院石燕教授鉴定为红心番薯叶(red-fleshIpomea batatas(L.)Lam. leaves)。将采摘的新鲜红薯叶表面去除杂质,清水漂洗干净,50℃鼓风干燥72 h,然后粉碎过60目筛,放入自封袋中,置于干燥器中备用。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma公司;没食子酸和槲皮素标准品 中国药品生物制品检定所;Folin-酚试剂 北京索莱宝生物科技有限公司;碳酸钠、无水乙醇、甲醇、丙酮、正丁醇、氯仿和乙酸乙酯等均为分析纯 天津大茂化学试剂厂;甲酸(色谱纯)、咖啡酸、金丝桃苷、3-O-咖啡酰基奎宁酸(3-O-caffeoylquinic acid,3-CQA)、3,5-O-二咖啡酰奎宁酸(3,5-O-dicaffeoylquinic acid,3,5-diCQA)、3,4-O-二咖啡酰奎宁酸(3,4-O-dicaffeoylquinic acid,3,4-diCQA)、4,5-O-二咖啡酰奎宁酸(4,5-O-dicaffeoylquinic acid,4,5-diCQA) 阿拉丁试剂(上海)有限公司;甲醇(色谱纯) 德国Merck公司。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;DFY-500C试样粉碎机 温岭市林大机械有限公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;LGJ-1冷冻干燥机 北京亚泰科隆仪器技术有限公司;Agilent 6538高分辨四极杆-飞行时间质谱仪(配有电喷雾离子源及Masshunter数据处理系统)、1290高效液相色谱系统(配有二极管阵列检测器) 美国安捷伦公司。
1.3 方法
1.3.1 红薯叶不同溶剂提取物的制备
准确称取7份红薯叶粉末,每份5.0 g,分别用蒸馏水、甲醇、无水乙醇、丙酮、正丁醇、乙酸乙酯和氯仿按1∶20(m/V)的料液比混合,并在振动摇床上55℃振荡提取90 min,提取液4 000 r/min离心10 min,残渣再按照相同的实验条件提取1次,合并上清液,过滤,用相应的提取溶剂定容至250 mL。取10 mL提取液用于成分和抗氧化性分析,剩余240 mL样品用旋转蒸发仪器浓缩至膏状,然后置于冷冻干燥机中冻干,并称量质量计算提取物得率,计算公式如下。

式中:m1为浓缩干燥后圆底烧瓶的质量/g;m2为浓缩前圆底烧瓶的质量/g;m3为折算后红薯叶粉末的质量(4.8 g)。
1.3.2 总酚、总黄酮和花青素含量测定
采用Folin-酚法[12]测定总酚含量。以没食子酸(gallic acid,GA)为标准品(10~60 ☒g/mL)绘制标准曲线,得到回归方程:Y=0.016 9X+0.037 3(R2=0.997 6)。总酚含量以干物质质量计,单位为mg GAE/g。
采用氯化铝比色法[13]测定样品中总黄酮含量。以槲皮素(quercetin,QE)为标准品(2~12μg/mL)绘制标准曲线,得到回归方程:Y=0.033 8X+0.017 3(R2=0.999 5)。总黄酮含量以干物质质量计,单位为mg QE/g。
采用pH示差法[14]测定样品中花青素含量。以矢车菊花素-3-O-葡萄糖苷(cyanidin-3-O-glucoside)为标准品,花青素含量以干物质质量计,单位为mg c-3-gE/100 g。
1.3.3DPPH自由基清除能力的测定[15]
取2.0 mL不同质量浓度的样品溶液和2.0 mL 0.1 mmol/L DPPH溶液混合,摇匀,避光反应30 min后,以无水乙醇为空白,于5 1 7 n m波长处测吸光度。以对D P P H自由基的清除率达5 0%时(IC50,mg/mL)所需要的样品质量浓度来比较不同溶剂提取液对DPPH自由基清除能力的大小。DPPH自由基清除率按下式计算。
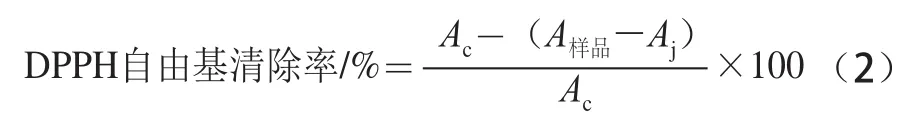
式中:A样品为2.0 mL样品溶液和2.0 mL DPPH溶液的吸光度;Ac为2.0 mL无水乙醇和2.0 mL DPPH溶液的吸光度;Aj为2.0 mL样品溶液和2.0 mL无水乙醇的吸光度。
1.3.4 还原力的测定[16]
取1.0 mL不同质量浓度的样品溶液,加1.0 mL 1 g/100 mL的K3Fe(CN)6溶液,50℃水浴20 min后,加入1.0 mL 10%三氯乙酸终止反应,然后加入2.0 mL蒸馏水和0.4 mL 0.1 g/100 mL的FeCl3显色,最后于700 nm波长处测吸光度。吸光度越高代表还原力越大。以反应体系的吸光度为0.5时所需要的样品质量浓度(ρ0.5,mg/mL)来比较提取物还原能力的大小。
1.3.5 HPLC-MS/MS分析
称取一定量干燥的甲醇提取物,用70%甲醇配成20 mg/mL的溶液,过0.22 ☒m微孔滤膜后用于HPLC-MS/MS分析。液相色谱条件:A g i l e n t X D B C18柱(250 mm×4.6 mm,0.25 ☒m);流动相A:水(含0.1%的甲酸),流动相B:甲醇,梯度洗脱程序如下:0~15 min,10%~35%B;15~50 min,35%~80%B;50~55 min,80%~100%B;55~65 min,100%B;流速1.0 mL/min,检测波长320 nm,进样量5μL,柱温30℃。
质谱条件:电喷雾离子化源;负离子扫描模式;喷雾气压力50 psi;干燥气流速10 mL/min;干燥器温度350℃;毛细管裂解电压4 000 V;质量数扫描范围:m/z50~1 000。通过与文献、数据库(Metlin、Chemspider)比较化合物的保留时间、母离子、裂解规律以及紫外吸收光谱,并结合标品(咖啡酸、金丝桃苷、3-CQA、3,4-diCQA、3,5-diCQA、4,5-diCQA)对化合物进行鉴定。
1.4 数据分析
每组实验重复3次,结果表示为,采用Origin 8.0绘图软件绘图,SPSS 13.0对数据进行统计学分析。
2 结果与分析
2.1 红薯叶不同溶剂提取物得率、总酚、总黄酮和花青素含量
表1 红薯叶不同溶剂提取物得率、总酚、总黄酮和花青素含量Table1 Extraction yields and contents of total phenolic, total flavonoid and anthocyanins from sweet potato leaf extracts with different solvents
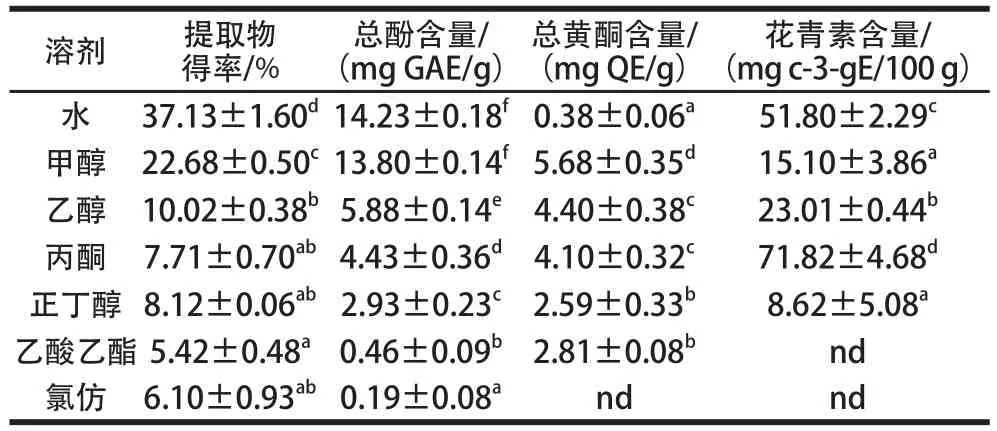
表1 红薯叶不同溶剂提取物得率、总酚、总黄酮和花青素含量Table1 Extraction yields and contents of total phenolic, total flavonoid and anthocyanins from sweet potato leaf extracts with different solvents
注:同列小写字母不同表示差异显著(P<0.05);nd.未检出或者无法检出。
溶剂提取物得率/%总酚含量/(mg GAE/g)总黄酮含量/(mg QE/g)花青素含量/(mg c-3-gE/100 g)水37.13±1.60d14.23±0.18f0.38±0.06a51.80±2.29c甲醇22.68±0.50c13.80±0.14f5.68±0.35d15.10±3.86a乙醇10.02±0.38b5.88±0.14e4.40±0.38c23.01±0.44b丙酮7.71±0.70ab4.43±0.36d4.10±0.32c71.82±4.68d正丁醇8.12±0.06ab2.93±0.23c2.59±0.33b8.62±5.08a乙酸乙酯5.42± 0.48a0.46±0.09b2.81±0.08bnd氯仿6.10±0.93ab0.19±0.08andnd
由表1可知,不同溶剂提取物得率、总酚、总黄酮和花青素含量差别很大。水提物具有最高的粗提物得率(37.13%),其次是甲醇提取物(22.68%),丙酮、正丁醇和氯仿的粗提物得率不存在显著性差异(P>0.05),乙酸乙酯的粗提物得率最低(5.42%)。总体上来说,随着提取溶剂极性的降低,粗提物的得率呈下降趋势。提取率的差异可能是因为红薯叶化学成分中极性物质(多糖、蛋白质)含量较高,导致其在不同溶剂中的溶解性不同[17]。Mohdaly等[18]研究了土豆皮不同溶剂提取物的抗氧化活性,结果发现粗提物得率也随提取溶剂极性的降低而呈下降趋势。
不同溶剂提取物中总酚含量的大小顺序为:水=甲醇>乙醇>丙酮>正丁醇>乙酸乙酯>氯仿,水和甲醇提物中含有最高的总酚含量,分别为14.23、13.80 mg GAE/g,氯仿提取物中总酚含量最低(0.19 mg GAE/g)。比较不同溶剂对红薯叶多酚的提取效果发现,总酚含量与提取物得率有着类似的变化规律。提取溶剂极性强,总酚得率高,如水和甲醇极性强,其提取液总酚得率高,而非极性溶剂总酚得率最低,因此更适合在提取多酚前除去红薯叶粉末中的脂类。大量研究表明提取溶剂的极性对植物多酚提取效率有较大影响。刘曦等[19]研究了蓝莓叶不同极性溶剂(水、甲醇、乙醇、乙酸乙酯、氯仿、石油醚)提取物抗 氧化活性,发现水提物总酚含量最高,其次为甲醇提取物,石油醚和氯仿提取物总酚含量最低,而董怡等[20]研究了溪黄草根不同溶剂(蒸馏水、60%乙醇、无水乙醇、甲醇、丁醇、乙酸乙酯和氯仿)提取物抗氧化活性,发现以60%乙醇为提取溶剂时总酚含量最高,其次为丁醇提取物、甲醇提取物,水提物和氯仿提取物较低,可见提取溶剂的极性对植物多酚的提取效果影响较大,但由于不同植物的化学组成存在差异,影响不尽相同,因此在提取植物多酚时选择合适的提取溶剂非常重要。
不同溶剂提取物中,总黄酮含量最高的是甲醇提取液(5.68 mg QE/g),其次是丙酮和乙醇,二者的总黄酮含量无显著性差异(P>0.05),最小的是氯仿,在提取液中未检测到黄酮。溶剂类型对花青素的提取效率表现出与粗提物、总酚和总黄酮不同的规律,丙酮提取液具有最高的花青素含量(71.82 mg c-3-gE/100 g),其次为水(51.80 mg c-3-gE/100 g),乙酸乙酯和氯仿提取物中未检测到花青素。本实验发现丙酮对花青素具有较高的提取效率,说明红薯叶中的花青素在丙酮溶液中有较好的溶解性,周玮婧等[21]研究了荔枝皮原花青素提取工艺,也发现丙酮比乙醇和甲醇具有更高的花青素提取得率。
2.2 DPPH自由基清除能力
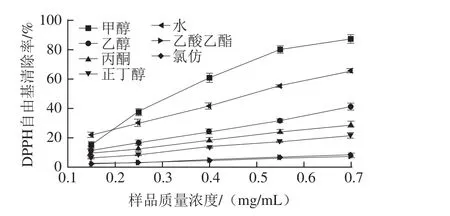
图1 红薯叶不同溶剂提取物对DPPH自由基的清除能力Fig.1 DPPH radical scavenging activity of various solvent extracts from sweet potato leaves
由图1可知,除乙酸乙酯和氯仿外,提取物对DPPH自由基均有一定的清除能力,且与DPPH自由基清除能力呈现量效关系。不同溶剂提取物对DPPH自由基的清除能力与总酚的变化规律类似,甲醇提取液具有最高的DPPH自由基清除能力,其IC50值为0.32 mg/mL,其次为水提液(0.50 mg/mL),极性较小的氯仿和乙酸乙酯提取液的DPPH自由基清除能力最弱,在测定质量浓度范围内(0.15~0.70 mg/mL),其DPPH自由基清除率变化范围为1.26%~8.01%,因此,甲醇可用于提取红薯叶中的自由基清除剂。另外,相关性分析表明,总酚、总黄酮和花青素含量与DPPH自由基清除能力的相关性系数分别为0.955、0.432和0.277(表2),酚类化合物对提取物的自由基清除能力的贡献最大。由此可推断,红薯叶提取物中的DPPH自由基的清除剂主要为酚类化合物。
2.3 还原能力
如图2所示,样品的还原能力与DPPH自由基清除能力以及总酚含量变化趋势一致,提取溶剂的极性对提取物的还原能力影响显著(P<0.05)。除氯仿提取物外,随样品质量浓度的增加,提取物的还原能力逐渐增强,具有明显的量效关系(P<0.05)。当样品质量浓度为1.4 mg/mL时,提取液的还原能力大小顺序为:甲醇>水>乙醇>丙酮>正丁醇>乙酸乙酯>氯仿。甲醇提取液具有最强的还原能力,其ρ0.5值为0.95 mg/mL,水提液次之(ρ0.5值为1.35 mg/mL),氯仿和乙酸乙酯提取物还原力很弱,在测定质量浓度范围内(0.2~2.0 mg/mL),反应体系在700 nm波长处的吸光度分别为0.004~0.153和0.068~0.148。相关性分析表明,酚类化合物与还原能力具有最强的相关性,Pearson’s相关系数为0.941(表2),总黄酮和花青素类化合物与还原能力弱相关,相关系数分别为0.413和0.419。由此可推测,酚类化合物是红薯叶提取物中的主要还原剂。

图2 红薯叶不同溶剂提取物的还原能力Fig.2 Reducing power of various solvent extracts from sweet potato leaves
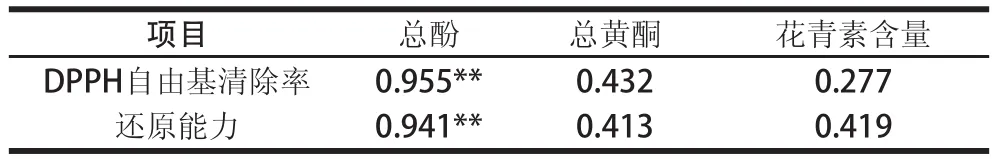
表2 红薯叶不同溶剂提取物(0.40 mg/mL)总酚、总黄酮和花青素含量与抗氧化活性的相关性Table2 Pearson s correlation coefficients of antioxidant activities with the contents of total phenolics, total flavonoids and anthocyanins ofextracts from sweet potato leaves
结合2.2节中的结果可知,红薯叶提取物中总酚含量的多少直接反映提取物抗氧化能力的强弱,多酚对红薯叶提取物抗氧化活性贡献最大,已有大量的研究表明多酚类化合物含量与天然植物提取物抗氧化活性具有显著的相关性[22-23]。
2.4 HPLC-MS/MS分析
图3为红薯叶甲醇提取液的基峰色谱图和320 nm波长处紫外光谱图,根据母离子峰、碎片离子、保留时间及紫外光谱图等信息,结合可利用标准品及参考文献的报道,共鉴定9种、初步鉴定3种主要的多酚类化合物(表3)。
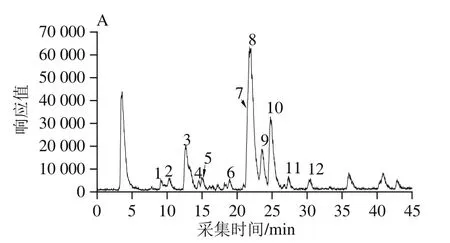

表3 红薯叶甲醇提取物HPLC-MS/MS分析结果Table3 HPLC-MS results of methanol extract of sweet potato leaves
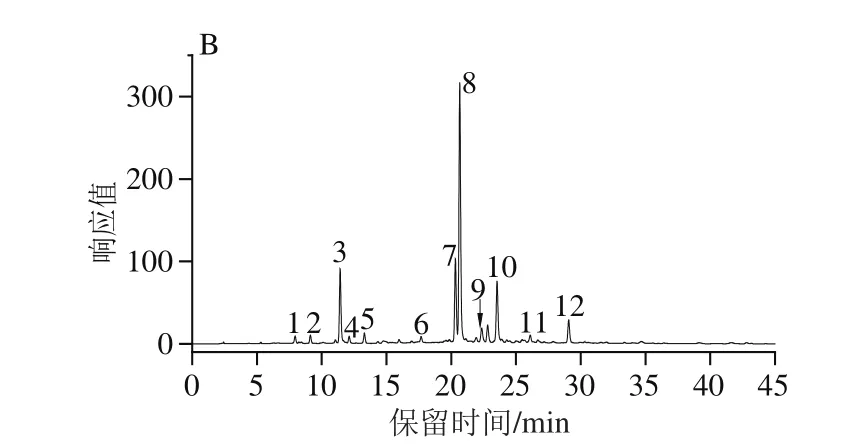
图3 红薯叶甲醇提取物的负离子模式基峰图和320 nm波长处紫外光谱图Fig.3 Base peak chromatogram and UV spectrum at 320 nm of methanol extract of sweet potato leaves
由图3、表3可知,化合物1和3的紫外光谱图在240 nm附近和320 nm处有一个强吸收,298 nm处有个肩峰,属于羟基肉桂酸类化合物的特征紫外图谱[24]。化合物1和3的母离子和主要MS/MS碎片离子均为[M-H]-m/z353.09和191.06,通过Masshunter的分子式计算器得到它们的分子式分别为C16H18O9和C7H12O6对应的离子片段分别为[CQA-H]-和[奎尼酸-H]-,通过与标准品比对母离子和保留时间,化合物3鉴定为3-CQA,Lin Longze等[25]报道单取代咖啡酰奎宁酸的出峰顺序为1-CQA>3-CQA>4-CQA>5-CQA,因此化合物1鉴定为1-CQA。
化合物2([M-H]-,C15H18O9)的紫外图谱表明其为羟基肉桂酸类化合物。MS/MS特征碎片离子179.036 1为母离子中性损失一个己糖产生(-162 D),对应的C9H8O4分子式表明该碎片为咖啡酸。碎片离子161.025 3和135.045 9分别为咖啡酸失去一分子H2O和CO2产生,以上表明化合物2为咖啡酰己糖苷。
化合物4([M-H]-,137.024 5,C7H6O3)初步推断为羟基苯甲酸。MS/MS碎片119.015 1、109.027 7和93.029 4分别为母离子失去一个H2O,CO和CO2产生,表明该化合物中存在羧基,根据参考文献[26]化合物4鉴定为对羟基苯甲酸。
化合物6、9、10的紫外特征吸收相似,且MS/MS色谱中都存在301.035 9(Y0-)和300.026 3([Y0-H]-)的主要碎片离子,Fabre等[27]表明,在黄酮苷类化合物的MS/MS图谱中,若同时存在Y0-和[Y0-H]-片段,则表明糖连接在3-OH位。因此,这三个化合物鉴定为槲皮素-3-O-糖苷。化合物6的母离子[M-H]-m/z为625.143 2,苷元离子(Y0-)对应于母离子中性损失2个六碳糖(-324 D);化合物9、10的母离子[M-H]-m/z均为463.090 4,表明化合物为己糖糖基化,通过与金丝桃苷比较保留时间和母离子,化合物9鉴定为金丝桃苷,化合物6、10分别鉴定为槲皮素-3-O-二己糖苷和槲皮素-3-O-己糖苷。
化合物7、8、11具有相似的紫外图谱、母离子[M-H]-和MS/MS裂解图谱。根据参考文献,它们被鉴定为diCQA的同分异构体。MS/MS碎片353.090 4、191.056 2、179.035 6、173.046 0、161.025 0、155.034 7、135.045 9对应于的离子片段为[咖啡酰奎宁酸-H]-、[奎宁酸-H]-、[咖啡酸-H]-、[奎宁酸-H2O-H]-、[咖啡酸-H2O-H]-、[奎宁酸-2H2O-H]-、[咖啡酸-CO2-H]-。通过与3,4-diCQA、3,5-diCQA和4,5-diCQA的匹对,化合物7、8、11分别鉴定为3,4-diCQA、3,5-diCQA、4,5-diCQA。同理,化合物12鉴定为3,4,5-三咖啡酰奎宁酸(3,4,5-tricaffeoylquinic acid,3,4,5-triCQA)。Carvalho[28]和Luo Chunying[29]等都在红薯叶中报道过这些化合物。
由上可知,红薯叶甲醇提取液中主要的酚类化合物为1-CQA、3-CQA、3,4-diCQA、3,5-diCQA、4,5-diCQA、3,4,5-triCQA、咖啡酸、咖啡酰己糖苷、对羟基苯甲酸、槲皮素-3-O-二己糖苷、槲皮素-3-O-己糖苷和金丝桃苷。
3 结 论
提取溶剂的极性对红薯叶中多酚类化合物的提取效率和提取物抗氧化活性有很大影响。不同溶剂提取物总酚含量与抗氧化性具有显著的相关性(P<0.01)。在测试溶剂中,甲醇提取物总酚含量(13.80 mg GAE/g)和总黄酮含量(5.68 mg QE/g)最高,且具有最好的DPPH自由基清除能力(IC50=0.32 mg/mL)与还原能力(ρ0.5=0.95 mg/mL),因此甲醇是提取红薯叶中多酚类化合物的适宜溶剂。
通过HPLC-MS/MS技术,从红薯叶甲醇提取物中鉴定出12个主要酚类化合物,包括1-CQA、3-CQA、咖啡酸、对羟基苯甲酸、咖啡酰己糖苷、3,4-diCQA、3,5-diCQA、4,5-diCQA、槲皮素-3-O-二己糖苷、槲皮素-3-O-己糖苷、金丝桃苷和3,4,5-triCQA,基峰图显示3,4-diCQA、3,5-diCQA具有最高的相对含量。这为进一步研究红薯叶中的酚类物质提供了一定的理论基础,对红薯叶中活性成分的开发与利用也具有参考意义。
[1] SUN Hongnan, MU Taihua, XI Lisha, et al. Sweet potato (Ipomoea batatas L.) leaves as nutritional and functional foods[J]. Food Chemistry, 2014, 156(1)∶ 380-389.
[2] 李昌文. 红薯及红薯叶综合利用及深加工技术[J]. 农业工程技术∶农产品加工业, 2008, 1(2)∶ 18-20.
[3] ISHIDA H, SUZUNO H, SUGIYAMA N, et al. Nutritive evaluation on chemical components of leaves, stalks and stems of sweet potatoes (Ipomoea batatas poir)[J]. Food Chemistry, 2000, 68(3)∶ 359-367.
[4] HUANG Xiaoqin, TU Zongcai, XIAO Hui, et al. Dynamic high pressure microfluidization-assisted extraction and antioxidant activities of sweet potato (Ipomoea batatas L.) leaves flavonoid[J]. Food and Bioproducts Processing, 2013, 91(1)∶ 1-6.
[5] SUN Hongnan, MU Taihua, XI Lisha, et al. Effects of domestic cooking methods on polyphenols and antioxidant activity of sweet potato leaves[J]. Journal of Agricultural and Food Chemistry, 2014, 62(36)∶ 8982-8989.
[6] 李群梅, 杨昌鹏, 李健, 等. 植物多酚提取与分离方法的研究进展[J].保鲜与加工, 2010, 10(1)∶ 16-19.
[7] 段红星, 周春娥, 李家华. 不同溶剂对普洱茶(熟茶)茶多酚提取的影响研究[J]. 云南农业大学学报, 2014, 29(2)∶ 246-250.
[8] BOULEKBACHE-MAKHLOUF L, MEDOUNI L, MEDOUNIADRAR S, et al. Effect of solvents extraction on phenolic content and antioxidant activity of the byproduct of eggplant[J]. Industrial Crops and Products, 2013, 49(1)∶ 668-674.
[9] 陆健, 樊伟, 孔维宝, 等. 大麦总多酚不同溶剂提取物对DPPH自由基清除能力的影响[J]. 食品与生物技术学报, 2008, 27(1)∶ 57-61.
[10] SINGH M, JHA A, KUMAR A, et al. Influence of the solvents on the extraction of major phenolic compounds (punicalagin, ellagic acid and gallic acid) and their antioxidant activities in pomegranate aril[J]. Journal of Food Science and Technology, 2014, 51(9)∶ 2070-2077.
[11] TRUONG V D, MCFEETERS R, THOMPSON R, et al. Phenolic acid content and composition in leaves and roots of common commercial sweet potato (Ipomea batatas L.) cultivars in the United States[J]. Journal of Food Science, 2007, 72(6)∶ C343-C349.
[12] MADHAVA NAIDU M, SHYAMALA B N, PURA NAIK J, et al. Chemical composition and antioxidant activity of the husk and endosperm of fenugreek seeds[J]. LWT-Food Science and Technology, 2011, 44(2)∶ 451-456.
[13] QUETTIER-DELEU C, GRESSIER B, VASSEUR J, et al. Phenolic compounds and antioxidant activities of buckwheat (Fagopyrum esculentum Moench) hulls and flour[J]. Journal of Ethnopharmacology, 2000, 72(1/2)∶ 35-42.
[14] SHAO Yafang, XU Feifei, SUN Xiao, et al. Phenolic acids, anthocyanins, and antioxidant capacity in rice (Oryza sativa L.) grains at four stages of development after flowering[J]. Food Chemistry, 2014, 143(15)∶ 90-96.
[15] SALTARELLI R, CECCAROLI P, IOTTI M, et al. Biochemical characterisation and antioxidant activity of mycelium of Ganoderma lucidum from Central Italy[J]. Food Chemistry, 2009, 116(1)∶ 143-151.
[16] ZOVKO KONČIĆ M, KREMER D, GRUZ J, et al. Antioxidant and antimicrobial properties of Moltkia petraea(Tratt.) Griseb. flower, leaf and stem infusions[J]. Food and Chemical Toxicology, 2010, 48(6)∶1537-1542.
[17] LÓPEZ A, RICO M, RIVERO A, et al. The effects of solvents on the phenolic contents and ant ioxidant activity of Stypocaulon scoparium algae extracts[J]. Food Chemistry, 2011, 125(3)∶ 1104-1109.
[18] MOHDALY A A, SARHAN M A, SMETANSKA I, et al. Antioxidant properties of various solvent extracts of potato peel, sugar beet pulp and sesame cake[J]. Journal of the Science of Food and Agriculture, 2010, 90(2)∶ 218-226.
[19] 刘曦, 祝连彩, 王伯初. 蓝莓叶不同溶剂提取物抗氧化活性研究[J].食品工业科技, 2013, 34(12)∶ 101-105.
[20] 董怡, 林恋竹, 赵谋明. 溪黄草根不同溶剂提取物的抗氧化性[J]. 食品科学, 2011, 32(15)∶ 39-42.
[21] 周玮婧, 孙智达, 谢笔钧, 等. 荔枝皮原花青素提取工艺优化[J]. 农业工程学报, 2009, 25(1)∶ 175-179.
[22] SOCHA R, JUSZCZAK L, PIETRZYK S, et al. Antioxidant activity and phenolic composition of herbhoneys[J]. Food Chemistry, 2009, 113(2)∶ 568-574.
[23] 段江莲, 李为琴, 张梅庆, 等. 高粱米不同溶剂提取物的抗氧化活性研究[J]. 中国粮油学报, 2009, 28(6)∶ 36-39.
[24] GOUVEIA S C, CASTILHO P C. Validation of a HPLC-DAD-ESI/ MSnmethod for caffeoylquinic acids separation, quantification and identification in medicinal Helichrysum species from Macaronesia[J]. Food Research International, 2012, 45(1)∶ 362-368.
[25] LIN Longze, HARNLY J M. Identification of hydroxycinnamoylquinic acids of arnica flowers and burdock roots using a standardized LCDAD-ESI/MS profiling method[J]. Journal of Agricultural and Food Chemistry, 2008, 56(21)∶ 10105-10114.
[26] KAMMERER D, CLAUS A, CARLE R, et al. Polyphenol screening of pomace from red and white grape varieties (Vitis vinifera L.) by HPLC-DAD-MS/MS[J]. Journal of Agricultural and Food Chemistry, 2004, 52(14)∶ 4360-4367.
[27] FABRE N, RUSTAN I, de HOFFMANN E, et al. Dete rmination of flavone, flavonol, and flavanone aglycones by negative ion liquid chromatography electrospray ion trap mass spectrometry[J]. Journal of the American Society for Mass Spectrometry, 2001, 12(6)∶ 707-715.
[28] CARVALHO I S, CAVACO T, CARVALHO L M, et al. Effect of photoperiod on flavonoid pathway activity in sweet potato (Ipomoea batatas (L.) Lam.) leaves[J]. Food Chemistry, 2010, 118(2)∶ 384-390.
[29] LUO Chunying, WANG Xixi, GAO Ge, et al. Identification and quantification of free, conjugate and total phenolic compounds in leaves of 20 sweetpotato cultivars by HPLC-DAD and HPLC-ESI-MS/ MS[J]. Food Chemistry, 2013, 141(3)∶ 2697-2706.
Comparison of Antioxidant Activities of Various Solvent Extracts of Sweet Potato (Ipomoea batatas(L.) Lam.) Leaves and Identification of Antioxidant Constituents of the Merthanol Extract
TU Zongcai1,2, FU Zhifeng1, WANG Hui1, ZHANG Lu1, WEN Qinghui1, LI Jinlin2, DUAN Dengle1, LI Ruyi1
(1. State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Nanchang University,Nanchang 330047, China; 2. College of Life Science, Jiangxi Normal University, Nanchang 330022, China)
This study aimed to investigate the effects of solvents with different polarities on the extraction of phenolic compounds from sweet potato leaves, to compare antioxidant activities of the extracts, and to identify the main antioxidants of the extract with the highest antioxidant activity. Seven solvents, namely distilled water, methanol, ethanol, acetone,n-butanol, ethyl acetate and chloroform, were used to extract polyphenols from sweet potato leaves. The contents of total phenolics, total flavonoids and anthocyanins, as well asin vitroantioxidant activities of these extracts were compared. The major antioxidant compounds in the extract with the highest antioxidant activity were identified by high performance liquid chromatography tandem mass spectroscopy (HPLC-MS/MS). Results indicated that solvent polarity had a substantial influence on the extraction efficiency of polyphenols from sweet potato leaves and the antioxidant activities of the extracts. The water extract had the highest crude extract yield of (37.13±1.60)%, but the highest total phenolic content (13.80 mg GAE/g) and total flavonoid content ((5.68±0.35) mg QE/g) were observed in the methanol extract and it exhibited the strongest DPPH (1,1-diphenyl-2-picryl-hydrazyl-hydrate) radical scavenging activity with IC50value of 0.32 mg/mL and reducing power ofρ0.5value of 0.95 mg/mL. A total of 9 phenolic compounds, namely caffeic acid, chlorogenic acid, 3,4-dicaffeoylquinic acid, 3,5-dicaffeoylquinic acid, 4,5-dicaffeoylquinic acid and 3,4,5-tricaffeoylquinic acid, were identified from the methanol extract, including 3 phenolic compounds.
sweet potato leaves; polyphenols; solvent extraction; antioxidant activities; HPLC-MS/MS
TS201.4
1002-6630(2015)17-0001-06
10.7506/spkx1002-6630-201517001
2014-10-16
国家自然科学基金面上项目(21276118)
涂宗财(1965—),男,教授,博士,研究方向为食物资源开发与高效利用。E-mail:tuzc_mail@aliyun.com

