绿航绿萝和金边吊兰对铅胁迫的生理响应
朱红霞,张家洋*,张 统
(1.新乡学院 生命科学技术学院,河南 新乡453003,2.河南大学 生命科学学院,河南 开封475001)
重金属污染是全球性、公众普遍关注的重要的环境问题之一。由于矿产开发、废气排放、污水灌溉及含铅制品的使用,导致环境中铅的含量显著升高。铅是植物的非必需元素,低浓度的铅处理能够促进植物正常的生理代谢活动,如茎叶内硝酸还原酶活性、可溶性糖的含量、叶绿素的含量均有不同程度的增加[1],但高浓度的铅使植物体内的代谢过程发生紊乱,甚至导致植物死亡[2]。关于植物的抗铅污染研究,大多集中于铅对植物形态、生理生化效应等方面,且主要以农作物为研究对象[3-5]。本研究以绿航绿萝(Scindapsus aureum)和金边吊兰(Chlorophytum comosum)2种具有较高观赏价值的景观绿化植物为试验材料,通过铅胁迫下对其生理指标影响进行分析,综合评定绿航绿萝和金边吊兰抗铅胁迫能力的强弱,为探寻植物的生理抗性和受铅污染的土壤恢复提供理论依据。
1 材料与方法
1.1 试验材料
供试植物选取长势基本一致的绿航绿萝和金边吊兰,均采购于新乡市花卉市场,盆栽土壤全铅含量为0。重金属添加形式:Pb(NO3)2,为分析纯试剂。
1.2 试验方法
采用盆栽试验,Pb2+浓度设置5个处理梯度,分别为20、40、80、160、320mg·L-1,同时用去离子水作对照(CK),每处理重复3次。每天9:00对植物叶片喷施30mL的Pb(NO3)2溶液,分别于第7天和第14天取植物相同部位叶子测定各项生理生化指标。
1.3 生理指标的测定方法
可溶性糖含量采用蒽酮比色法进行测定[6],脯氨酸含量的测定采用茚三酮法[7],可溶性蛋白的测定采用考马斯亮蓝法[8],丙二醛含量的测定采用硫代巴比妥酸法[9],叶绿素含量的测定采用丙酮提取法[10]。
用于分析的数据均为3次重复的平均值,采用Excel整理数据,同时采用模糊数学中的隶属函数法对绿航绿萝和金边吊兰的抗铅胁迫能力强弱进行综合评定。
1.4 抗铅污染的综合评价方法
用模糊数学中的隶属函数法对绿航绿萝和金边吊兰的抗铅污染能力进行综合评价[11-14]。用灰色系统理论中的灰色关联分析法确定各项生理指标与绿航绿萝和金边吊兰抗铅污染的关系,关联度越大,说明这个指标与抗铅污染的关系越密切[13-14]。
1.4.1 隶属函数法 隶属函数法是目前应用比较广泛的数学评定方法,根据模糊数学的原理,利用隶属函数进行综合评价。先求出各生理指标的具体隶属函数值[13-14],然后对各隶属函数值进行加权累加,求其加权平均值,得出综合评估的指标值[15]。隶属函数值法的基本计算方法如下:
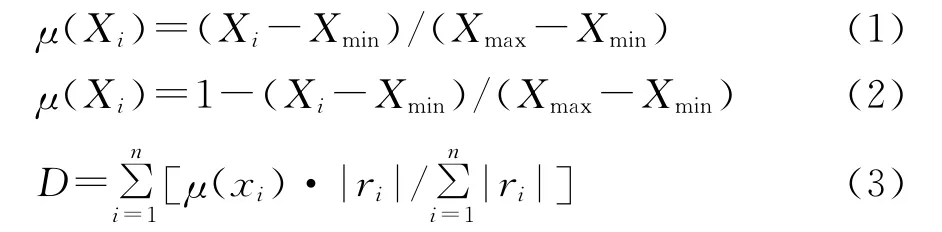
式中,Xi为指标i的测定值,Xmin和Xmax分别为绿航绿萝和金边吊兰两种植物某一指标的最小值和最大值;μ(Xi)为指标Xi的隶属函数值。如果所测指标与抗铅污染呈正相关用式(1),负相关则用式(2),将每种植物树种各指标的抗铅污染能力隶属函数值用式(3)计算出的加权平均值,加权平均值越大,抗铅污染能力就越强。
1.4.2 灰色关联度分析 将绿航绿萝和金边吊兰2种植物抗铅污染指标的平均隶属值作为参考数据列,记为X0;以各个抗铅污染指标的平均数为比较数列,记为X1,X2,…,X5,分别代表可溶性糖,游离脯氨酸,…,总叶绿素。用如下公式对比较数列进行量纲为1的标准化处理:X′i(k)=(Xi(k)-X)/Si式中:Xi(k)为原始数据;X′i(k)为原始数据标准化后的结果;X和Si分别为同一指标的平均值和标准差。

式中,εi(k)为关联系数,ri为灰色关联度;△i(k)=│X0(k)-Xi(k)│,表示X0数列与Xi数列在第k点的绝对值;minminΔi(k)为二级最小差,maxmaxΔi(k)为二级最大差;ρ为分辨系数,取值范围为0~1,文中试验取值0.5[13-15]。
权重计算公式:

1.5 数据处理
采用Excel 2003和SSPS13.0进行数据处理。
2 结果与分析
2.1 铅胁迫下绿航绿萝和金边吊兰叶片可溶性糖含量的变化
可溶性糖作为渗透调节物质可以使细胞得到保护,免受伤害,使植物维持原有的生理过程,以适应外界条件的变化[16],因此可溶性糖可以作为生理指标之一来反映重金属污染对植物的毒害作用。
从表1可看出,绿航绿萝叶片在Pb2+胁迫7d时可溶性糖含量在不同铅浓度处理下均明显高于对照,且随着铅处理浓度的增加呈现先上升后下降的趋势,Pb2+浓度为20、40mg·L-1时,可溶性糖含量逐渐增加,40mg·L-1时达到最大值23 574.60 μg·g-1,比对照增加403%。但当Pb2+浓度>40 mg·L-1时,随着铅浓度的增大可溶性糖的含量开始下降。铅胁迫14d时取样测定时可溶性糖的含量在Pb2+处理浓度为20~80mg·L-1时含量逐渐增加,80mg·L-1时达到最大值16 686.34μg·g-1,比对照增加298%。当Pb2+浓度>80mg·L-1时,随着铅处理浓度的增大可溶性糖的含量开始下降。铅胁迫14d取样测定时的含量均低于第7天测定时的值,说明随着处理时间的延长绿航绿萝抗铅污染能力呈现出逐渐减弱的趋势。
铅胁迫7d和14d时,金边吊兰叶片可溶性糖含量在不同Pb2+浓度处理下均明显高于对照,且随着铅处理浓度的增加呈递增趋势,最大增幅分别为498%、543%。第14天测定时可溶性糖的含量均高于第7天测定时的值,说明随着处理时间的延长绿航绿萝抗铅污染能力呈现出逐渐增强的趋势。
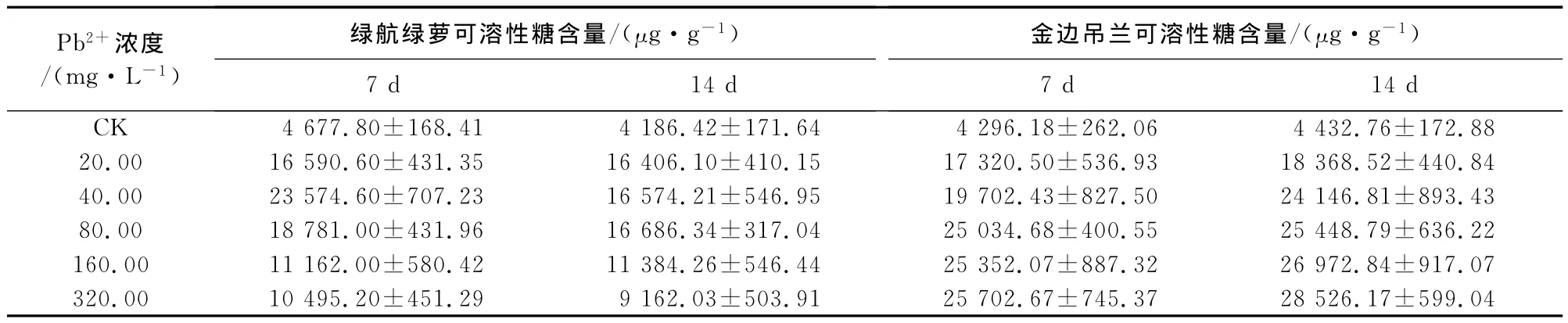
表1 铅胁迫下绿航绿萝和金边吊兰叶片可溶性糖含量的变化Table 1 Variation of soluble sugar content of S.aureus and C.comosumunder Pb2+stress
2.2 铅胁迫下绿航绿萝和金边吊兰叶片游离脯氨酸含量的变化
游离脯氨酸是植物蛋白质的重要组成,其含量的变化反映植物对逆境条件的适应能力,因此游离脯氨酸可以作为鉴定植物相对抗性的指标之一[17]。
从表2可看出,铅胁迫7d和14d时,绿航绿萝和金边吊兰叶片游离脯氨酸含量在不同Pb2+浓度处理下均高于对照,且随着铅处理浓度的增加呈现递增趋势,Pb2+浓度>80mg·L-1时,游离脯氨酸含量增加幅度增大。第14天取样测定时游离脯氨酸含量均高于第7天测定时的值,且7d时,金边吊兰游离脯氨酸含量高于绿航绿萝,而14d时,金边吊兰游离脯氨酸含量低于绿航绿萝。

表2 铅胁迫下绿航绿萝和金边吊兰叶片游离脯氨酸含量的变化Table 2 Variation of proline content of S.aureus and C.comosumunder Pb2+stress
2.3 铅胁迫下绿航绿萝和金边吊兰叶片可溶性蛋白含量的变化
重金属胁迫能够造成植物碳水化合物合成代谢、氮素代谢等的紊乱,进而影响可溶性蛋白的含量[18]。可溶性蛋白是植物体内重要的渗透调节物质,其含量的变化不仅与抗逆性的形成有关,而且是反映叶片功能及衰老的重要指标之一[19]。从表3可知,绿航绿萝铅胁迫7d时叶片可溶性蛋白表现出下降趋势,在Pb2+浓度为20mg·L-1时,叶片中可溶性蛋白含量达到最大值15.79μg·g-1,比对照增加54.7%,之后随着铅处理浓度的增加而逐渐下降,铅处理浓度为20~40mg·L-1时明显高于对照,>40mg·L-1时低于对照;在铅胁迫14d时,不同铅处理浓度下可溶性蛋白含量均明显高于对照,Pb2+浓度>40mg·L-1时,变化趋势不明显。铅胁迫7d和14d时金边吊兰叶片可溶性蛋白含量在不同铅处理浓度下均低于对照,且随着铅处理浓度的增加呈递减趋势。
在相同铅处理条件下,从2种植物叶片可溶性蛋白含量的多少及变化趋势来看,金边吊兰叶片中可溶性蛋白含量低于绿航绿萝。
2.4 铅胁迫下绿航绿萝和金边吊兰叶片丙二醛含量的变化
逆境胁迫下植物器官往往发生膜脂过氧化作用,丙二醛是其产物之一,丙二醛含量反映了细胞膜脂过氧化程度,是植物膜系统受伤害的重要指标之一[20]。从表4可知,绿航绿萝和金边吊兰叶片丙二醛含量在不同Pb2+浓度下均高于对照,处理浓度为320mg·L-1时明显高于对照。但随着铅处理浓度的增加和铅胁迫时间的延长变化趋势不明显,表现出一定程度的上下浮动。相同铅处理条件下,绿航绿萝叶片中丙二醛含量与金边吊兰差别不大。

表3 铅胁迫下绿航绿萝和金边吊兰叶片可溶性蛋白含量的变化Table 3 Variation of soluble protein econtent of S.aureus and C.comosumunder Pb2+stress

表4 铅胁迫下绿航绿萝和金边吊兰叶片丙二醛含量的变化Table 4 Variation of malondialdehyde econtent of S.aureus and C.comosumunder Pb2+stress
2.5 铅胁迫下绿航绿萝和金边吊兰叶片叶绿素含量的变化
叶绿素是植物的光合色素,其含量的变化直接影响着植物的光和作用[21]。从表5可看出,铅胁迫7d时,绿航绿萝叶片叶绿素a、叶绿素b及总叶绿素含量在不同Pb2+浓度下均低于对照,且随着铅处理浓度的增加呈现先下降后上升的趋势。绿航绿萝叶片叶绿素a、叶绿素b及总叶绿素含量在Pb2+浓度为20~40mg·L-1时呈降低趋势,40mg·L-1时分别达到最小值3.59、0.844mg·g-1和5.13 mg·g-1,比对照相应降低31%、38%、32%,之后随着铅处理浓度的增大逐渐上升。铅胁迫14d时,绿航绿萝叶片叶绿素a、叶绿素b及总叶绿素含量在不同Pb2+浓度处理下均高于对照,且随着铅处理浓度的增加呈上升趋势,上升趋势非常明显,在320 mg·L-1时分别达到最大值3.144、0、632mg·g-1和4.307mg·g-1,相应的比对照增加286%、126%、225%。从胁迫时间来看,铅胁迫14d与铅胁迫7d相比绿航绿萝叶片中叶绿素a、叶绿素b及总叶绿素含量明显降低。

表5 铅胁迫下绿航绿萝叶片的叶绿素含量的变化Table 5 Variation of chlorophyll econtent of S.aureus under Pb2+stress
从表6可看出,铅胁迫7d时,金边吊兰叶片叶绿素a、叶绿素b及总叶绿素含量在不同Pb2+浓度处理下均低于对照,且随着铅处理浓度的增加呈现先下降后上升的趋势。金边吊兰叶片中叶绿素a含量在Pb2+浓度20~40mg·L-1时呈降低趋势,40 mg·L-1时达到最小值2.28mg·g-1,比对照降低50%,之后随着铅处理浓度的增大逐渐上升。叶绿素b和总叶绿素含量的变化与叶绿素a相似,在Pb2+浓度20~80mg·L-1时呈降低趋势,80mg·L-1、40mg·L-1时分别达到最小值0.409mg·g-1和3.916mg·g-1,比对照相应降低45%和35%。铅胁迫14d时与胁迫7d时变化趋势一致,金边吊兰叶片叶绿素a、叶绿素b及总叶绿素含量在不同铅处理浓度下均低于对照,且随着铅处理浓度的增加呈先下降后上升趋势,在160mg·L-1时分别达到最小值,相应的比对照减少39%、61%、44%。从胁迫时间来看,铅胁迫7d与铅胁迫14d相比金边吊兰叶片中叶绿素a、叶绿素b及总叶绿素含量总体上有所降低。
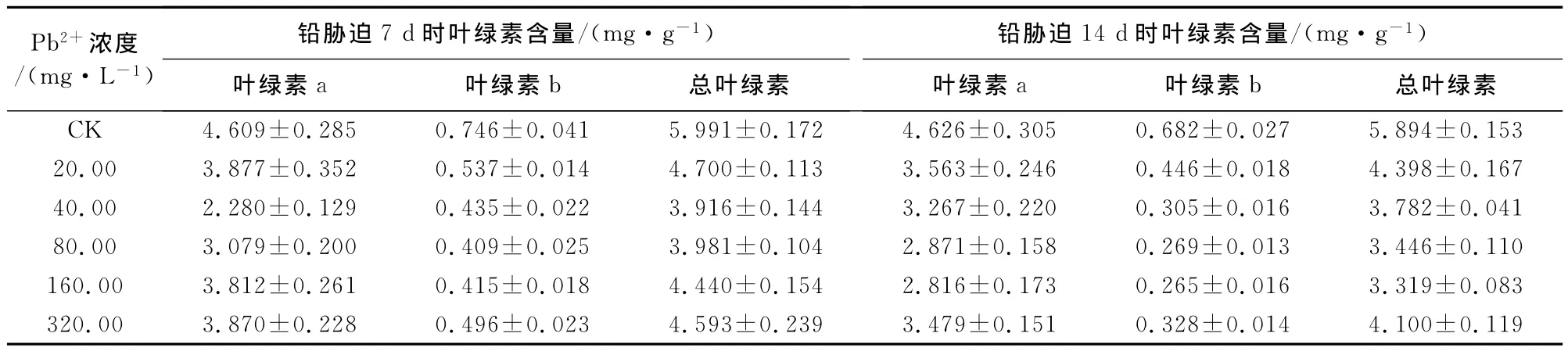
表6 铅胁迫下金边吊兰叶片的叶绿素含量的变化Table 6 Variation of chlorophyll econtents of C.comosumunder Pb2+stress
比较表5和表6可知,从胁迫时间来看,在相同铅处理浓度下,7d时,绿航绿萝叶片中叶绿素a、叶绿素b及总叶绿素含量高于金边吊兰,而14d时,绿航绿萝叶片中叶绿素a、叶绿素b及总叶绿素含量低于金边吊兰,说明随着铅胁迫时间的延长,金边吊兰抗重金属铅的能力优于绿航绿萝。
2.6 绿航绿萝和金边吊兰抗铅胁迫能力的综合评判
利用模糊数学的隶属函数法对金边吊兰和绿航绿萝的抗铅污染能力进行综合评价,隶属函数的加权平均值的累加均值越大,抗铅污染能力越强。结果如表7所示,绿航绿萝为0.096,金边吊兰为0.113,金边吊兰的抗铅污染能力优于绿航绿萝。将各项指标与平均隶属值的关联度与权重进行计算,结果如表8所示,游离的脯氨酸和可溶性糖的关联度在0.7以上,与金边吊兰和绿航绿萝的抗铅污染能力关联性最强;可溶性蛋白和丙二醛关联度在0.6~0.7之间,关联性次之;总叶绿素关联度在0.6以下,关联性最差。
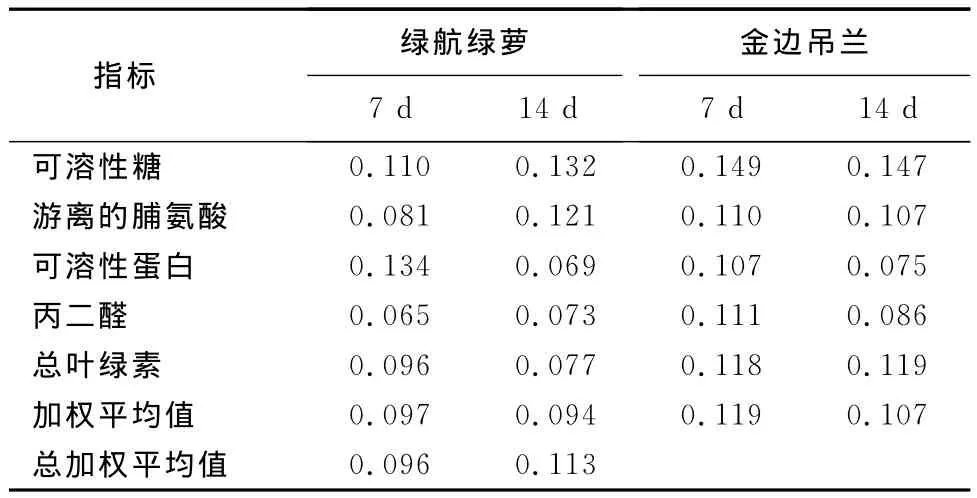
表7 铅胁迫下各指标的隶属函数加权值和综合评判结果Table 7 Subordinate function value and comprehensive evaluation results of each index of Pb stress
3 结论与讨论
绿航绿萝和金边吊兰作为景观绿化植物具有净化空气,抗重金属污染,改善城市环境等多种功能。在植物抗重金属铅污染方面,王艳[20]等研究刺槐和紫穗槐,凤仙花和万寿菊铅胁迫时得出了不同植物对抗铅污染能力存在差异的结论,同时植物的各种生理指标对抗铅污染能力的也具有一定的相关性,本试验的研究结果与此一致。
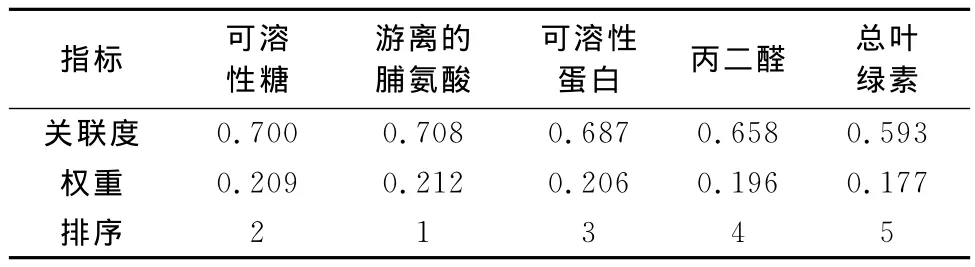
表8 绿航绿萝和金边吊兰5项抗铅胁迫指标的关联度及权重Table 8 The grey correlative degree and weight of five Pb stress resistance indexe of S.aureus and C.comosum
逆境胁迫下植物体内的可溶性糖含量会增加,以减少不利因素对植物的伤害。本试验中绿航绿萝和金边吊兰2种植物可溶性糖含量随着铅处理时间的延长和铅处理浓度的升高均高于对照,说明2种植物都表现出了抗铅污染的能力。金边吊兰叶片可溶性糖含量基本呈递增趋势,而绿航绿萝叶片可溶性糖含量则呈现先升后降的趋势。说明植物对铅污染的吸收和净化是有一定限度的,存在一定的阈值。这与孙小霞[19]研究高羊茅对铅递进胁迫的生理响应时的结论一致。可溶性糖的权重值在5项指标中位于第2,虽然比较重要,但也说明同样是渗透调节物质,可溶性糖在绿航绿萝和金边吊兰抗铅污染指标中所起的作用不及位于第1的脯氨酸。
脯氨酸在植物体内含量很低,一旦发生逆境胁迫,脯氨酸便会在植物细胞质中积累,以防止细胞脱水。沙翠芸[22-23]等在研究紫叶李、美人梅以及花生对铅胁迫的生理响应时普遍认为在逆境下,脯氨酸的含量呈增加趋势,本试验研究表明,航绿萝和金边吊兰叶片脯氨酸含量随着铅处理时间的延长和铅处理浓度的升高而增加,这与前人的研究一致,证实了逆境胁迫会造成脯氨酸的积累。本研究还发现,相同铅浓度处理条件下航绿萝和金边吊兰叶片脯氨酸含量和铅胁迫的时间长短有一定的关系,Pb2+胁迫14d比胁迫7d测定值大,随着铅处理时间的延长,相同条件下脯氨酸含量升高20%左右。并且脯氨酸权重值在5项指标中位于第1,说明脯氨酸可以作为测定航绿萝和金边吊兰抗铅污染能力的重要鉴定指标。
许多研究表明,Pb2+进入植物体内后,不仅与可核酸、蛋白质和酶等大分子物质结合,而且还可取代某些酶和蛋白质行使其功能时所必需的特定元素,使其变性或活性降低[24]。本试验中,绿航绿萝Pb2+胁迫7d,Pb2+处理浓度为20、40mg·L-1时可溶性蛋白含量高于对照,之后随着Pb2+处理浓度增大而降低且低于对照,说明短时间低浓度Pb2+胁迫有利于可溶性蛋白含量的积累,短时间高浓度Pb2+胁迫可溶性蛋白的合成能力减弱;Pb2+胁迫14 d,不同Pb2+处理浓度均明显高于对照,>40mg·L-1时变化趋势不明显,说明此时可溶性蛋白含量的积累能够维持在一定的水平而无明显降低。金边吊兰叶片的可溶性蛋白含量随着铅处理时间的延长和铅处理浓度的升高先呈降低趋势,可能开始是较低浓度的铅作为一种逆境条件促进蛋白的合成,而当铅超过一定限度时则与蛋白质结合使其变性,也可能是由于铅胁迫干扰植物体内的蛋白质代谢,使蛋白质的合成受阻。此外,蛋白质合成减弱,还可能与重金属抑制核酸合成有关[25]。
植物在重金属胁迫下,体内的丙二醛含量会相应升高,这是植物细胞内活性氧含量增加,细胞发生膜脂过氧化现象的表现[26]。本试验中,绿航绿萝和金边吊兰叶片丙二醛含量在不同Pb2+浓度处理下均高于对照,这表明与对照相比绿航绿萝和金边吊兰膜质过氧化程度加重,已经受到了重金属铅的毒害。但随着铅处理浓度的增加变化趋势不明显,而且不同取样时间内表现出一定程度的上下浮动。可能是细胞内保护酶系活性水平不断调整和细胞膜结构的受损与修复这一动态过程的正常表现。
朱宇林[27]等认为,重金属胁迫可引起植物叶片褪绿及叶绿素含量的下降。可能是因为Pb2+取代叶绿素分子中的Mg2+,破坏了叶绿素的结构,从而使叶绿素的生理功能受到抑制,影响光合作用的正常进行。本试验结果表明,Pb2+胁迫7d时,绿航绿萝和金边吊兰叶片叶绿素a、叶绿素b及总叶绿素含量在不同Pb2+浓度处理下均低于对照,且随着铅处理浓度的增加呈现先下降后上升的趋势。Pb2+胁迫7d时绿航绿萝随着铅处理浓度的增加呈上升趋势,金边吊兰则呈下降趋势。铅胁迫14d与铅胁迫7d相比绿航绿萝和金边吊兰叶片中叶绿素a、叶绿素b及总叶绿素含量有所降低。这种变化可能与绿航绿萝和金边吊兰的防御机制有关。低浓度的Pb2+还不能刺激绿航绿萝和金边吊兰内发生防御性反应,直接破坏叶绿素分子结构或抑制叶绿素合成,,所以其含量降低。但随着Pb2+胁迫浓度加大,达到防御系统的刺激域值时,航绿萝和金边吊兰的防御机制开始启动,生成相应的解毒物质[28],从而使叶绿素含量呈上升趋势。如果胁迫浓度进一步加大以致于超过绿航绿萝和金边吊兰的防御能力时,进入植物体内的Pb2+开始破坏生物膜的结构,导致叶绿体、线粒体及细胞核等重要器官损伤,影响光合作用。
综合来看,许多生理生化指标均与植物的抗铅污染能力有关,植物的抗铅胁迫能力是由诸多因素协同作用构成的一个复杂的综合性状,因此在评价植物的抗铅污染能力时,必须将这些综合起来才能做出正确的评价。本试验将模糊数学中的隶属函数评判法和灰色关联分析法应用到植物抗铅胁迫能力的综合评价中,不仅克服了单个指标的片面性,而且使评判结果更全面地反映了植物实际的抗铅胁迫能力。综合评判的结果表明,金边吊兰的抗铅污染能力优于绿航绿萝。
[1] 刘秀梅,聂俊华,王庆仁.Pb对农作物的生理生态效应 [J].农业环境保护,2002,21(3):201-203.LIU X M,NIE J H,WANG Q R.Eco-physiological response of several crops to lead[J].Agro-environmental Protection,2002,21(3):201-203.(in Chinese)
[2] 段德超,于明革,施积炎.植物对铅的吸收、转运、累积和解毒机制研究进展[J].应用生态学报,2014,25(1):287-296.DUAN D C,YU M G,SHI J Y.Research advances in uptake,translocation,accumulation and detoxification of Pb in plants[J].Chinese Journal of Applied Ecology,2014,25(1):287-296.(in Chinese)
[3] 秦普丰,铁柏清,周细红.铅与镉对棉花和水稻萌发及生长的影响[J].湖南农业大学学报,2000,26(3):205-207.QIN P F,TIE B Q,ZHOU X H.Effects of cadmium and lead in soil on the germination and growth of rice and cotton[J].Journal of Hunan Agricultural University,2000,26(3):205-207.(in Chinese)
[4] 任安芝,高玉葆,刘爽.铬、镉、铅胁迫对青菜叶片几种生理生化指标的影响[J].应用与环境生物学报,2000,6(2):112-116.REN A Z,GAO Y B,LIU S.Effects of Cr,Cd and Pb on free proline contentetc in leavea of Brassica chinensis L.[J].Chinese Journal of Applied &Environmental Biology,2000,6(2):112-116.(in Chinese)
[5] 秦天才,吴玉树,王焕校,等.Cd、Pb及其相互作用对小白菜根系生理生态效应的研究[J].生态学报,1998,18(3):320-325.QIN T C,WU Y S,WANG H X,et al.Effect of Cadmum,Lead and their in teractions on the physiological and ecological chara-cteristics of root system of Brassica chinensis[J].Acta Ecologica Sinica,1998,18(3):320-325.(in Chinese)
[6] 郝建军,刘延吉.植物生理学实验技术[M].沈阳:辽宁科学技术出版社,2001:100-101.
[7] 高俊风.植物生理学实验指导[M].北京:高等教育出版社,2006:142-231.
[8] 刘志国.生物化学实验[M].武汉:华中科技大学出版社,2007:79-81.
[9] 张志良.植物生理学实验指导[M].北京:高等教育出版社,2010:154-155.
[10] 刘萍,李明军.植物生理学实验技术[M].北京:科学出版社,2007:89-90.
[11] 田如男,袁安全,薛建辉.4种常绿阔叶乔木树种幼苗抗铅胁迫能力的比较[J].南京林业大学学报,2005,29(6):81-84.TIAN R N,YUAN A Q,XUE J H.Comparison on the ability of resistance to Pb stress of four evergreen broadleaved trees seedlings[J].Journal of Nanjing Forestry University,2005,29(6):81-84.(in Chinese)
[12] 冯祥元,种培芳,于柱英.10个彩叶树种抗旱性指标测定分析及其综合评价[J].西北林学院学报,2013,28(5):30-35.FENG X Y,ZHONG P F,YU Z Y.Comprehensive evaluated of dought resistance of ten colourfultree specie[J].Journal of Northwest Forestry University,2013,28(5):30-35.(in Chinese)
[13] 种培芳,苏世平.4种金色叶树木对SO2胁迫的生理响应[J].生态学报,2013,33(15):4639-4648.ZHONG P F,SU S P.Physiological responses of four goldenleaf trees to SO2stress[J].Acta Ecologica Sinica,2013,33(15):4639-4648.(in Chinese)
[14] 陈志成,王志伟,王荣荣.3种阔叶树种对持续干旱的生理响应及抗旱性评价[J].中国水土保持科学,2013,11(2):65-71.CHEN Z C,WANG Z W,WANG R R.Physiological response of three broadleaved tree species to drought stress and evaluation of drought resistance[J].Science of Soil and Water Conservation,2013,11(2):65-71.(in Chinese)
[15] 魏秀俭.玉米自交系耐旱性的模糊隶属函数法分析[J].山东农业科学,2005(2):25-27.WEI X J.The drought tolerance analysis of maize inbred lines by fuzzy administering function[J].Shandong Agricultural Sciences,2005(2):25-27.(in Chinese)
[16] 张杰,梁永超,娄运生.镉胁迫对两个水稻品种幼苗光合参数、可溶性糖和植株生长的影响[J].植物营养与肥料学报,2005,11(6):774-780.ZHANG J,LIANG Y C,LOU Y S.Effect of cadmium on photosynthesis parameters,leaf soluble sugar and plant growth in two rice cultivars[J].Plant Nutrition and Fertilizer,2005,11(6):774-780.(in Chinese)
[17] MIELKE H W,GONZALES C R,SMITH M K,et al.Quantities and associa-tions of lead,zinc,cadmium,manganese,chromium,niekel,vanadiumand copper in fresh Mississippi delta alluvium and New Orleans alluvialsoils[J].The Seienee of the Total Environment,2000,246:249-259.
[18] 江行玉,赵可夫.植物重金属伤害及其抗性机理[J].应用与环境生物学报,2001,7(l):92-99.JIANG X Y,ZHAO K F.Mechanism of heavy metal injury and resistance of plants[J].Chinese Journal of Applied &Environmental Biology,2001,7(l):92-99.(in Chinese)
[19] 孙小霞.高羊茅对铅递进胁迫的生理响应[J].河南科技大学学报,2006,27(6):75-78.SUN X X.Physiological response of tall fescue to lead increased stress[J].Journal of Henan University of Science &Technology,2006,27(6):75-78.(in Chinese)
[20] 王艳,王进鑫,马惠芳.干旱和铅胁迫对刺槐和紫穗槐抗氧化酶活性的影响[J].西北林学院学报,2011,26(6):24-29.WANG Y,WANG J X,MA H F.Effects of drought and lead stresses on antioxidant enzyme activities of Robinia pseudoacacia and Amorpha fruticosa[J].Journal of Northwest Forestry University,2011,26(6):24-29.(in Chinese)
[21] 何翠屏,王慧忠.重金属镉、铅对草坪植物根系代谢和叶绿素水平的影响[J].湖北农业科技,2003(5):60-63.HE C P,WANG H Z.Effect of cadmium and lead on the roots metabolizm and chlorophyll of lawn plant[J].Hubei Agricultural Sciences,2003(5):60-63.(in Chinese)
[22] 沙翠芸,孟庆瑞,王静.两种彩叶植物对铅胁迫的生理响应[J].西北林学院学报,2011,26(4):36-40.SHA C Y,MENG Q R,WANG J.Physiological responses of two colored leaf species to Pb stress[J].Journal of Northwest Forestry University,2011,26(4):36-40.(in Chinese)
[23] 韩豫,曹莹,王绍斌,等.铅胁迫对花生生理生化特性的影响[J].花生学报,2007,36(1):24-27.HAN Y,CAO Y,WANG S B.Effects of lead stress on the physiological and biochemical characteristics of peanut[J].Journal of Peanut Science,2007,36(l):24-27.(in Chinese)
[24] 张义贤.重金属对大麦毒性的研究[J].环境科学学报,1997,17(2):199-205.ZHANG Y X.Toxicity of heavy metals to Hordeum vulgare[J].Acta Scientiae Circumstantiae,1997,17(2):199-205.
[25] 严重玲,洪业汤,杨先科.Cd、Pb胁迫对烟草叶片中活性氧清除系统的影响[J].生态学报,1997,17(5):488-492.YAN C L,HONG Y T,YANG X K.Effect of Cd,Pb stress on scarenging system of activated oxygen in leaves of tobacco[J].Acta Ecologica Sinica,1997,17(5):488-492.(in Chinese)
[26] 侯文华,宋关铃,汪群慧.3种重金属对青萍毒害的研究[J].环境科学研究,2004,17:40-44.HOU W H,SONG G L,WANG Q H.Toxic effect of three kinds of heavy metals on lemna minor[J].Research of Environmental Sciences,2004,17:40-44.
[27] 朱宇林,曹福亮,汪贵斌,等.Cd、Pb胁迫对银杏光合特性的影响[J].西北林学院学报,2006,21(1):47-50.ZHU Y L,CAO F L,WANG G B,et al.Effects of Cd single and combined stress on chlorophyll content and photosynthetic characteristics of ginkgo[J].Journal of Northwest Forestry University,2006,21(1):47-50.(in Chinese)
[28] 罗通,邓骛远,曾妮.Ag+、Pb2+对轮藻生理生化指标的影响[J].四川师范大学学报:自然科学版,2005,28(6):723-726.LUO T,DENG W Y,ZENG N.Effect of Ag+and Pb2+on physiological and biochemical guidelines of chara[J].Journal of Sichuan Normal University:Nat.Sci.,2005,28(6):723-726.(in Chinese)
——吊兰

