葡萄糖再灌注对2 型糖尿病并发低血糖患者影响的研究
刘雪芳 夏碧文 曾炼坤 蒋 婵 周晓华
糖尿病(Diabetes Mellitus,DM)是全球性灾难,随着强化控制血糖的观念被广泛接受,DM 相关的低血糖发生率也随之增加。持续低血糖可诱发急性心血管疾病,加剧DM 大血管病变,因此,纠正低血糖是必然的,然而新近研究发现低血糖昏迷的大鼠葡萄糖再灌注后出现不同程度脑损害,因此提出葡萄糖再灌注损伤概念,低糖后补充葡萄糖至一定水平能诱发氧化应激,进而损伤细胞或组织[1]。研究表明DM 可能是由炎症因子介导的炎症反应性疾病,C 反应蛋白(C -Reaction Protein,CRP)是一种非糖基化聚合蛋白,是炎症急性时相蛋白中最敏感的指标,与DM 及其并发症发生发展密切相关,CRP 可作为糖尿病肾病早期诊断的依据[2],且2 型DM发生低血糖后血清超敏CRP 水平明显高于2 型DM 未发生低血糖组及健康对照组[3]。CRP 是否与葡萄糖再灌注损伤相关尚不明确,本文旨在研究2 型DM 患者并发低血糖后血糖升高至不同水平时生化指标变化,并探讨炎症因子CRP 与葡萄糖再灌注损伤的相关性。
1 对象与方法
1.1 研究对象
选择2012 年10 月~2014 年10 月于我院分泌科住院的2 型DM 并发中至重度低血糖患者60 例,其中男29 例,女31例;平均年龄(59.60 ±8.9)岁。均符合1999 年WHO 糖尿病诊断与分型,并发低血糖时伴头痛、视觉模糊、交流困难、行为异常、意识障碍或癫痫发作等表现,指尖血糖≤3.0 mmol/L。研究对象通过随机数字表随机分为A、B 两组各30 例。A 组平均年龄(59. 7 ± 8. 4)岁,升糖前血 糖(2. 55 ±0.20)mmol/L;B 组平均年龄(60.70 ±10.2)岁、升糖前血糖(2. 40 ± 0. 2)mmol/L;另选同期随机指尖血糖为6 ~12 mmol/L 2 型DM 患者35 例为对照组(C 组),其中男18例,女17 例;平均年龄(58.30 ±8.3)岁。各组间年龄、ALT、AST、尿素氮(BUN),血清肌酐(Cr)差异无统计学意义,A、B两组基线血糖、磷酸肌酸激酶(CK)、肌酸激酶同工酶(CK -MB)、胱抑素C(Cystatin,CysC)、CRP 差异无统计学意义。排除标准:A、B 两组对象排除胰岛素瘤、胰岛素自身免疫综合征、肾上腺皮质功能减退、倾倒综合征等DM 以外的低血糖患者及低血糖难以纠正,需要进一步使用激素或胰高血糖素者;C 组对象排除曾出现低血糖者。本研究经我院伦理委员会批准,研究对象均签署知情同意书。
1.2 研究方法
1.2.1 采用静脉微泵注入50%葡萄糖(GS)纠正低血糖,葡萄糖灌注起始速度为50%GS 8 ml/min、每15 min 检测指尖血糖,使A 组患者指尖血糖稳定在6 ~8 mmol/L,B 组患者指尖血糖稳定在9 ~12 mmol/l,两组患者血糖升至相应水平后每1 ~2 h 监测指尖血糖,并根据指尖血糖水平调整葡萄糖灌注速度,使两组患者指尖血糖稳定在相应水平。两组患者葡萄糖灌注前及指尖血糖稳定相应水平24 h 后分别抽取静脉血10 ml 送检。对照组亦抽取静脉血10 ml 送检。
1.2.2 观察指标 观察各组患者血糖,BUN、Cr、ALT、AST、CK、CK-MB、CysC、CRP。其中血糖、BUN、Cr、ALT、AST、CK、CK-MB、CysC 均由日立公司7180 全自动生化分析仪测定。CRP 采用双抗夹心酶联免疫检测法测定。
1.3 统计学方法
采用SPSS 18.0 统计软件进行数据处理,结果符合正态分布,数据采用(±s)表示。多组间比较采用单因素方差分析,两组间比较采用t 检验,Pearson 相关分析法分析CRP与各指标的相关性。以p <0.05 为差异有统计学意义。
2 结果
2.1 各组临床、生化资料的比较
A 组升糖后的CK、CK - MB 较升糖前显著降低(p <0.05),B 组升糖后CK、CK - MB 较A 组升糖后显著升高(p <0.05),B 组升糖后CK、CK -MB 较升糖前差异无显著性(p >0.05);C 组CK、CK -MB 较A、B 组升糖前显著降低(p <0.05),较A、B 组升糖后差异无显著性(p >0.05);A 组升糖后的CysC、CRP 较升糖前差异无显著性(p >0.05),B 组升糖后的CysC、CRP 较升糖前及A 组升糖后显著性升高(p<0.05);C 组CysC、CRP 较B 组升糖后显著下降(p <0.05),较A 组升糖后差异无显著性(p >0.05)(见表1)。
表1 各组患者临床、生化资料比较 (±s)
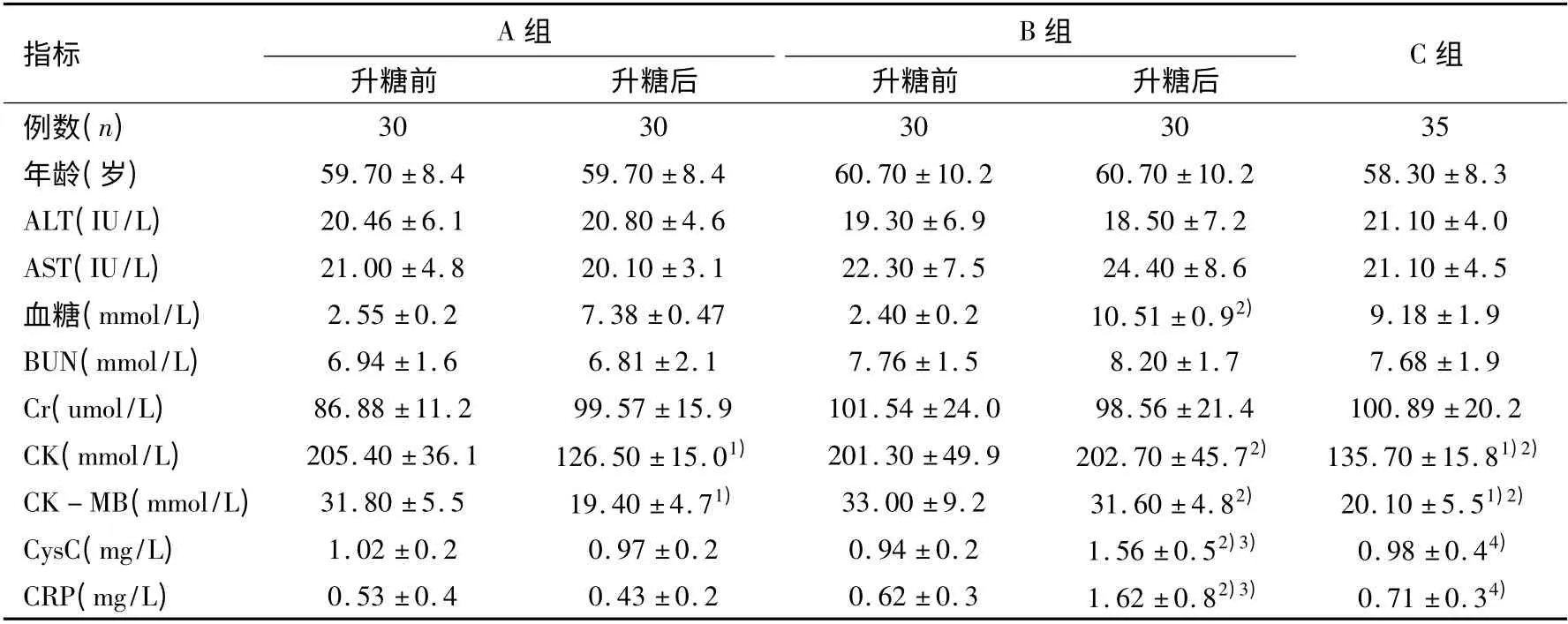
表1 各组患者临床、生化资料比较 (±s)
注:与A 组升糖前比较,1)p <0.05;与A 组升糖后比较,2)p <0.05;与B 组升糖前比较,3)p <0.05;与B 组升糖后比较,4)p <0.05
A指标组B 组 C升糖前 升糖后 升糖前 升糖后例数(n)组30 30 30 30 35年龄(岁) 59.70 ±8.4 59.70 ±8.4 60.70 ±10.2 60.70 ±10.2 58.30 ±8.3 ALT(IU/L) 20.46 ±6.1 20.80 ±4.6 19.30 ±6.9 18.50 ±7.2 21.10 ±4.0 AST(IU/L) 21.00 ±4.8 20.10 ±3.1 22.30 ±7.5 24.40 ±8.6 21.10 ±4.5血糖(mmol/L) 2.55 ±0.2 7.38 ±0.47 2.40 ±0.2 10.51 ±0.92) 9.18 ±1.9 BUN(mmol/L) 6.94 ±1.6 6.81 ±2.1 7.76 ±1.5 8.20 ±1.7 7.68 ±1.9 Cr(umol/L) 86.88 ±11.2 99.57 ±15.9 101.54 ±24.0 98.56 ±21.4 100.89 ±20.2 CK(mmol/L) 205.40 ±36.1 126.50 ±15.01) 201.30 ±49.9 202.70 ±45.72) 135.70 ±15.81)2)CK-MB(mmol/L) 31.80 ±5.5 19.40 ±4.71) 33.00 ±9.2 31.60 ±4.82) 20.10 ±5.51)2)CysC(mg/L) 1.02 ±0.2 0.97 ±0.2 0.94 ±0.2 1.56 ±0.52)3) 0.98 ±0.44)CRP(mg/L) 0.53 ±0.4 0.43 ±0.2 0.62 ±0.3 1.62 ±0.82)3) 0.71 ±0.34)
2.2 CRP 与各指标间Pearson 相关分析
Pearson 相关分析显示,三组总体CRP 与血糖(r =0.395,p <0.01)、CysC(r =0.365,p <0.01)呈正相关,与年龄、ALT、Cr 存在负性线性趋势,但差异无统计学意义,与AST、BUN、CK、CK-MB 呈在正线性相关趋势,差异亦无统计学意义。见表2。

表2 CRP 与各指标的Pearson 相关分析
3 讨论
控制DM 患者心血管危险行动研究(ACCORD 研究)[4]、强化血糖控制与2 型DM 患者的血管转归研究(ADVANCE研究)[5]等循证医学研究显示严重低血糖发生率增加与强化降糖与密切相关。2013 年中国2 型DM 防治指南指出接受药物治疗的DM 患者,血糖≤3.9 mmol/L 属低血糖,即需要补充葡萄糖或含糖食物。然而,到目前为止,国内外对低血糖患者血糖升高到什么水平更有益、以何种速度升高、升高的血糖持续多长时间等问题尚未达成共识,临床治疗过程中往往使血糖在较短时间内上升到较高水平,尤其见于静脉注射葡萄糖患者。
HACES 等[6]用胰岛素致大鼠低血糖后,给予25%的葡萄糖静脉输注,结果显示,葡萄糖再灌注21 h 后血糖已经恢复正常的情况下,仍可清晰地观察到大鼠大脑皮层的坏死细胞,葡萄糖再灌注9 h 和21 h,大鼠脑的海马组织、皮层、纹状体中仍能检测出3 -硝基酪氨酸蛋白表达增高。SUH[1]报道,低血糖昏迷的大鼠给予葡萄糖再灌注治疗,经30 分钟将血糖分别升高至1 ~2 mmol/L、5 ~10 mmol/L、10 ~15 mmol/L,葡萄糖再灌注30 min 时检测脑组织活性氧水平显示,葡萄糖再灌注诱导的氧化应激水平高于低糖本身,1 周后脑组织HE 染色显示,后两组脑组织损伤程度比持续处于低血糖状态者还要严重,认为低血糖导致的脑损伤是由“葡萄糖再灌注”所诱发,并非完全低血糖本身所致,其可能机制是NADPH 氧化酶活性增加所致。我国褚秀丽等[7]发现胰岛素诱导的低血糖大鼠葡萄糖再灌注后有不同程度脑损害,相同的灌注时间,血糖越高,海马神经元数量越少,从电镜下观察海马的超微结构有不同程度的病理改变,大鼠脑损害程度与低血糖后血糖升高速度有关,血糖升高速度越快,脑损害越明显,提示可能存在葡萄糖再灌注脑损害。
本研究发现A、B 两组升糖前CK、CK -MB 差异无显著性,但均较C 组显著性升高,提示低血糖在一定程度上诱发心肌损伤,当血糖升高后,A 组CK、CK-MB 均较升糖前显著下降,然而血糖升高至B 组9 ~12 mmol/L 水平时CK、CK -MB 无显著性下降,且较6 ~8 mmol/L 水平时显著升高,提示血糖升高至更高水平时,不利于心肌损伤修复。
肾脏是清除CysC 的唯一器官,不受年龄、性别、炎症、饮食等变化的影响,CysC 反应早期肾损伤较BUN、Cr 有更高的敏感性和特异性[8]。本研究中各组BUN、Cr 差异均无显著性,但B 组升糖后CysC 水平较各组均显著性升高,表明葡萄糖升至更高水平时存在一定程度肾损伤。推测与以下机制相关:①氧化应激。近年来研究表明血糖波动与氧化应激水平增高相关[9],兰丽珍等[10]发现餐后2 h 的急性血糖波动可引起血清丙二醛(Malondialdehyde,MDA)水平显著性升高,MDA 升高程度与短期血糖的升高幅度密切相关,且血糖波动越大,体内MDA 水平增幅越高。MDA 可间接反映氧自由基对机体细胞的损伤程度,引起内皮细胞结构和功能的急性损害。②炎症过程激活。SCHIEKOFER 等[11]研究了健康志愿者外周血单核细胞NF -кB 在不同血糖水平的活性,观察到当血糖从5 mmol/L 升高到10 mmol/L 时,2 h 后NF -кB的活性增加,提示急性的血糖变化可能激活NF -кB,引起炎症反应的发生。③凝血机制活化。急性血糖变化会伴随凝血系统改变,最终导致血栓形成。具体机制包括血小板聚集,因子Ⅷ、纤维蛋白肽A 水平增加,纤维蛋白原半衰期缩短等[12]。肾小球毛细血管内皮细胞是肾小球的固有细胞之一,与肾小球基底膜和系膜紧密相连,上述氧化应激、炎症反应、凝血机制失调等途径可导致肾小球毛细血管内皮功能障碍,肾小球基底膜和系膜病变,及肾小球局部血流流速减慢,局部微血栓形成,从而导致一定程度肾损伤。
研究表明血清高水平CRP 可损伤血管内皮细胞功能,诱导内皮细胞粘附分子的表达,促进血管硬化的发生[13],通过下调CRP,可改善2 型DM 患者肾脏功能[14],本研究中CRP在B 组血糖升高至9 ~12 mmol/L 时较其余各组显著性升高,相关分析显示,CRP 与CysC 显著性正相关,与CK、CK -MB 亦存在正线性相关趋势,提示CRP 与葡萄糖再灌注损伤相关,推测炎症因子是葡萄糖再灌注损伤机制之一。
综上所述,2 型DM 并发低血糖患者葡萄糖升高水平越高,越不利于心肌损伤修复,并引起早期肾损害,而炎症因子CRP 与葡萄糖再灌注损伤相关。本研究样本量较小,所得研究结论需继续扩大样本量证实,将进一步研究血糖升高速度对机体的影响。
[1] SUH SW,GUM ET,HANBY AM,et al. Hypoglycemic neuronal death is triggered y glucose reperfusion and activation of neuronal NADPH oxidase[J].Clin Invest,2007,117,910 -918.
[2] 傅明捷,黄 萍,王 艳,等.糖尿病肾病患者蛋白尿与C 反应蛋白、肿瘤坏死因子-α 和白介素-6 水平关系的临床研究[J].中国医药导报,2013,10(15):89 -90.
[3] 邹晓莹,孙中华,奚树刚.2 型糖尿病患者发生低血糖后血清超敏CRP 水平的观察[J].中国实验诊断学,2012,16(1):124 -125.
[4] THE ACTION TO CONTROL CARDIOVASCULAR RISK IN DIABETES STUDY GROUP. Effects of intensive glucose lowering in type 2 diabetes[J]. The new England journal of medicine,2008,358(24):2545 -2559.
[5] THE ADVANCE COLLABORATIVE GROUP. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes[J]. The new England journal of medicine ,2008,358(24):2560 -2572.
[6] HACES ML,MONTIEL T,MASSIER L,et al. Selective vulnerability of brain regions to oxidative stress in a non -coma model of insulin - induced hypoglycemia[J]. Neuroscience,2010,165(1):28 -38.
[7] 褚秀丽,赵玉武,米亚静,等.血糖升高水平对大鼠低血糖性脑损伤影响的实验研究[J].中华糖尿病杂志,2012,4(3):170-176.
[8] 王彦春,张俊峰,魏殿军.胱抑素C 和β2-微球蛋白对糖尿病肾病早期诊断的价值和相关性[J]. 广东医学,2014,17:2715-2717.
[9] 彭 永,吕肖锋. 血糖波动与糖尿病慢性血管并发症关系的研究进展[J].中国医药导报,2014,11(10):156 -159,163.
[10] 兰丽珍,弓军胜,谭 芳,等.急性血糖波动加剧氧化应激引起糖尿病微血管并发症的研究[J]. 中西医结合心血管病杂志,2013,11(6):678 -680.
[11] SCHIEKOFER S,ANDRASSY M,CHEN J,et al. Acute hyperglycemia causes intracellular formation of CML and activation of rats,p42/44 MAPK,and nuclear factor кB in PBMCs[J]. Diabetes,2003,52:621.
[12] 汪 湲,吴汉妮. 血糖波动的研究进展[J]. 内科急危重症杂志,2011,17(6):379 -382.
[13] SRIDEVI D,DAN YX,ISHWARLAL J,et al.C -reactive protein increases plasminogen activator inhibitor - 1 expression and cativety in human aortic endothelial cells:implications for the metabolic syndrome and atherothrombosis[J]. Circulation,2003 ,107:398 -404.
[14] 陈锁胜,刘子永,严建伟. 厄贝沙坦联合阿托伐他汀对早期糖尿病肾病患者的血清炎症因子的影响[J].现代医院,2014,14(1):26 -28.

