饥饿诱导人胚肾细胞自噬模型的构建
黄桢钧 刘慰华 钟赟 刘少军
基础研究论著
饥饿诱导人胚肾细胞自噬模型的构建
黄桢钧 刘慰华 钟赟 刘少军
目的探讨饥饿诱导的人胚肾细胞(HEK293)自噬模型的构建。方法采用Earle's平衡盐溶液(EBSS)分别处理HEK293细胞0、1、2、4、8 h,显微镜下观察细胞形态变化,蛋白免疫印迹法检测自噬微管相关蛋白轻链(LC)3-Ⅱ/LC3-Ⅰ和p62的表达;双荧光mRFP-eGFP-LC3(ptfLC3)质粒转染HEK293细胞24 h后,荧光显微镜观察EBSS饥饿条件下细胞内红色和绿色LC3荧光亮点的变化。结果饥饿处理后,HEK293细胞皱缩、变小变圆,蛋白免疫印迹法可检测到LC3的蛋白表达和LC3-Ⅱ/LC3-Ⅰ比值增加;荧光显微镜可观察到细胞内红色和绿色LC3荧光亮点均增加。结论饥饿可成功诱导HEK293细胞自噬,表现为LC3蛋白表达和LC3-Ⅱ/LC3-Ⅰ比值的增加,以及荧光显微镜下细胞内红色和绿色LC3荧光亮点的增加。
饥饿;自噬;自噬微管相关蛋白轻链3;p62;双荧光检测
自噬是细胞内的一种蛋白降解途径,即细胞中受损的蛋白质、细胞器被双层膜结构包绕形成自噬体,与溶酶体结合后即可被降解[1]。自噬普遍存在于真核细胞内,无论是在生理过程还是在病理状态下,均可见自噬现象。研究表明,自噬参与了神经退行性疾病、心脏疾病和恶性肿瘤等多种疾病的发生、发展[2-3]。当细胞缺乏营养即饥饿时可激活自噬,饥饿性自噬是最基本的自噬过程。本研究选用常用的工具细胞——人胚肾细胞(HEK293细胞),以Earle's平衡盐溶液(EBSS)处理作为饥饿手段,建立HEK293细胞自噬模型,旨在为自噬的研究提供更具有普遍意义的方法学参考[4]。
材料与方法
一、细胞来源
HEK293细胞购自中国科学院细胞库,采用含10%胎牛血清、1%链-青霉素的DMEM培养液,在37℃、5%CO2饱和湿度下培养,0.25%胰酶消化传代,取对数生长期细胞进行实验。
二、主要试剂
DMEM培养液、EBSS购自美国Gibco公司,雷帕霉素购自上海生工生物工程股份有限公司,mRFP-eGFP-自噬微管相关蛋白轻链(LC)3质粒购自美国Addgene公司。LC3B兔抗人多克隆抗体购自美国Sigma公司,p62兔抗人多克隆抗体购自美国Cell Signaling公司,内参照物GAPDH鼠抗人单克隆抗体购自美国Santa Cruz公司,辣根过氧化物酶(HRP)标记羊抗兔、羊抗小鼠IgG购自美国Cell Signaling公司。脂质体Lipofactamine 3000转染试剂盒购自美国Life Technologies公司。
三、主要仪器
包括美国Thermo scientific 3110系列ⅡCO2培养箱,美国Thermo scientific 1300系列A2生物安全柜,美国AMG EVOS fl荧光显微镜,美国Thermo scientific BCA蛋白测定试剂盒,美国Biotek Epoch酶标仪,美国Bio-Rad电泳仪和转膜仪。
四、方法
1.细胞形态变化的观察
以EBSS代替DMEM培养液,饥饿处理HEK293细胞0、1、2、4、8 h,并与另一自噬诱导剂雷帕霉素(200 nmol/L)作阳性对照,使用高倍显微镜在400倍视野下观察细胞的形态变化,并采集相应的图片。
2.LC3-Ⅱ/LC3-Ⅰ和p62蛋白表达水平检测
采用蛋白免疫印迹法,按前述方法分组处理HEK293细胞,收集蛋白前用4℃预冷磷酸盐缓冲液(PBS)洗2遍,加RIPA蛋白裂解液冰上裂解5 min,超声充分裂解细胞。调整蛋白浓度后行12%SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳,100 V恒压转膜1 h,5%脱脂牛奶室温封闭1 h,一抗LC3(1∶2 000)、p62(1∶1 000)和GAPDH(1∶2 000)4℃摇床孵育过夜。二抗室温孵育1 h,电化学发光显影。采用Image-Pro Plus 6.0软件分析灰度值,计算LC3-Ⅱ/LC3-Ⅰ。
3.自噬流的监测
对自噬流进行双荧光mRFP-eGFP-LC3监测。采用mRFP-eGFP-LC3质粒瞬时转染HEK293细胞,转染24 h后分为未经处理的阴性对照组、EBSS饥饿处理组、雷帕霉素阳性对照组,分别处理2 h。由于eGFP绿色荧光和mRFP红色荧光在自噬体同时存在,在红、绿荧光合成图像中呈黄色;但在自噬溶酶体酸性环境中eGFP绿色荧光降解,只剩下红色荧光。因此可用合成图像中的黄色斑点(自噬体)和红色斑点(自噬溶酶体)较完整地反映细胞内自噬囊泡的数量[5]。分组处理细胞后在400倍荧光显微镜下观察,随机采集300个细胞内的红、绿色LC3荧光图,计数其合成图像中平均每个细胞含有黄色亮点和红色亮点的数量。
五、统计学处理
结 果
一、显微镜下HEK293细胞形态的变化
与对照组相比,EBSS饥饿处理1 h时,HEK293细胞形态即有明显变化,细胞皱缩、变小变圆钝,随着饥饿时间延长,细胞形态变化越大;雷帕霉素处理未见明显细胞形态变化,见图1。
二、HEK293细胞中LC3-Ⅱ/LC3-Ⅰ和p62蛋白表达水平变化
与饥饿处理0 h组相比,饥饿处理1 h后LC3-Ⅱ表达及LC3-Ⅱ/LC3-Ⅰ均增加,2 h达到峰值,之后逐渐减少;饥饿未明显诱导p62蛋白表达下降,见图2。
三、饥饿处理对HEK293细胞自噬流的影响
经EBSS及雷帕霉素处理2 h后,红、黄色荧光亮点数均比阴性对照组明显增加(P<0.05),提示自噬体和自噬溶酶体增加,说明饥饿处理使HEK293细胞中自噬流增加,见图3。
讨 论
自噬作为与溶酶体相关的主要蛋白降解途径之一,影响着细胞的能量代谢。自噬产生的氨基酸、脂肪酸等降解产物可供细胞重新利用,因而适度的自噬水平有利于维持细胞能量代谢促使细胞存活;而自噬过度激活可能导致细胞发生自噬性死亡。自噬激活或缺陷在肿瘤的发生、发展中发挥着重要作用[6-7]。研究细胞自噬机制可为恶性肿瘤和神经退行性疾病等的治疗提供新的途径和作用靶点[8-10]。自噬是一个非常复杂、连续动态的过程,目前还没有任何一种检测方法能够单独反映整个自噬过程。现有检测方式缺乏特异性。
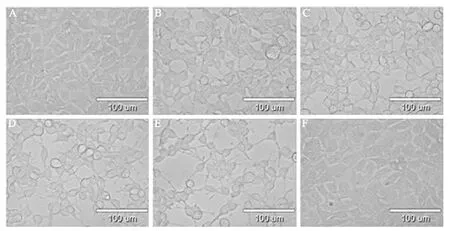
图1 饥饿处理后HEK293细胞的形态变化
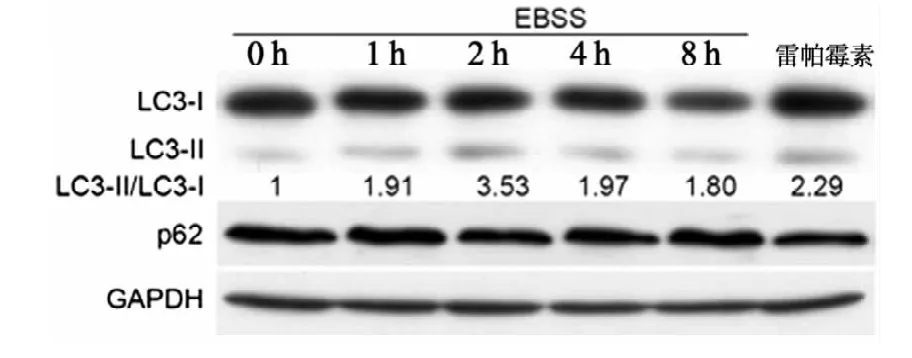
图2 饥饿处理后HEK293细胞内LC3和p62的蛋白表达水平变化

图3 饥饿处理后HEK293细胞自噬流增加
电镜下观察到自噬结构是自噬存在最直接的证据,主要用于定性分析[11]。典型的自噬体为双层膜结构,其内包含有如线粒体、内质网或高尔基体碎片等细胞器成分。但自噬体转化为自噬溶酶体后则变为单层膜结构,其内容物也逐渐被降解,自噬囊泡的辨认难度加大。另外,细胞内的线粒体或包绕线粒体的粗面内质网等双层膜结构,也易与真正的双层膜自噬体结构混淆。尽管可以对样品进行多次切片并测量自噬结构的横截面积以期定量细胞自噬活性,但在细胞中鉴别出自噬体结构本身就已经相当困难,而且自噬结构在细胞内并非均匀分布,使这种定量方法很难准确反映细胞自噬水平。
免疫金电镜技术是相对可行的定量方法,用胶体金颗粒标记异噬体和两性体内的异噬内容物,或者标记自噬前体和自噬体膜上的LC3,从而把自噬前体、自噬体和自噬溶酶体鉴别开来。需要注意的是,这种定量方法也只能反映静态自噬水平,不能反映自噬流的变化。另外,丹酰戊二胺染色、吖啶橙染色等方法也可以用于标记自噬囊泡,但因特异性较差,应用价值有限。
蛋白免疫印迹法检测LC3蛋白表达水平及LC3-Ⅱ/LC3-Ⅰ比值变化是简便可行的方法。LC3是酵母ATG在哺乳动物中的同源物,是目前最可靠的自噬标记蛋白。正常情况下,LC3-Ⅰ分布在细胞质中,与磷脂酰乙醇胺结合形成LC3-Ⅱ后即转移到自噬体的内外膜上,并贯穿于整个自噬过程。电镜和GFP-LC3转染实验证实,LC3-Ⅱ含量增加能够反映细胞内自噬囊泡的增加。另外,多种细胞尤其是肿瘤细胞存在一定水平的基础自噬,在细胞状态不同时LC3-Ⅱ含量也可能发生明显变化。因此,LC3-Ⅱ/LC3-Ⅰ比值是反映自噬水平的可靠指标。本研究以EBSS制造细胞饥饿环境,LC3-Ⅱ及LC3-Ⅱ/LC3-Ⅰ的增加均在2 h达到峰值。p62/SQSTM1是一种自噬降解底物,属于泛素样结合蛋白,与LC3偶联参与自噬体的形成,在自噬中晚期被降解。自噬激活时细胞内p62可减少,然而这种减少在很多情况下较难观察到[12]。
以GFP-LC3融合蛋白的质粒转染细胞后,荧光显微镜下可观察到LC3-Ⅰ呈绿色荧光弥散分布于细胞质中,而LC3-Ⅱ大量聚集在自噬体膜上,呈绿色亮点,或者称为GFP-LC3亮点,亮点可用来反映自噬体的数目。这是目前应用比较广泛的自噬定量方法。但由于GFP绿色荧光在自噬溶酶体内酸性条件下易降解,GFP-LC3不能完全反映自噬结构。Kimura等[5]根据RFP红色荧光不易在溶酶体内降解这一原理,使用mRFP-eGFP-LC3转染细胞,证实红色荧光和绿色荧光在自噬前体和自噬体共表达,呈黄色;而当自噬体与溶酶体融合形成自噬溶酶体后,GFP绿色荧光消失,只剩下红色荧光。因此可以通过统计合成图像中平均每个细胞含有的黄色和红色亮点代表自噬体和自噬溶酶体的数量,这比单纯GFP-LC3法更全面地反映自噬活性和自噬通量的变化。因此,本研究采用mRFP-eGFP-LC3替代GFP-LC3观察LC3亮点。
本研究建立了一个简便而实用的细胞自噬模型,为进一步研究细胞自噬本身的分子机制以及自噬在肿瘤等方面的作用提供了可靠的实验对象。由于双荧光mRFP-eGFP-LC3法还未在多种类型的细胞中应用,因而还需要进行更多的实验建立更可靠、合理的实验标准。
[1]马泰,孙国平,李家斌.细胞自噬的研究方法.生物化学与生物物理进展,2012,39:204.
[2]Mijaljica D,Prescott M,Devenish RJ.Autophagy in disease.Methods Mol Biol,2010,648:79-92.
[3]Nishida K,Kyoi S,Yamaguchi O,et al.The role of autophagy in the heart.Cell Death Differ,2009,16:31-38.
[4]Yang BJ,Feng LM.Symptomatic hyponatremia and hyperglycemia complicating hysteroscopic resection of intrauterine adhesion:a case report.Chin Med J(Engl),2012,125:1508-1510.
[5]Kimura S,Noda T,Yoshimori T.Dissection of the autophagosome maturation process by a novel reporter protein,tandem fluorescent-tagged LC3.Autophagy,2007,3:452-460.
[6]Mazure NM,Pouyssegur J.Hypoxia-induced autophagy:cell death or cell survival?Curr Opin Cell Biol,2010,22:177-180.
[7]Hu YL,Delay M,Jahangiri A,et al.Hypoxia-induced autophagy promotes tumor cell survival and adaptation to antiangiogenic treatment in glioblastoma.Cancer Res,2012,72:1773-1283.
[8]Chen T,Hao J,He J,et al.Cannabisin B induces autophagic cell death by inhibiting the AKT/mTOR pathway and S phase cell cycle arrest in HepG2 cells.Food Chem,2013,138:1034-1041.
[9]Din FV,Valanciute A,Houde VP,et al.Aspirin inhibits mTOR signaling,activates AMP-activated protein kinase,and induces autophagy in colorectal cancer cells. Gastroenterology,2012,142:1504-1515.
[10]刘穗玲,李小毛.自噬与紫杉醇敏感性.新医学,2014,45:218-220.
[11]秦正红,乐卫东.自噬:生物学与疾病.北京:科学出版社,2011:49-51.
[12]Rusten TE,Stenmark H.p62,an autophagy hero or culprit?Nat Cell Biol,2010,12:207-209.
Establishment of HEK293 cell line with starvation-induced autophagy
Huang Zhenjun,Liu Weihua,Zhong Yun,Liu Shaojun.Guangzhou Institute of Cardiovascular Disease/Department of Cardiology,the Second Affiliated Hospital of Guangzhou Medical University,Guangzhou 510260,China
ObjectiveTo establish HEK293 cell model with starvation-induced autophagy.MethodsHEK293 cells were treated with Earle's balanced salt solution(EBSS)for 0,1,2,4 and 8 h.Then the changes in cell morphology were observed under a microscope.And the expression levels of two autophagy-related proteins including LC3 and p62 were detected by western blotting.After transfected with plasmids encoding mRFP-eGFP tandem fluorescent-tagged LC3(ptfLC3)for 24 h,the changes in LC3 puncta labeled with red and green fluorescence were observed under fluorescence microscopy when HEK293 cells were starved in EBSS.ResultsHEK293 cells shrank obviously and became smaller and round after starvation.The expression of LC3 protein and the ratio of LC3-Ⅱ/LC3-Ⅰwere increased detected by western blotting.The number of LC3 puncta labeled with red and green fluorescence was elevated under fluorescence microscopy.ConclusionsAutophagy in HEK293 cells can be successfully induced by starvation,manifested as increased expression of LC3 protein and enhanced ratio of LC3-Ⅱ/LC3-Ⅰand elevated number of LC3 puncta labeled with red and green fluorescence.
Starvation;Autophagy;LC3;p62;mRFP-eGFP
2014-12-20)
(本文编辑:林燕薇)
10.3969/g.issn.0253-9802.2015.04.004
510260广州,广州心血管疾病研究所广州医科大学附属第二医院心内科[黄桢钧(硕士研究生),刘慰华,钟赟,刘少军]
,刘少军,E-mail:shaojunliu@yahoo.com

