阻断TLR4信号通路对结肠癌细胞CT26裸鼠种植瘤生长和凋亡的影响
何卉欣 蒋梦萍 刘慧玲 江洁 尉秀清
阻断TLR4信号通路对结肠癌细胞CT26裸鼠种植瘤生长和凋亡的影响
何卉欣 蒋梦萍 刘慧玲 江洁 尉秀清
目的研究阻断Toll样受体4(TLR4)信号通路对小鼠结肠癌细胞CT26裸鼠种植瘤生长和凋亡的影响。方法 建立结肠癌细胞CT26裸鼠种植瘤模型,12只鼠成瘤后随机分成实验组及对照组,分别腹腔内注射TLR4信号通路阻断剂CLI-095(3 mg/kg)和相同公斤体积的二甲基亚砜(DMSO),并测定种植瘤的生长曲线;种植瘤石蜡包埋切片作苏木素-伊红染色观察病理组织学改变,TUNEL法检测瘤组织凋亡情况,蛋白免疫印迹法检测TLR4、cleaved caspase-3等蛋白表达。结果在实验结束时,实验组瘤体体积为(2.39±0.32)cm3,对照组瘤体体积为(1.77±0.25)cm3,实验组瘤体显著大于对照组(t=3.817,P=0.004)。实验组肿瘤细胞排列较致密,仅有局部坏死;对照组肿瘤细胞密度较低、排列散乱,坏死显著。实验组癌组织凋亡指数为(9.86±2.80)%,明显低于对照组的(22.57±4.93)%,t=-7.091,P<0.001。2组癌组织TLR4蛋白的表达无显著差异,实验组cleaved caspase-3蛋白的表达显著低于对照组。结论阻断TLR4信号通路,可以抑制结肠癌细胞株CT26种植瘤细胞的凋亡,从而有利于肿瘤生长。
结肠癌;TLR4;细胞凋亡;种植瘤
基础研究论著
结肠癌是目前世界第三大常见恶性肿瘤,也是中国最常见的肿瘤及肿瘤相关死亡原因,但目前关于结肠癌的病因及其发病机制仍未完全明了[1-2]。新近研究表明,先天性免疫在结肠癌发病机制中起了非常重要的作用[3]。Toll样受体4(TLR4)是一种非常重要的先天性免疫受体,其配体为外源性的脂多糖及内源性的热休克蛋白60等,不仅在免疫细胞上表达,近年来发现在多种肿瘤细胞上也有表达并表达上调,如结直肠癌、胃癌、乳腺癌、肝细胞等[4-7]。TLR4在结肠癌中的具体作用及作用机制仍未明确,本研究拟用TLR4信号通路阻断剂CLI-095腹腔注射于小鼠结肠癌细胞CT26裸鼠种植瘤模型,观察其对种植瘤的生长和凋亡的影响,以期初步明确TLR4在结肠癌中的生物学作用,并探讨其可能的作用机制[8]。
材料与方法
一、实验细胞株及实验动物
1.实验细胞株
小鼠结肠癌细胞CT26购于中国科学院上海生命科学院细胞资源中心。
无特定病原体(SPF)级BALB/c Nude裸鼠12只,雄性,周龄5周,体质量16~20 g,购自中山大学北校区动物实验中心。实验过程中对动物的处理符合医学伦理学的标准。
二、主要试剂
CLI-095(InvivoGen),苏木素-伊红染料(中杉金桥),TUNEL试剂盒(Recho),DMSO(Sigma),RPMI1640培养基(GIBCO),胎牛血清(GIBCO),0.025%胰蛋白酶(GIBCO),蛋白提取裂解液(EMD Millipore),蛋白质定量试剂盒(GenStar),cleavedcaspase-3抗体(Abcam),TLR4抗体(Abcam),β-actin抗体(Abcam)。
三、实验方法
1.细胞传代及培养
CT26于含10%胎牛血清的RPMI-1640培养基中贴壁生长,放于37℃5%CO2培养箱中培养,隔天换液,以0.025%的胰蛋白酶消化,含血清培养基停止消化,1∶3传代。收集对数生长期细胞,离心取上清,并用无血清培养基重悬,细胞计数,调整细胞浓度,制成2×106/ml的单细胞悬液。
2.成瘤小鼠实验模型建立
温州方言的历史面貌不见于或很少见于历史文献,瓯越语方言语汇往往是历史形成,世代口耳相传,缺少书面文本,这也给语料收集、研究、汇录增加了难度。盛教授为了写这本书,通过大量的田野调查和文献查询,历时近五年时间,比较全面地收集了瓯越语成语、惯用语、歇后语、谚语等语汇。据粗略统计,全书共收集到瓯语语汇4000多条,越语语汇3000多条。而这些材料是前人还没有全面系统地收集、整理、研究过的,这为该书的写作提供了丰富、翔实、可靠的语料。
小鼠随机分成实验组和对照组2组,每组6只。用一次性1 ml无菌注射器于每只小鼠右侧腰部皮下接种0.2 ml CT26单细胞悬液,形成直径约3 mm皮丘。待肿瘤出现肉眼可观察后,隔天实验组腹腔注射3 mg/kg CLI-095(以DMSO为溶剂)[8],对照组注射与实验组等公斤体积的DMSO溶液;同时观察小鼠精神及饮食情况,测量2组小鼠肿瘤体积。计算肿瘤体积(v)的方法:v=ab2/2 (a:肿瘤最大直径,b:肿瘤最小直径)。
3.标本采集与处理
第21日,10%水合氯醛麻醉小鼠后并剥离种植瘤体。每组每个标本取部分放入10%福尔马林中固定制成石蜡标本,其余保存于液氮中用于提取蛋白质。
4.组织学分析及TUNEL检测
病理标本常规石蜡包埋,苏木素-伊红染色,观察种植瘤生长情况。按照Roche公司产品说明书进行TUNEL检测,细胞核呈棕褐色为阳性染色。每张切片随机选10个视野,计算凋亡细胞数及总细胞数,凋亡指数=凋亡细胞数/肿瘤细胞总数×100%。
5.种植瘤蛋白提取及蛋白质电泳
每组取约20 mg冻存的瘤组织,按蛋白质提取裂解液说明书提取肿瘤组织总蛋白,并用BCA法检测蛋白浓度。分离蛋白并进行十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜(PVDF膜)、封闭后,用相应目的蛋白的抗体孵育,4℃冰箱摇床过夜,其中对总蛋白分别用抗TLR4、cleaved caspase-3、β-actin的一抗孵育。次日复温30 min后,HRP标记的二抗孵育2 h,暗房曝光。
四、统计学处理
应用SPSS 19.0软件进行相关数据统计学分析。计量资料以±s表示,采用2组独立样本t检验进行假设检验,P<0.05为差异有统计学意义。
结 果
一、2组小鼠结肠癌细胞CT26种植瘤的观察与比较
所有裸鼠接种后,均先后成瘤,成瘤率达100%,无自然死亡。成瘤期间,小鼠精神饮食可。肉眼见皮下种植瘤呈结节状,质硬,边界清,表面可见丰富血管形成,不易推动,向周围浸润性生长。接种细胞第21日完整剥取种植瘤,可见CLI-095实验组肿瘤的体积显著大于对照组。接种肿瘤单细胞悬液第5日出现肉眼可见约为0.05 cm3种植瘤开始腹腔注射药物,17 d以前2组小鼠种植瘤体积差异无统计学意义。在第19日及第21日,实验组种植瘤体积分别为(1.74±0.35)cm3和(2.39±0.32)cm3,对照组种植瘤体积为(1.29 ±0.22)cm3和(1.77±0.25)cm3,实验组瘤体体积显著高于对照组,2组比较差异均有统计学意义(t第19日=2.657,P=0.03;t第21日=3.817,P=0.004),见图1、2。
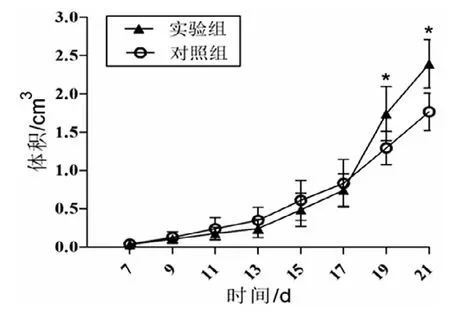
图1 小鼠的肿瘤生长曲线
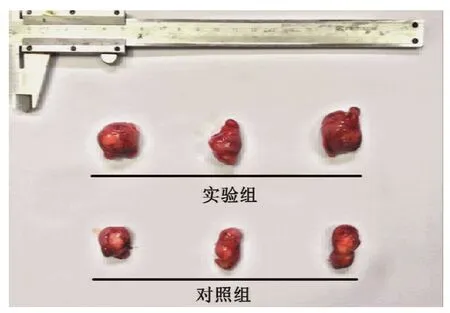
图2 小鼠皮下种植瘤大体标本
二、2组小鼠结肠癌细胞CT26种植瘤石蜡切片组织学情况及凋亡情况
苏木素-伊红染色可见2组鼠CT26结肠癌种植瘤细胞布满视野,密集排列,无显著腺体存在,癌细胞间有结缔组织。肿瘤细胞异型性显著,核大畸形、深染,胞质少,大小不一,形状不等,呈椭圆形,病理性核分裂像多见。与对照组比较,实验组肿瘤组织坏死灶少,肿瘤细胞密度较高。TUNEL染色显示凋亡信号散在于肿瘤组织。实验组凋亡指数为(9.86±2.80)%,显著低于对照组的(22.57±4.93)%,2组比较差异有统计学意义(t=-7.091,P<0.001),实验组凋亡信号少呈淡褐色,对照组凋亡信号分布广泛且呈深褐棕色(图3)。

图3 CT26结肠癌种植瘤石蜡切片组织学表现及凋亡情况(×200)
三、种植瘤组织中的TLR4及cleaved caspase-3蛋白的表达
3组肿瘤组织蛋白免疫印迹法检测,内参照βactin为均一显影的条带,TLR4蛋白表达量无差异;实验组cleaved caspase-3蛋白表达量显著降低,这与TUNEL法检测的结果趋势相一致(图4)。
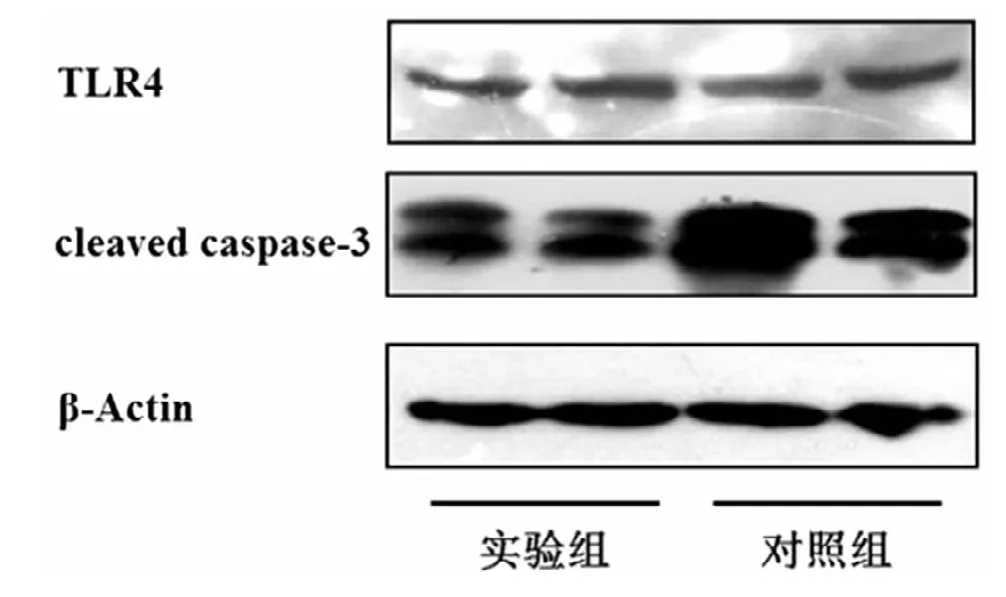
图4 结肠癌细胞CT26种植瘤相关蛋白质表达情况
讨 论
结肠癌是最常见的恶性肿瘤之一,各地流行病学资料显示,结肠癌发病率及病死率均逐年上升。由于慢性炎症是肿瘤一个非常重要的危险因素,近年来研究发现,参与介导炎症的TLR4可促进炎症相关结肠癌肿瘤发展;另一方面,促肿瘤细胞分泌炎症因子逃避自然杀伤细胞核细胞毒性T细胞攻击,进而加强免疫逃逸作用[9-10]。但同时也有证据指出活化TLR4发挥着抗癌作用。在肿瘤发展中,TLR4促树突状细胞的成熟及自然杀伤细胞的活化,诱发或上调T细胞介导的抗肿瘤特异性免疫[11]。目前包括TLR4的配体内毒素(LPS)以及另外2 种TLR4的激动剂牛型结核杆菌卡介苗以及沙培林(OK-432)已被证明是治疗结肠癌、胃癌和肺癌的有效药物[12-15]。Eiró等[16]对104位结肠癌患者临床研究发现,肿瘤细胞表达TLR4的患者肿瘤复发率更低、生存期更长。Li等[17]繁育转基因APCMin/+小鼠,其肠上皮细胞可持续表达活化TLR4,并发现此类转基因小鼠较杂合小鼠自发肠道肿瘤率减少且肿瘤体积减小,诱导激活凋亡通路,抑制肿瘤的发展。以上研究表明,TLR4在肿瘤发展中的作用是非常复杂的,需要我们进一步研究。
CLI-095是TLR4的特异性抑制剂,通过结合TLR4胞内的Cys747位点从而阻断TLR4信号通路,故本实验用CLI-095腹腔内注射于CT26裸鼠种植瘤模型来探索体内TLR4信号阻断对肿瘤细胞凋亡的影响。本实验发现,实验组瘤体显著大于对照组。实验组切片中,肿瘤细胞密度高成片排列,核大质少,仅出现局部坏死;对照组切片中,肿瘤细胞密度较低、排列散乱,多见部分细胞出现空泡或者核固缩,坏死显著。TUNEL法发现,实验组癌组织凋亡指数显著低于对照组;蛋白免疫印迹法检测表明,2组的TLR4表达未有显著差异,而实验组cleaved caspase-3表达显著低于对照组,这与TUNEL法的结果一致;这些结果均提示诱导细胞凋亡可能是TLR4信号抑制种植瘤的作用机制之一。
综上所述,在结肠癌细胞CT26裸鼠种植瘤模型上这一体内实验条件下,阻断TLR4信号通路,可以抑制种植瘤细胞发生凋亡,从而促进肿瘤生长。这为阐明TLR4诱导结肠癌细胞凋亡的分子信号机制提供了初步实验依据,但确切机制仍有待进一步探讨。
[1]Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008.Int J Cancer,2010,127:2893-2917.
[2]Zheng ZX,Zheng RS,Zhang SW,et al.Colorectal cancer incidence and mortality in China,2010.Asian Pac J Cancer Prev,2014,15:8455-8460.
[3]Kaczanowska S,Joseph AM,Davila E.TLR agonists:our best frenemy in cancer immunotherapy.J Leukoc Biol,2013,93:847-863.
[4]郭云蔚,文卓夫,郑丰平,等.TLR2和TLR4在大肠癌组织中的表达特点.广东医学,2007,28:1435-1437.
[5]Schmausser B,Andrulis M,Endrich S,et al.Toll-like receptors TLR4,TLR5 and TLR9 on gastric carcinoma cells:an implication for interaction with Helicobacter pylori.Int J Med Microbiol,2005,295:179-185.
[6]Xie W,Wang Y,Huang Y,et al.Toll-like receptor 2 mediates invasionia activating NF-kappaB in MDA-MB-231 breast cancer cells.Biochem Biophys Res Commun,2009,379:1027-1032.
[7]郭云蔚,李永伟,尉秀清,等.TLR2和TLR4在原发性肝癌中的表达.中国病理生理杂志,2008,24:1912-1915.
[8]Ni JQ,Ouyang Q,Lin L,et al.Role of toll-like receptor 4 on lupus lung injury and atherosclerosis in LPS-challenge ApoE-/-mice.Clin Dev Immunol,2013,2013:476856.
[9]Fukata M,Chen A,Vamadevan AS,et al.Toll-like receptor-4 promotes the development of colitis-associated colorectal tumors.Gastroenterology,2007,133:1869-1881.
[10]Kelly MG,Alvero AB,Chen R,et al.TLR-4 signaling promotes tumor growth and paclitaxel chemoresistance in ovarian cancer.Cancer Res,2006,66:3859-3868.
[11]Pham TN,Hong CY,Min JJ,et al.Enhancement of antitumor effect using dendritic cells activated with natural killer cells in the presence of Toll-like receptor agonist.Exp Mol Med,2010,42:407-419.
[12]Maehara Y,Okuyama T,Kakeji Y,et al.Postoperative immunochemotherapy including streptococcal lysate OK-432 is effective for patients with gastric cancer and serosal invasion.Am J Surg,1994,168:36-40.
[13]Sato M,Harada K,Yoshida H,et al.Therapy for oral squamous cell carcinoma by tegafur and streptococcal agent OK-432 in combination with radiotherapy:association of the therapeutic effect with differentiation and apoptosis in the cancer cells.Apoptosis,1997,2:227-238.
[14]Otto F,Schmid P,Mackensen A,et al.Phase II trial of intravenous endotoxin in patients with colorectal and non-small cell lung cancer.Eur J Cancer,1996,32A:1712-1718.
[15]Razack AH.Bacillus Calmette-Guerin and bladder cancer.Asian J Surg,2007,30:302-309.
[16]Eiró N,González L,González LO,et al.Toll-like receptor-4 expression by stromal fibroblasts is associated with poor prognosis in colorectal cancer.J Immunother,2013,36:342-349.
[17]Li Y,Teo WL,Low MJ,et al.Constitutive TLR4 signalling in intestinal epithelium reduces tumor load by increasing apoptosis in APC(Min/+)mice.Oncogene,2014,33:369-377.
Effect of blocking TLR4 signaling pathway on the growth and apoptosis of tumors of colorectal cancer cell line CT26 implanted in nude mice
He Huixin,Jiang Mengping,Liu Huiling,Jiang Jie,Wei Xiuqing. Department of Gastroenterology,the Third Affiliated Hospital of Sun Yat-sen University,Guangzhou 510630,China
ObjectiveTo investigate the effect of blocking TLR4 signaling pathway on the growth and apoptosis of the tumors of colorectal cancer cell line CT26 implanted in nude mice.Methods Twelve nude mouse models implanted with colorectal cancer cell line CT26 were established and randomly divided into the treatment and control groups.In the treatment group,the animals were injected with CLI-095(3 mg/kg),a TLR4 signaling pathway blocker and those in the control group were injected with the equivalent dose of DMSO.Growth curves of the implanted tumors were measured.Pathological changes of the implanted tumors were observed by HE staining.The apoptosis of the implanted tumors was detected by TUNEL staining.The expression levels of TLR4,cleaved caspase-3 and alternative proteins were determined by Western blot.ResultsMean tumor size in the treatment group was(2.39±0.32)cm3,significantly larger than(1.77±0.25)cm3in the control group(t=3.817,P=0.004).The tumor cells in the treatment group were arranged at a high density and merely partial necrosis was observed,whereas those in the control group were distributed at a low density in disorder and severe necrosis was noted.In the treatment group,the apoptosis index of tumor tissues was(9.86±2.80)%,significantly lower compared with(22.57±4.93)%in the control group(t=-7.091,P<0.001).The expression of TLR4 protein in tumor tissue did not significantly differ between two groups(P>0.05),whereas the expression of cleaved caspase-3 protein in the treatment group was significantly lower than that in the control group.ConclusionBlocking TLR4 signal pathway can inhibit the apoptosis of the tumors of colorectal cancer cell line CT26 impalnted in nude mice and promote the growth of tumors.
Colorectal cancer;TLR4;Apoptosis;Implanted tumor
2014-12-06)
(本文编辑:杨江瑜)

10.3969/g.issn.0253-9802.2015.04.003
国家自然基金面上项目(81470848,81272640)
510630广州,中山大学附属第三医院消化内科
,尉秀清,E-mail:wei-xiuqing@163.com

