布鲁氏菌感染诱发巨噬细胞炎症反应的初步研究
刘娟,孙志华,张静,张豫,刘来珍,李明奇,张辉
(石河子大学动物科技学院/新疆地方与民族高发病教育部重点实验室,石河子 832003)
布鲁氏菌感染宿主细胞需经过黏附、侵入、运输、复制和传播等复杂的步骤[1-4]。布鲁氏菌的抗感染免疫过程主要包括先天性免疫和获得性免疫。天然免疫应答是机体抵御病原生物入侵的第一道防线,也是获得性免疫的基础[5]。因此,天然免疫系统既可以通过诱导吞噬作用和炎症反应等途径对入侵的病原快速识别和清除,还在诱导和激活获得性免疫反应中至关重要。布鲁氏菌通过LPS等PAMPs被宿主细胞表达的PRRs识别进而启动下游信号通路,引起炎症反应[6-7]。NLRP3激活后形成的NLRP3炎症小体是是迄今为止结构和功能最为明确的炎症小体,也是研究最多的一种炎症小体,主要由NLRP3、ASC和caspase-1组成[8]。NRP3炎症小体能被细菌(李斯特杆菌、结核分枝杆菌等)、病毒(腺病毒、流感病毒)激活[6-11],但是目前布鲁氏菌感染与NRP3炎症小体关系还不明确。
本研究通过比较布鲁氏菌侵染宿主前后NLRP3炎症小体相关分子和炎症因子IL-18和IL-1β的表达情况,初步探讨布鲁氏菌感染与炎症小体的相关性,以期为进一步研究布鲁氏菌的胞内存活机制和致炎机制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌株和细胞
牛种布鲁氏菌参考株2308(Brucella abortus 2308)由本实验室保存;小鼠巨噬细胞RAW 264.7细胞株购自中国科学院典型培养物保藏委员会细胞库。
1.1.2 主要试剂
DMEM 培养基、胎牛血清均购自美国Gibco公司;NLRP3、Caspase-1、β-actin引物由华大基因合成;TRIzol购自美国 Invitrogen公司;逆转录试剂盒购自康为世纪;NLRP3抗体购自 abcam公司;Caspase-1抗体和山羊抗兔 IgG均购自Bioworld公司;NC膜购自 Solarbio公司;DAB显色液购自北京中杉金桥生物技术有限公司;小鼠IL-1β/IL-18 ELISA试剂盒购自美国R&D公司。
1.2 方法
1.2.1 牛种布鲁氏菌参考株2308和细胞的培养
将甘油冻存的牛种布鲁氏菌参考株2308菌液在布鲁氏菌无抗平板上进行四分区划线,37℃ 恒温培养3-5 d,挑选单个菌落接种于新鲜的20 mL Brucella Broth培养基中,37℃摇床,180 r/min培养至OD600=0.4,再取20μL菌液转接于20 mL Brucella Broth培养基,37℃摇床,180 r/min培养至OD600=1.0~1.5,备用。
将液氮中冻存的小鼠巨噬细胞RAW 264.7取出后迅速投入到37℃水浴中使其快速融化,吸取细胞悬液于新的预先加入3-5 mL含10%FBS的DMEM培养液的15 mL离心管中,充分吹打混匀,800 r/min离心5 min,弃去上清培养液,用含10%FBS的DMEM 培养液重悬细胞沉淀,37℃,5%的CO2湿润条件下培养细胞,每24 h更换培养液一次,培养3-5 d。
1.2.2 布鲁氏菌侵染小鼠巨噬细胞RAW 264.7模型建立
将培养的细胞接种至6孔板,细胞生长至对数期,弃去细胞培养液,PBS洗涤缓冲液清洗细胞3次,每孔加入2 mL新鲜的含10%FBS的 DMEM培养液,用细胞计数板对细胞进行计数。纯化培养的牛种布鲁氏菌参考株2308以100∶1(细菌∶细胞)的比例进行侵染模型的建立,阴性对照加入等体积的PBS,侵染1 h后,弃去细胞培养液,预冷的无菌PBS缓冲洗涤液润洗细胞3次,加入新鲜的细胞培养液,同时加入庆大霉素(2.5μL/孔/mL)继续培养45 min,以杀死胞外菌,弃去细胞培养液,预冷的无菌PBS缓冲洗涤液润洗细胞3次,加入新鲜的细胞培养液继续培养,分别在4、12、24和48 h取上清和细胞沉淀备用。
1.2.3 RT-PCR检测RAW 264.7细胞中NLRP3和Caspase-1的表达水平
分别在侵染4、12、24和48 h时,弃去细胞培养,预冷的PBS洗涤缓冲液润洗细胞3次,每孔加入1 mL TRIZOL,用移液器反复吹打细胞,使裂解液与细胞充分接触,冰上放置10 min,按TRIZOL法提取侵染细胞总RNA,微量紫外分光光度计检测其浓度和纯度,按反转录试剂盒逆转录20 uL体积的cDNA产物。利用 Premier 6.0设计引物(表1),通过RT-PCR检测 NLRP3炎症小体信号通路相关分子的 mRNA表达,以内参β-action做对照。

表1 基因引物序列Tab.1 Primers sequences of gene
1.2.4 Western blot检测 RAW 264.7细胞中NLRP3和Caspase-1的表达水平
分别在侵染4、12、24和48 h时,弃去细胞培养,预冷的PBS洗涤缓冲液润洗细胞3次,每孔加入200μL含1%PMSF的非变性组织裂解液,冰上放置10 min,细胞刮刀收集裂解后样品于心的1.5 mL离心管中,4℃,13000 r/min离心 15 min,上清即为蛋白样品。利用BCA蛋白定量试剂盒检测浓度,并调整各个时间段的样品浓度至同一水平,然后进行SDS-PAGE垂直电泳检测。恒流200 mA,1 h后采用半干湿转膜仪将凝胶上的蛋白转印至NC膜上,37℃封闭1 h。TBST洗3次,每次10 min,然后加入一抗稀释液中,4℃ 孵育过夜,TBST洗3次,每次10 min。再加二抗孵育1 h,TBST洗3次,每次10 min,DAB显色,扫描保存图像。
1.2.5 ELISA检测炎性因子IL-1β和IL-18的释放量
分别收集布鲁氏菌侵染RAW 264.7细胞4、12、24和48 h后的细胞上清,0.22μm的滤膜过滤后3000 g离心10 min,若在短时间内进行ELISA检测,-4℃冰箱中保存即可;否则应在-20或-80℃冷冻保存备用。通过RD公司的小鼠IL-1β/IL-18 ELISA试剂盒进行检测,具体步骤参照试剂盒说明书。
2 结果与分析
2.1 RAW 264.7巨噬细胞总RNA的提取结果
提取布鲁氏菌侵染小鼠巨噬细胞后总RNA,1%的变性琼脂糖电泳检测可以清楚的看到28S、18S和5.8S三条带(图1),说明RNA质量很好。
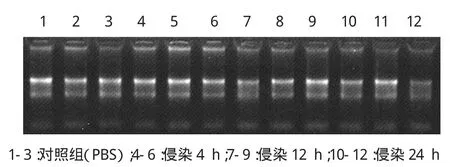
图1 布鲁氏菌侵染后总RNA提取Fig.1 Total RNA of Brucella post-infection
2.2 NLRP3和 Caspase-1 mRNA的表达检测
RT-RCR的结果(图2)显示,在不同的时间点,侵染组细胞的 NLRP3和Caspase-1 mRNA的表达与对照组均存在差异(P<0.05),其中侵染组细胞NLRP3在4、12和24 h mRNA的表达量均高于正常对照组,但48 h出现下降;而Caspase-1在4、12和24 h表达量均高于正常对照组,在48 h时出现下降,且Caspase-1 mRNA表达在12 h时达到最高水平。
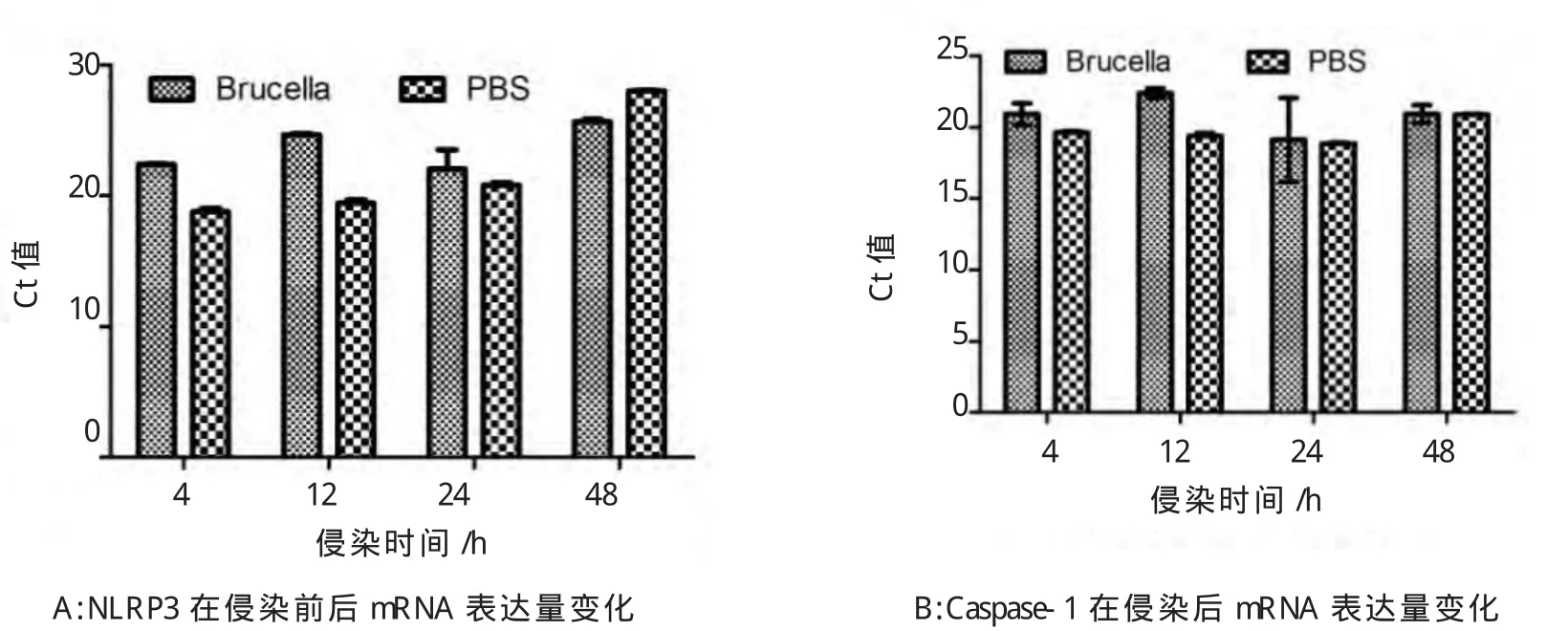
图2 布鲁氏菌侵染后NLRP3和Caspase-1mRNA表达量Fig.2 The mRNA expression of NLRP3 and Caspase-1 after Brucella infection
2.3 Western blot检测
采用半干湿转膜法进行炎症小体相关蛋白NLRP3和 Caspase-1表达水平检测,结果见图3。

图3 小鼠 RAW 264.7巨噬细胞NLRP3和Caspase-1蛋白表达Fig.3 The protein expression of NLRP3 and Caspase-1
图3显示,布鲁氏菌侵染 4、12、24和 48 h后小鼠巨噬细胞中NLRP3和Caspase-1蛋白表达量与对照组相比出现不同程度的升高。
2.4 炎症因子IL-1β和IL-18 ELISA检测
采用ELISA法检测细菌在不同的时间点侵染细胞后上清中IL-1β和IL-18含量,结果(图4)显示,牛种布鲁氏菌2308株侵染RAW264.7小鼠巨噬细胞后细胞因子IL-1β在4、12、24和48 h时含量均显著高于对照组,且在12 h时达到最高水平。
与对照组相比,牛种布鲁氏菌侵染组细胞因子IL-18的含量在不同的时间点均显著升高,且在24 h时达到最高水平(图5),差异具有统计学意义(P<0.05)。
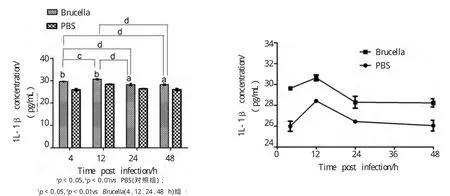
图4 小鼠巨噬细胞炎性因子IL-1β的变化Fig.4 Level of pro-inflammatory cytokines IL-1βin RAW 264.7 cells
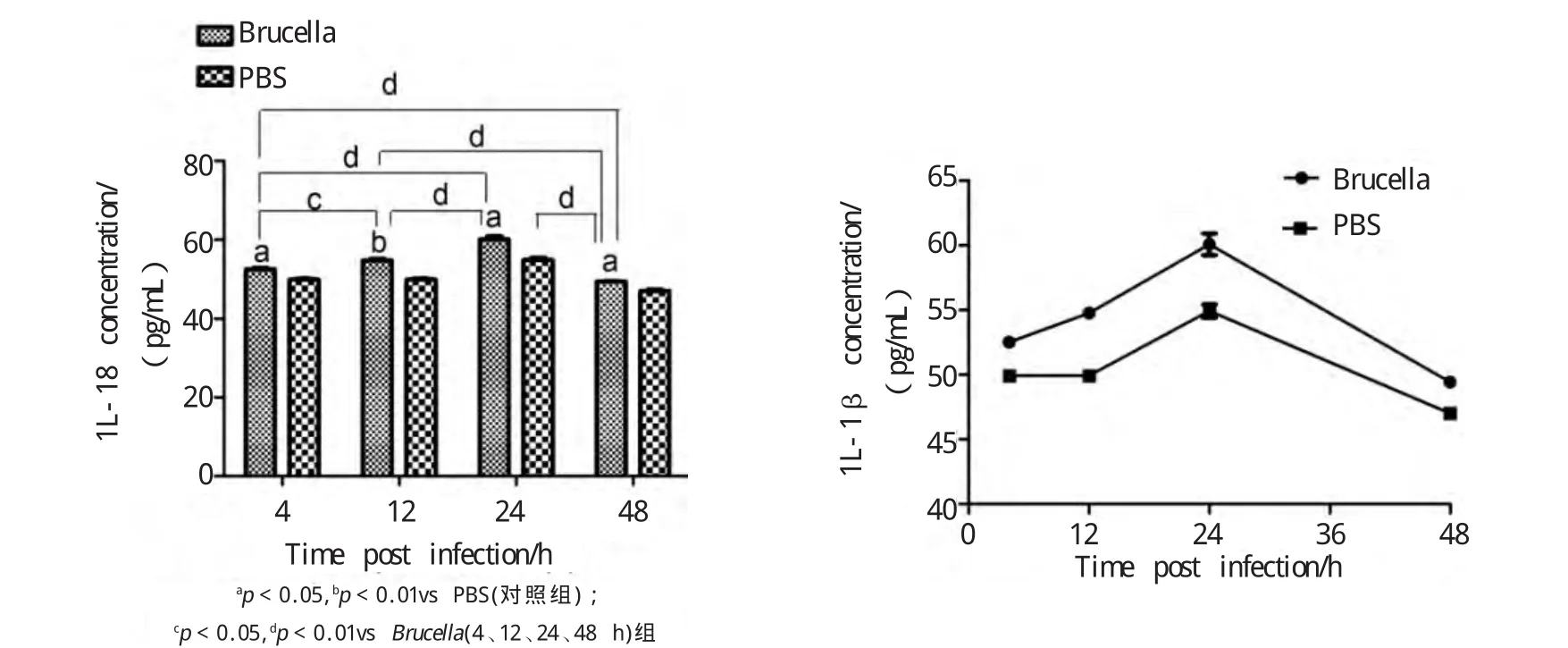
图5 小鼠巨噬细胞炎性因子IL-18的变化Fig.5 Level of pro-inflammatory cytokines IL-18 in RAW 264.7 cells
3 讨论
天然免疫应答在抵御病原微生物早期感染及顺利启动适应性免疫应答过程中至关重要。巨噬细胞和单核细胞均能快速识别病原菌的入侵,进而释放大量的促炎因子,引发炎症反应,固有免疫在布鲁氏菌的感染过程中发挥着重要的作用。本实验研究布鲁氏菌感染与细胞炎症小体间的关系,可为进一步的研究布鲁氏菌的致病机理提供理论基础。
(1)固有免疫系统模式识别受体共有四类,即TLR、NLR(NOD样受体),CLR(凝集素样受体)和RLR(解旋酶样受体),其中TLR和 NLR是识别病原微生物并诱导炎症的受体[12]。NLRP3炎症小体是识别配体并诱发慢性炎症反应的关键,NLRP3主要表达于嗜中性粒细胞、单核巨噬细胞和一些初级免疫细胞中,主要分布在细胞间质及细胞膜中[13]。存在于胞内的部分NLR激活后形成巨大的蛋白复合体“炎症小体”,激活 caspase-1,进而对 IL-1β 和 IL-18等炎症因子的前体形式进行切割,使其成熟并释放至胞外,引起炎症反应[14]。NLRP3炎性小体是迄今为止结构和功能最为明确的炎性小体,主要由 NLRP3、ASC和 caspase-1共同组成[15-16]。本研究证实布鲁氏菌感染同其他胞内寄生菌一样都可以激活NLRP3炎症小体,与多种病原微生物,特别是兼性胞内寄生菌的分子机制相同[6-7,17]。
(2)炎症小体活化所介导的促炎因子的产生及细胞死亡与机体抵御病原微生物感染、维持自身稳态密切相关。病原微生物感染宿主后,炎症小体被活化,产生IL-1β和IL-18等促炎因子介导炎症发生,但是炎症反应在清除微生物感染的同时会导致组织损伤,所以机体需及时进行负调控,抑制促炎因子过度产生,维持机体的正常生理功能。IL-1β和IL-18是重要的炎性细胞因子,与天然免疫防御的起始、加强等至关重要。IL-1β在炎症引起的发热方面发挥着重要的生物学功能,是机体对抗病原微生物入侵、炎症反应、免疫应答和组织损伤的重要物质,在机体内外均可诱导二级细胞因子(如IL-6、趋化因子)的产生[18]。IL-18是研究发现的第一种内毒素诱导因子,可诱导IFN-γ的产生,还具有诱导其他促炎性细胞因子和增强NK细胞黏附分子活性等功能[19-20]。因此,本研究中通过检测IL-1β和IL-18等促炎因子的表达量来确定布鲁氏菌感染与炎症小体的关系。
4 结论
本研究证实布鲁氏菌侵染巨噬细胞后NLRP3和caspase-1的 mRNA和蛋白均显著增加,同时 IL-1β和 IL-18的含量也显著升高,布鲁氏菌感染可激活NLRP3炎症小体。这将为布鲁氏菌感染引发的炎症反应和致病分子机制提供理论基础。
[1]纪太旺,张辉,郭飞,等.布鲁氏菌043强毒株BR0524基因缺失突变株的构建与毒力的初步评价[J].石河子大学学报:自然科学版,2014,32(5):529-536.JI Taiwang,ZHANG Hui,GUO Fei,et al.Construction and preliminary evaluation of virulence of BRO524 gene deletionBrucella melitensis043 strain[J].Journal of Shihezi University:Nature Science,2014,32(5):529-536.
[2]张豫,张辉,张艳,等.布鲁氏菌磷酸葡萄糖变位酶基因的原核表达与鉴定[J].石河子大学学报:自然科学版,2013,31(1):35-39.ZHANG Yu,ZHANG Hui,ZHANG Yan,et al.Expression and identification of phosphoglucomutase gene of Brucella[J].Journal of Shihezi University:Nature Science,2013,31(1):35-39.
[3]Corbel M J.International committee on systematic bacteriology subcommittee on the taxonomy of Brucella[J].Int J Syst Bacteriol,1988,38:450-452.
[4]Benkirane A.Ovine and caprine brucellosis:world distribution and control eradication strategies in West Asia/North Africa region[J].Small Ruminant Research,2006,62:19-25.
[5]蒋建烨,刘胜,罗晶晶,等.NLRP3炎症小体及下游分子在幽门螺旋杆菌感染小鼠的表达[J].细胞与分子免疫学杂志,2013,29(8):785-793.JIANG Jianye,LIU Sheng,LUO Jingjing,et al.The Expression of inflammatory corpuscle NLRP3 and its downstream molecules in the mouse model of helicobacter pylori infection[J].Journal of Cellular and Molecular Immunology,2013,29(8):785-793.
[6]雷国伟,毛立明,李华,等.炎症小体在对抗微生物感染中的作用[J].中国细胞生物学学报,2011,33(12):1301-1315.LEI Guowei,MAO Liming,LI Hua,et al.The role of inflammation in the fight again stmicrobial infection[J].Chinese Journal of Cell Biology,2011,33(12):1301-1315.
[7]Fukata M,Vamadevan A S,Abreu M T.Toll-like receptors(TLRs)and Nod-like receptors(NLRs)in inflammatory dissorders[J].Semin Immunol,2009,21(4):242-253.
[8]Lamkanfi M,Kanneganti T D.Nlrp3:an immune sensor of cellular stress and infection[J].Int J Biochem Cell Biol,2010,42(6):792-795.
[9]方潮,王中新,胡元生,等.弓形虫感染与NLRP3炎症小体相关性的初步研究[J].安徽医科大学学报,2012,47(12):1381-1384.FANG Chao,WANG Zhongxin,HU Yuansheng,et al.The preliminary study of correlation btweenToxoplasma gondiiinfection and NLRP3 inflammasome[J].Journal of Anhui Medical University,2012,47(12):1381-1384.
[10]TING J P,Willingham S B,Bergstralh D T.NLRs at the intersection of cell death and immunity[J].Nat Rev Immunol,2008,8(5):372-379.
[11]于馨,张彩.炎症小体信号通路的负调控[J].生物化学与生物物理进展,2014,41(1):87-95.YU Xin,ZHANG Cai.Negative regulation of inflammation signaling pathways[J].Progress in Biochemistry and Biophysics,2014,41(1):87-95.
[12]Koval'chuk D V,Khoreva M V,Nikonova A S.Recognition receptors of innate immunity(NLR,RLr and CLR)[J].Zh Mikrobiol Epidemiol Immunobiol,2011,1:93-100.
[13]Dostert C,Petrilli V,Van Bruggen R,et al.Innate immune activation through Nalp3 in flammasome sensing of asbestos and silica[J].Science,2008,320(5876):674-677.
[14]毛开睿,孙兵.NLRP3炎症小体研究进展[J].现代免疫学,2011,31(1):1-4.MAO Kairui,Sun Bing.Research progress of NLRP3 inflammatory corpuscle[J].Journal of Modern Immunology,2011,31(1):1-4.
[15]Cook G P,Savic S,Wittmann M,et al.The NLRP3 inflammasome,a target for therapy in diverse disease states[J].Eur J Immunol,2010,40(3):631-634.
[16]Vandanmagsar B,Youm Y H,Ravussin A,et al.The NLRP3 in-flammasome instigates obesity-induced inflammation and insulin resistance[J].Nat Med,2011,17(2):179-188.
[17]陈鹏博,张亚丽,王远志,等.NLRP3炎症小体在牛种布鲁氏菌2308和RB51侵染人巨噬细胞THP-1过程中作用的初步研究[J].石河子大学学报:自然科学版,2014,32(4):427-433.CHEN Pengbo,ZHANG Yali,WANG Yuanzhi,et al.The preliminary study in role in the process of NLRP3 inflammatory corpuscle in Brucella 2308 and RB51 infect people macrophages THP-1[J].Journal of Shihezi University:Nature Science,2014,32(4):427-433.
[18]Fantuzzi.Lessons from interleukin-deficient mice:the interleukin-1 system[J].Acta Physiol Scand,2001,173(1):5-9.
[19]Gracie J A,Robertson S E,McInnes I B.Interleukin-18[J].J Leukoc Biol,2003,73(2):213-224.
[21]Abdelaziz D H,Gavrilin M A,Akhter A,et al.Apoptosisassociated speck-like protein(ASC)controlsLegionella pneumophilainfection in human monocytes[J].J Biol Chem,2011,286(5):3203-3208.

