姬菇菇脚对红曲霉菌丝生长和产色素的影响
苗玉志, 任 尧, 李 维, 葛方兰
(四川师范大学 生命科学学院,四川 成都 610101)
红曲色素是由红曲霉(Monascus spp.)经发酵产生的天然安全食用色素[1-2],具有色泽鲜红、着色力强、稳定性好、口味自然等优点,能抑菌[3]、抗氧化[4]、抑制脂肪酶活性[5]、调节血脂[6]、抗肿瘤[7-8]等功能,已被广泛应用于各种食品[9-10]。传统的红曲色素多以大米为底物发酵生产,其成本相对较高。近年来,为减少环境污染和降低生产成本,各种农业副产物已被广泛应用于发酵工业[11-12]。在红曲色素的生产方面,同样开展了以低廉的玉米芯[13]、甘蔗渣[14]、葡萄渣[15]、土豆粉[16]等为底物的发酵实验,而以姬菇菇脚为底物进行红曲色素的生产经检索国内外尚无报道。
姬菇菇脚是姬菇(Pleurotus cornucopiae)[17]在采收和加工过程中产生的农业副产物。我国姬菇栽培量大,仅就四川金堂县每年栽培规模就达3.9亿袋,总产量为31.6万t,产值12亿元[18],而姬菇菇脚占整个鲜菇质量的9%左右,目前菇脚基本上按垃圾废弃物处理,造成一定程度上的环境污染和资源的极大浪费。同时,菇脚同其子实体一样富含多种营养成分[19-20],具有极高的使用价值。作为农业废弃物的姬菇菇脚,如果能够用来发酵生产红曲色素,不仅可以降低生产成本,解决废弃菇脚所造成的环境污染,同时也可为菇脚变废为宝开辟新的途径。
作者以姬菇菇脚为底物通过平板培养和液态发酵探究了姬菇菇脚对紫红曲霉MR02菌丝生长及红曲色素生产的影响,以评估姬菇菇脚是否适合作为底物用于红曲色素的发酵生产,所得结果可为以姬菇菇脚为底物生产红曲色素的培养基配方及发酵工艺优化提供依据。
1 材料与方法
1.1 材料与试剂
菌种:紫红曲霉MR02(Monascus purpureous MR02):作者所在实验室分离鉴定并保存;姬菇菇脚:收集于成都市金堂县清江镇姬菇种植基地。收集后经清洗、风干、粉碎成粉备用;NaNO3、KH2PO4、MgSO4:分析纯;乳酸:食品级。
1.2 仪器与设备
TH-1901型紫外可见分光光度计:北京普析通用仪器公司;DNP-9082型电热恒温培养箱:上海精宏公司;DHG-9140型电热恒温鼓风干燥箱:上海鸿都公司;IS-RSV1型恒温振荡器:上海珂淮仪器公司;JD200-3电子天平:南北设备集团;1850R超速离心机:上海博翔公司。
1.3 方法
1.3.1 培养基配制 普通培养基:大米粉质量分数3%、NaNO3质量分数 0.5%、KH2PO4质量分数0.15%、MgSO4质量分数 0.1%、pH 5.5~6.0(乳酸调)、平板添加琼脂粉质量分数1.8%;菇脚培养基:普通培养基+质量分数6%的菇脚;液体培养基:按照试验设计配制。所有培养基在121℃下灭菌20 min。
1.3.2 培养方法
1)平板培养:从母种斜面上接约0.5 cm2菌块到活化平板上,30℃恒温培养5 d,得到活化菌种,从活化平板上分别接约0.5 cm2圆形菌块到普通平板和菇脚平板上,30℃恒温培养,用于测定菌落直径。
2)发酵摇瓶培养:用10 mL无菌水洗出1管活化斜面菌种接到种子培养基中,30℃、150 r/min培养72 h,得到种子液。以8%的接种体积分数分别接种到装有80 mL液体培养基的250 mL三角瓶中培养,测定发酵液生物量和发酵液色素产量。
1.3.3 测定方法
1)平板菌丝增殖速率测定[21]:每天测定普通平板和菇脚平板上的菌落直径,直至第10天。作3个平行试验,取平均值。
2)菌体生物量测定[18]:吸10 mL发酵液真空抽滤得到菌丝体,用蒸馏水洗菌体,去净底物成分,所得菌体用180 W微波干燥15 min,然后在干燥器中冷却15 min,反复干燥至恒重后称量。
3)色素色价测定[20-21]:取发酵液 10 mL,再加入体积分数75%的乙醇90 mL,静置浸提4 h,浸提完毕后用滤纸过滤。滤液再以体积分数75%的乙醇稀释适当倍数后,以体积分数75%的乙醇作空白对照,用分光光度计法,在505、420 nm下测吸光度值,发酵液总色价(U/mL)为:(OD505+OD420)×稀释倍数。
1.4 菌丝平均增殖速率的计算
式中,dt为第t天时的菌落直径 (mm);d0为刚接种时的菌落直径(mm)。
2 结果与分析
2.1 平板培养时姬菇菇脚对菌丝生长的影响
将紫红曲霉MR02分别接种在普通平板和姬菇菇脚平板培养基中进行菌丝体增殖和产色能力培养,不同培养时间下菌丝增殖结果见表1。培养到第10天时的菌落和背面色泽见图1。
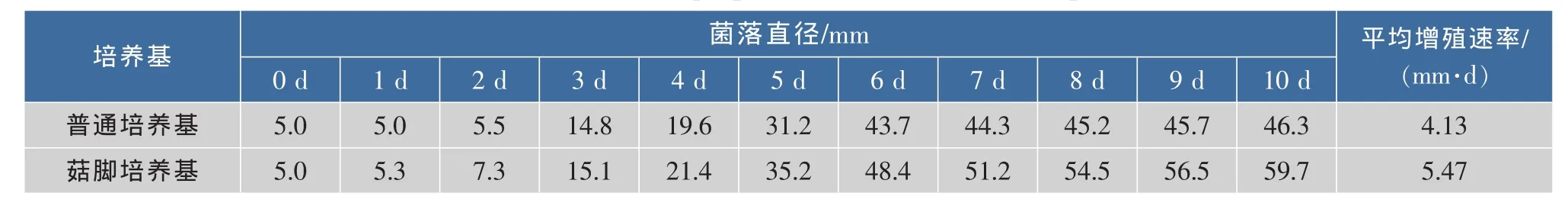
表1 不同平板培养基中紫红曲霉MR02的菌丝增殖速率Table 1 Growth rate of M.purpureous MR02 in different plate medium
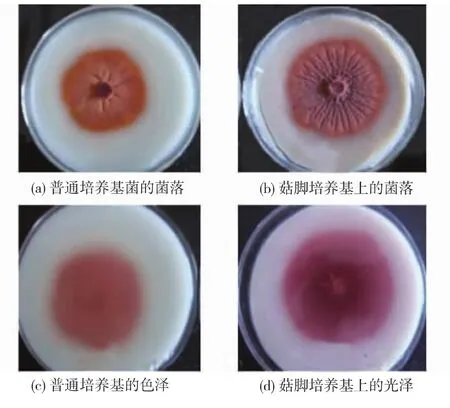
图1 普通培养基和菇脚培养基上的菌落和色泽Fig.1 Colony and color in general medium and P.cornucopiae stembase medium
由表1可知,紫红曲霉MR02在普通平板上菌丝生长相对较慢,接种后的第2天才开始生长,第6天后菌丝增殖速率明显放缓,培养到第10天时,菌落直径为46.3 mm,平均增殖速率为4.13 mm/d。由于在菇脚平板培养基中添加菇脚,改善了培养基的营养组分,接种后菌丝体仅需很短时间来适应,在第1天就开始生长,持续增殖直到第10天,第10天时菌落直径为59.7 mm,平均增殖速率为5.47 mm/d,同比菌落直径增大了28.9%。
图1显示,普通平板培养基上的菌落明显比菇脚平板培养基上的小,菌丝生长缓慢,长势不好,并且菌落中央有菌丝体老化(图1 a),而在菇脚平板培养基上菌丝长势良好,菌块中央无菌丝体老化(图1 b)。从平板背面的色素圈大小和颜色来看,在普通平板培养基上的色素圈小且颜色较浅 (图1 c),在菇脚平板培养基上的色素圈明显较大且颜色较深(图1 d)。因此,在普通平板培养基中添加姬菇菇脚能够提高紫红曲霉MR02菌丝体的增殖速度和产色素能力。
2.2 液体培养时菇脚对菌体形态和产色素的影响
紫红曲霉MR02摇瓶发酵时,菌丝体主要以菌丝球的形式存在,而菌丝球的大小及结构对代谢产物合成有较大的影响[25]。在分别以普通液体培养基和添加质量分数6%的菇脚液体培养基中接种体积分数8%的紫红曲霉MR02,在30℃、150 r/min的条件下培养192 h,测定菌丝球的外形尺寸,菌丝体生物量和发酵液色价结果见表2和图2。
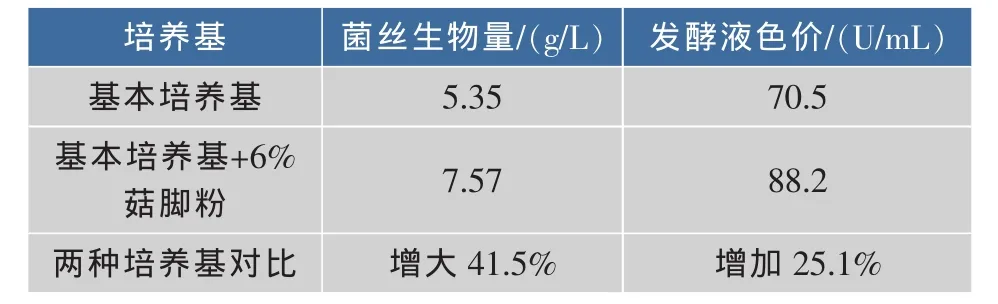
表2 紫红曲霉MR02在两种培养基中的发酵特点Table 2 Characters of M.purpureous MR02 shake flasks fermentation in two medium
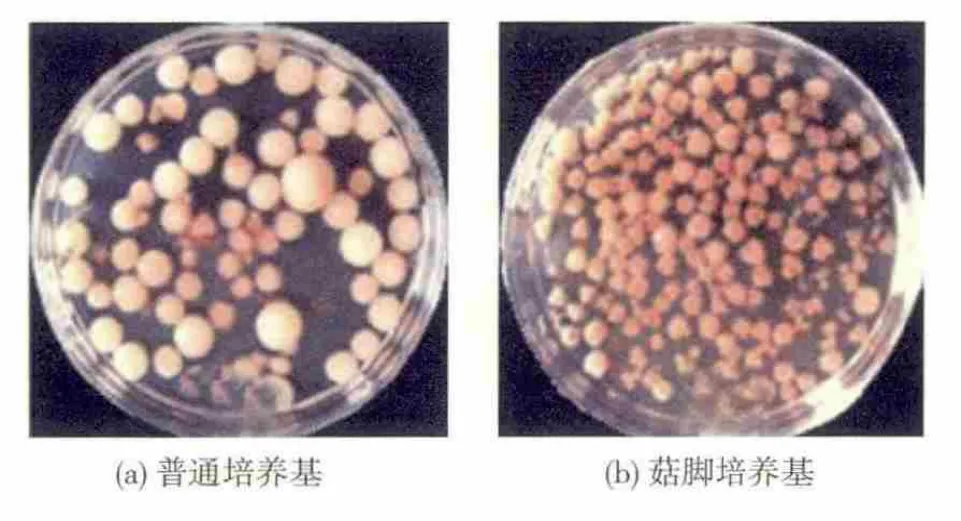
图2 紫红曲霉MR02在普通培养基和菇脚培养基中的菌丝体形状Fig.2 Mycelial pellets of M.purpureous MR02 in general and P.cornucopiae stembase fermention medium
由表2可知,紫红曲霉MR02在菇脚液体培养基中的菌丝体生物量比在普通液体培养基中增加了41.5%,发酵液色价提高了25.1%。由图2可知,在普通液体培养基(图2a)中菌丝球直径较大,数量较少,发酵液颜色较淡,这是由于在发酵后期,发酵液营养不足造成了菌丝自溶的出现。而在添加有6%的姬菇粉液体培养基中(图2b),在发酵后期菌丝球直径较小,数量较多,发酵液颜色较深,这是因为菇脚的添加使得发酵液营养较充足,能够继续维持菌丝体的生长,从而延长发酵时间,促进色素更多的合成,最终提高了色素产量。
2.3 以菇脚为底物的培养对菌丝体生物量和产色素的影响
大米是红曲色素生产中的最佳底物,但其成本较高,基于产量和生产成本的考虑,作者采用大米和姬菇菇脚为底物进行实验。在分别添加质量分数为0%、1%、2%、3%的大米粉和质量分数0%、3%、6%、9%、12%的菇脚发酵培养液中,接种体积分数8%的紫红曲霉MR02,在30℃、150 r/min培养192 h,测得的菌丝体生物量色素产量见图3。
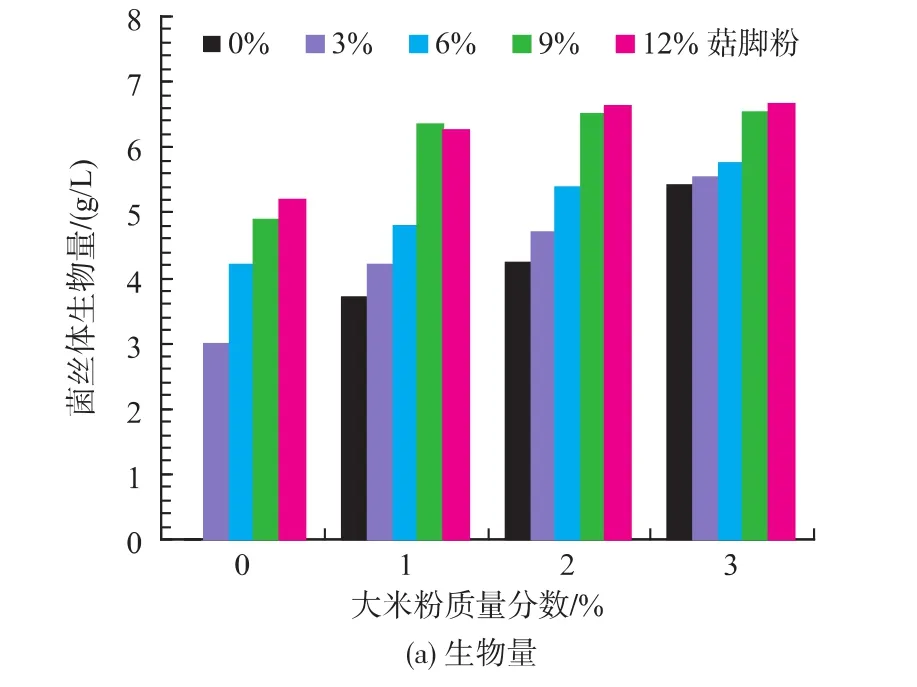
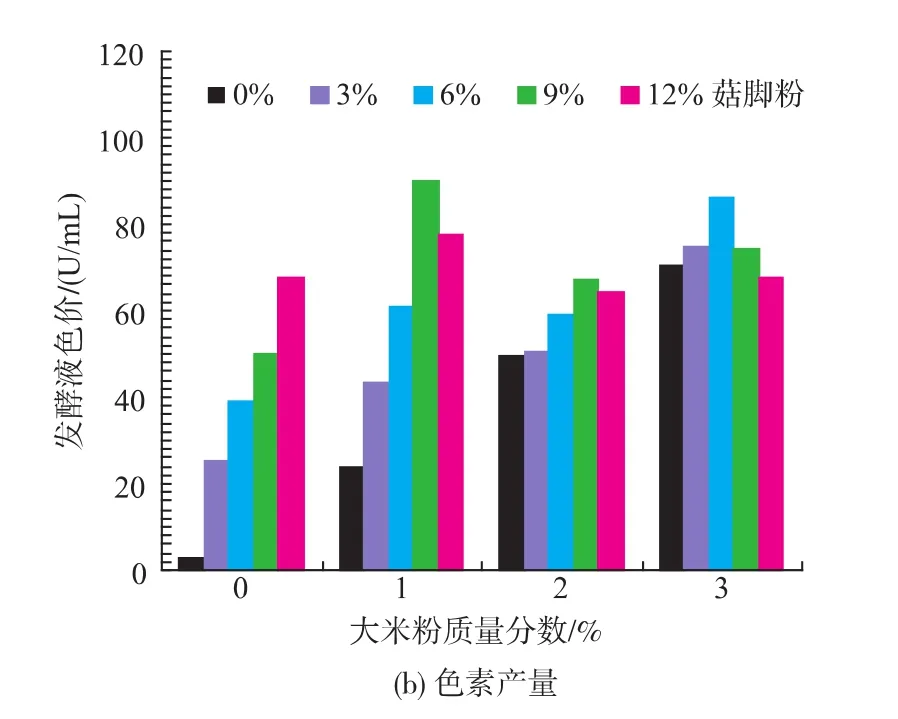
图3 大米和菇脚用量对生物量和色素产量的影响Fig.3 Effect of P.cornucopiae stembase and rice doses on biomass and pigment yield
图3结果显示,以不同配比的菇脚和大米为底物培养紫红曲霉MR02时,对菌丝体生物量和色素产量均有显著影响。可以看出,所有以姬菇菇脚和大米为共同底物培养的菌丝体生物量和色素产量均比以单一姬菇菇脚或大米为底物的产量要高。在大米粉质量分数为3%的不同菇脚配比中,在菇脚质量分数为6%的发酵液中色素产量最大,为85.97 U/mL,而菇脚质量分数为12%时,发酵液菌丝体生物量最大,为6.65 g/L;而在所有配比中,大米粉质量分数为1%和菇脚质量分数为9%的发酵液中,色素产量最大,为90.1 U/mL。同时在仅以姬菇菇脚为底物培养紫红曲霉MR02时,虽然菌丝体生物量和色素产量明显低于以大米粉和姬菇菇脚为共同底物的培养,但有不同数量的菌丝体和红曲色素产生,尤其以质量分数12%菇脚为底物培养192 h的菌丝体的生物量和色素产量最高,分别为5.21 g/L和67.5 U/mL,这一结果也表明,只以姬菇菇脚为底物加适量的氮素和营养盐能够用于培养紫红曲霉MR02生产红曲色素。
2.4 菇脚对紫红曲霉MR02生长动力学的影响
在分别以普通培养基、添加质量分数6%菇脚的普通培养基以及质量分数12%纯菇脚液体培养基中接种体积分数8%的紫红曲霉MR02,在30℃、150 r/min的条件下培养,通过测定在不同培养时间下的菌丝体生物量和色素产量来评估姬菇菇脚对紫红曲霉MR02的生长动力学影响,菌丝生长和色素生产特性曲线见图4。
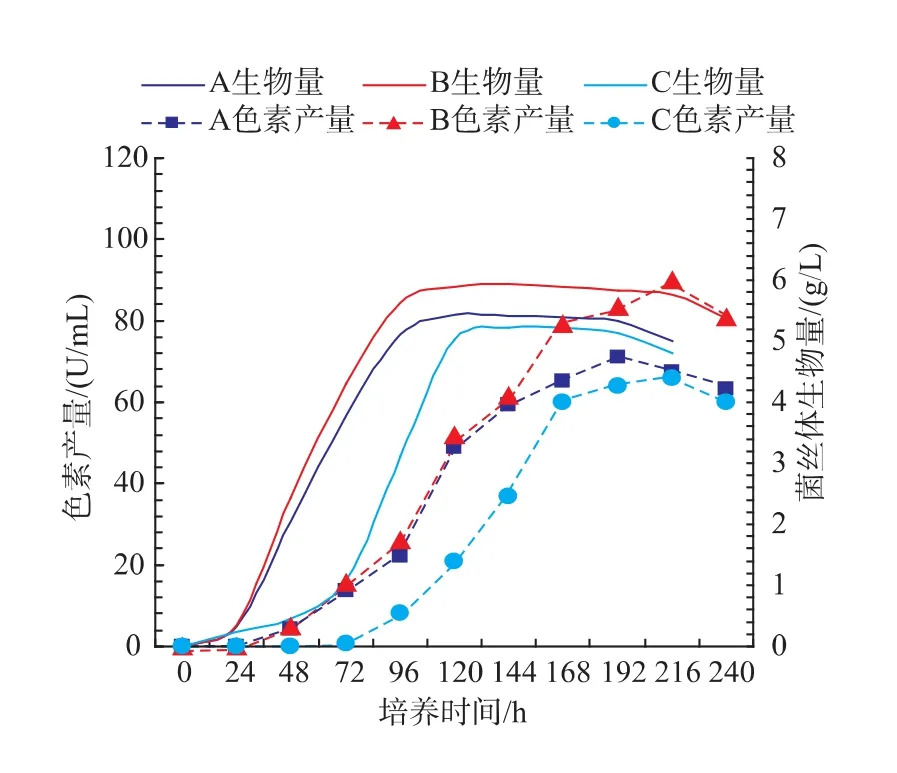
图4 紫红曲霉MR02在不同液体培养基中的生长和产色曲线图Fig.4 Curves ofgrowth and pigmentyield of M.purpureous MR02 in different liquid medium
从图4可知,紫红曲霉MR02在这三种液体培养基中的生长特性虽然都符合多细胞生物的生长曲线规律,但是其菌丝体生物量和色素产量随培养基底物的不同而变化趋势明显。在添加6%菇脚的普通液体培养基中,紫红曲霉MR02完成对数生长期所需时间为72 h,稳定期持续了96 h,菌丝体生物量和色素产量也相对最高;在普通液体培养基中,虽然紫红曲霉MR02完成对数生长期所需时间同样为72 h,但由于营养组分的差异,其稳定期只维持了72 h,菌丝体生物量和红曲色素产量相对较低;而在只以姬菇菇脚(12%)为底物的液体培养基中,紫红曲霉MR02完成对数生长期所需时间为120 h,稳定期仅仅维持了48 h,而菌丝体生物量和红曲色素产量最少。如果将姬菇菇脚作为底物培养紫红曲霉MR02生产红曲色素,会出现生产周期长、色素产量低等问题,因而需要对其培养基组分进行优化实验。
2.5 菇脚质量分数对菌丝体生物量和产色素的影响
在以质量分数6%、9%、12%、15%的菇脚为底物,接种体积分数8%的紫红曲霉MR02,在30℃、150 r/min,经不同时间培养后测定的紫红曲霉MR02的菌丝体生物量和色素产量见图5。
从图5可知,在以不同菇脚为底物的发酵液中,紫红曲霉MR02在接种后第24小时开始生长,直到第120小时菌丝体生物量达最大,而后进入稳定期,在第192小时后菌丝体生物量开始降低。同时,自第72小时开始,发酵液缓慢变红,开始产生红曲色素,直到发酵的第216小时达到最大,不论是从最大菌丝体生物量和最高色素产量获得的时间来看,都比采用大米和菇脚为共同底物的培养明显延后。同时,菌丝体生物量和发酵液色价与菇脚质量分数具有明显的相关性,在以6%的菇脚为底物的发酵液中,其生物量和色素色价明显较低;在分别以9%、12%和15%的菇脚为底物的培养液中,生物量相对较高并非常接近。在菇脚质量分数为12%时,培养到第144小时,具有最大的生物量,为5.52 g/L,而在培养到第216 h,具有最大的红曲色素产量,为72.92 U/mL。
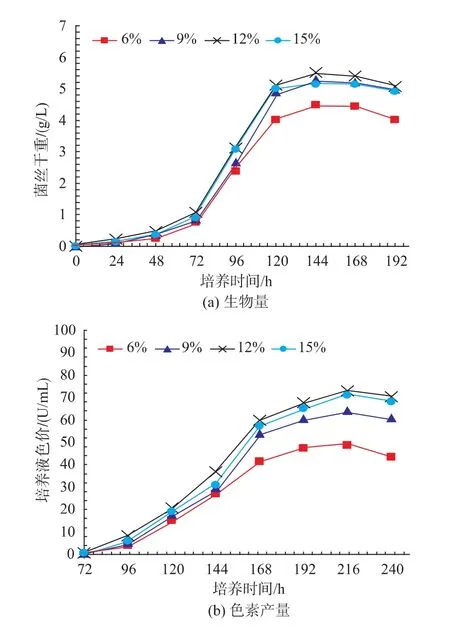
图5 不同质量分数菇脚对紫红曲霉MR02的生物量和色素产量的影响Fig.5 Effect of stembase concentrations on biomass and pigment yield of M.purpureous MR02
3 结语
在普通培养基中添加质量分数6%的菇脚粉,通过平板培养紫红曲霉MR02后,其平均增殖速率为5.47 mm/d,培养10 d后菌落直径与在普通培养基上相比增大了28.9%,通过液体培养紫红曲霉MR02后,菌丝生物量增加41.5%,发酵液色价同比提高25.1%。
分别以不同质量分数菇脚和大米的配比为底物培养紫红曲霉MR02时,虽然以菇脚为单一底物的培养明显低于以大米粉或大米和菇脚为共同底物的培养,但均有不同数量的菌丝体生物量和红曲色素产生,在以12%菇脚为底物培养192 h时,菌丝体生物量和色素产量分别为5.21 g/L和67.5 U/mL,这表明只以姬菇菇脚为底物能够用于培养紫红曲霉MR02生产红曲色素。
在只以姬菇菇脚为底物培养紫红曲霉MR02的生长曲线符合多细胞生物的生长曲线规律,但其对数生长期较长,稳定期较短,从而使得紫红曲霉MR02的菌丝体生物量和红曲色素生成量明显低于以大米或大米和姬菇菇脚为共同底物培养的产量。
在以不同质量分数的菇脚为底物对紫红曲霉MR02进行培养,不同用量的菇脚发酵产生不同的菌丝体生物量和色素产量,最大产量在姬菇菇脚质量分数为12%,培养到第144小时的生物量(5.52 g/L)和培养到第216小时的红曲色素 (72.92 U/mL)。这表明菌丝体生物量和红曲色素产量与菇脚底物质量分数具有明显的相关性,因而需要对姬菇菇脚促进红曲霉菌的生长和产色机理以及培养基组分进行全面优化实验。
因此,以紫红曲霉MR02为出发菌株,以姬菇菇脚为底物发酵生产红曲色素是切实可行的。下一步拟对用姬菇菇脚为底物发酵生产红曲色素的培养基组分和发酵条件进行优化,有望进一步提高以姬菇菇脚为底物发酵生产红曲色素的色价,为工业化利用姬菇菇脚生产红曲色素提供技术支持。
[1]Mohan Kunari H P,Akhilender Naidu,Vishwanath S,et al.Safety evaluation of Monascus purpureus red mould rice in albino rats[J].Food and Chemical Toxicology,2009,47(8):1739-1746.
[2]曹岚,杨旭.红曲的应用及安全性分析[J].酿酒科技,2008,168(6):89-91.CAO Lan,YANG Xu.Application of monascus&analysis of its safety[J].Liquor-Making Science&Technology,2008,168(6):89-91.(in Chinese)
[3]Chi D P,Hyuck J J,Hang W L,et al.Antioxidant activity of monascus pigment of Monascus purpureus P-57 mutant[J].The Korean Journal of Microbiology,2005,41(2):135-139.
[4]徐伟,范志诚,马思慧.柱层析分离红曲色素及其组分的抑菌性对比[J].酿酒,2010,37(6):49-52.XU Wei,FAN Zhicheng,MA Sihui.Separation of monascus pigments by column chromatography and inhibition comparison of isolated components[J].Liquor Making,2010,37(6):49-52.(in Chinese)
[5]Kim J H,Kim H J,Kim C,et al.Development of lipase inhibitors from various derivatives of monascus pigment produced by monascus fermentation[J].Food Chemistry,2007,101(1):357-364.
[6]Jeun J,Jung H,Kim J H,et al.Effect of the Monascus pigment threonine derivative on regulation of the cholesterol level in mice[J].Food Chemistry,2008,107(3):1078-1085.
[7]Akihisa T,Tokuda H,Ukiya M,et al.Antitumorinitiating effects of monascin,an azaphilonoid pigment from the extract of Monascus pilosus fermented rice (red-mold rice)[J].Chemistry Biodiversity,2005,2(10):1305-1309.
[8]Hsu W H,Pan T M.Monascus purpureus-fermented products and oral cancer:a review [J].Applied Microbiology and Biotechnology,2012,93:1831-1842.
[9]Mapari S A S,Nielsen K F,Larssen T O,et al.Exploring fungal biodiversity for the production of water-soluble pigments as potential natural food colorants[J].Current Opinion in Biotechnology,2005,16(2):231-238.
[10]Dufosse L,Galaup P,Yaron A ,et al.Microorganisms and microalgae as sources of pigments for food use:a scientific oddity or an industrial reality?[J].Trends in Food Science and Technology,2005,16(9):389-406.
[11]孙付保,陈晓旭,陈晓萍,等.混合菌株固态发酵玉米皮生产饲料蛋白[J].食品与生物技术学报,2010,29(6):918-923.SUN Fubao,CHEN Xiaoxu,CHEN Xiaoping,et al.Feed protein production from corn bran with mix-strain solid-state fermentation[J].Journal of Food Science and Biotechnology,2010,29(6):918-923.(in Chinese)
[12]孙啸,蔡宇杰,廖祥儒,等.血红密孔菌Pycnoporus sanguineus SYBC-L12固态发酵水稻秸秆产漆酶及其对染料的脱色作用[J].食品与生物技术学报,2013,32(3):240-249.SUN Xiao,CAI Yujie,LIAO Xiaoru,et al.Laccase production under solid-state fermentation of rice straw by pycnoporus sanguineus SYBC-L12 and its decolorization of synthetic dyes[J].Journal of Food Science and Biotechnology,2013,32(3):240-249.(in Chinese)
[13]Velmurngan P,Hur H,Balachandr V,et al.Monascus pigment production by solid-state fermentation with corn cob substrate[J].Journal of Bioscience and Bioengineering,2011,112(6):590-594.
[14]Silverira S T,Daroit D J,Sant’anna V,et al.Stability modeling of red pigments produced by Monascus purpureus in submerged cultivations with sugarcane bagasse[J].Food and Bioprocess Technology,2013,6(4):1007-1014.
[15]Silverira S T,Daroit D J,Brandeli A.Pigment production by Monascus purpureus in grape waste using factorial design[J].LWT-Food Science and Technology,2008,41(1):170-174.
[16]Sharmila G,Nidhi B,Muthukmaran C,et al.Sequential statistical optimization of red pigment production by Monascus purpureus(MTCC 369) using potato powder[J].Industrial Crops and Products,2013,44:158-164.
[17]王波.彩色图解姬菇、肺型侧耳栽培新技术[M].成都:四川科学出版社,2003:1-2.
[18]李平作,徐柔,章克昌.灵芝液体发酵过程中菌体形态与胞外多糖产量的关系[J].工业微生物,2000,30(3):20-24.LI Pingzuo,XU Rou,ZHANG Kechang.Relationship between mycelia morphology and yield of extrapolysaccharide in the culture of G.lucidum[J].Industrial Microbiology,2000,30(3):20-24.(in Chinese)
[19]林忠宁,陈敏健,刘明香,等.真姬菇菇脚和菌糠氨基酸含量测定及营养评价[J].中国食用菌,2012,31(2):44-46.LIN Zhongning,CHEN Minjian,LIU Mingxiang,et al.Determination of the contents of amino acids and nutritional evaluation of hypsizygus marmoreus stembase and mushroom barn[J].Edible Fungi of China,2012,31(2):44-46.(in Chinese)
[20]Pereirad D G,Kilikian B V.Effect of yeast extract on growth kinetics of Monascus purpureus[J].Applied Biochemistry and Biotechnology,2001,91-93(1-9):311-316.
[21]中华人民共和国国家标准GB4926-85.食品添加剂红曲米[S].北京:中国标准出版社,1985.
[22]陈家文.水溶性红曲色素工业性试验研究[J].食品与发酵工业,2000,26(2):20-24.CHEN Jiawen.Study on industrial trial of water soluble monascus color[J].Food and Fermentation Industries,2000,26(2):20-24.(in Chinese)

