生物医用材料生物相容性评价研究进展
袁毅君,王廷璞,陈学梅,苟黎明,姚丹
(1.天水师范学院 生物工程与技术学院,甘肃 天水 741001;2.陕西佰傲再生医学有限公司,陕西 西安 710024)
引 言
生物医用材料是一类具有特殊性能与特种功能的材料,用于疾病预防以及诊断、治疗与康复;并可替换人体组织、器官或增进其功能。其关键在于材料自身的理化性能和生物安全性、可靠性,更注重材料在体内激活机体自我修复的能力,使受损部位结构修复并完善功能。[1]材料与人体组织或体液接触、相互作用时,涉及人体的反应和人体对材料的作用,[2]生物相容性是生物医用材料在机体内处于动、静态变化过程中的反应能力,因此必须具有良好的生物相容性、生物功能性以及良好的可加工性。生物医用材料生物相容性评价主要有体内组织学评价和体外细胞生物学评价两种方法。材料直接植入动物体内并作用一定时间,取出观察组织生长情况即体内组织学评价;在简化模型表面研究细胞粘附、伸展、生长和生物学特性的表达为体外细胞生物学评价。[3]现有国内外生物相容性的评价标准尚需进一步完善,本文就生物医用材料生物相容性评价研究进展进行综述。
1 生物医用材料类型
目前生物医用材料种类繁多,主要分为三大类:(1)天然高分子生物材料,如胶原蛋白、明胶、纤维蛋白、壳聚糖、琼脂、糖胺多糖(如透明质酸、硫酸软骨素等)、藻酸盐、丝素蛋白、几丁质、松质骨骨基质、脱细胞基质等。(2)合成高分子生物材料,如硅橡胶、聚乙烯、聚氨酯、聚丙烯酸酯聚乳酸(PLA)、聚羟基乙酸(PGA)等。(3)复合高分子生物材料,如明胶/硫酸软骨素/透明质酸钠、聚氧化乙烯/甲壳素/壳聚糖、壳聚糖/明胶、丝素蛋白/羟基磷灰石、聚乳酸/纳米羟基磷灰石/氧化石墨烯纳米等复合生物材料。[4]虽然每种材料有不同的特点与功能,但每一类型材料具有相似点,见表1.[5-7]

表1 生物材医用料类型
生物医用材料提供组织细胞生长所需的支撑介质与环境,并协调内环境活性因子和细胞间的相互作用,促进细胞黏附,潜在影响细胞分化与增殖,改变细胞表面因子受体表达。所以理想的生物医用材料应具有:(1)优良的生物相容性,无毒,无致畸性;(2)良好的生物可降解性和降解率:生物材料是可被吸收的,在组织形成过程中逐步分解,不影响新形成组织的结构和功能,降解速度同步于组织再生速度;(3)材料表面活性好:促进细胞贴附,是细胞生长、增殖和分泌基质的理想微环境;(4)具有可塑性和一定的机械强度;(5)免疫原性低,不引起炎症反应;(6)方便加工;(7)具有可消毒性。[8-10]
2 生物医用材料生物相容性的检测
2.1 细胞毒性的检测
采用体外细胞毒性试验对生物材料和医疗器材或浸提液可滤出成分中潜在的细胞毒性评价是常用方法,一般以体外细胞培养方法进行。各种医疗器械和医用材料临床应用前的必选项目是细胞毒性实验,是评价医用材料毒性的重要指标。[11]细胞毒性实验研究周期短,已被广泛用于生物材料生物相容性评价中,特点是简便、敏感,节省经费、节约动物。[12]
有多种方法检测细胞毒性,GB/T16886标准分为MTT试验法(主要是浸提液法)、直接接触法、分子滤过法和琼脂覆盖法。还有按照不同的生物学评价指标对细胞毒性检测进行评价,如细胞形态学、细胞膜效应(LDH释放法)、细胞代谢活性、细胞增殖率等方法。另有细胞周期、细胞凋亡和细胞增殖相关蛋白检测等方法评价细胞毒性。不同生物材料的细胞毒性途径不同,初步探讨材料细胞毒性的机制往往选择多生物学终点的评价,同时进一步采用分子生物学方法探明材料的毒性机理。[13]
MTT试验是一种检测细胞生长、存活情况的方法,主要原理是活细胞中的线粒体琥珀酸脱氢酶将MTT分子还原,产生紫色结晶物,DMSO溶解紫色结晶,比色测定吸光值,呈现材料的浸渍液对细胞数量及活性的影响;[14-15]在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。直接接触试验是受试样品直接接触机体,可测出材料微弱的细胞毒性,对材料的细胞毒性敏感性最高;琼脂覆盖法以肉眼或电镜观察细胞溶解区和脱色区范围来直接评价材料对细胞膜的破坏程度;[16]分子滤过法则是检测生物材料对活细胞琥珀酸脱氢酶活性的影响评价细胞毒性的方法;[17]正常细胞内存在乳酸脱氢酶(LDH),仅于细胞受损时裂解释放至胞外,所以LDH释放法可检测细胞培养液上清的LDH活性评价细胞毒性。[18-19]上述五种检测方法的优缺点以及适用范围见表2.
2.2 血液相容性评价
植入机体的生物材料接触血液时,机体血液将产生相关生理生化反应,尤其考察用于心血管体系的生物材料引起的血液生理变化有着特殊意义。因此评价生物材料与血液接触时对机体血液破坏的量度,即血液相容性评价。具体指形成血栓、红细胞破坏、减少或激活血小板;凝血因子和补体系统是否激活;血液中各种酶活性是否改变;有害免疫反应是否发生等,血液生理生化反应是相互联系又同时发生(如图1)。[20]心血管体系的生物材料更需要具有非常优良的血液相容性。由于内环境理化因子的复杂性与多变及凝血机制,因此生物材料需要经体内和体外实验进行血液相容性评价,具体评价方法和指标还未标准化。[21]血液相容性评价一般采用体外实验、半体内试验和体内试验。

表2 细胞毒性检测方法[14-19]
在实验室中模拟体内环境,如温度、血液接触生物材料界面的剪切力,检测材料接触血液后的变化,即体外实验。特点是节省经费,周期短,操作简单,易控制。
将实验动物循环血液导出体外与材料相互作用之后,直接返回体内,即半体内试验。由于实验中利用在体循环血液,免除了抗凝剂制造的假象。
体内试验则是将生物材料直接种植于实验动物体内一定位置,经过一定的试验时间后取出材料再进行评价。相比于体外试验其结果与临床应用密切相关。但具有和半体内试验相同的缺点——受实验动物种属与个体间差异的影响,且需大量的实验动物。
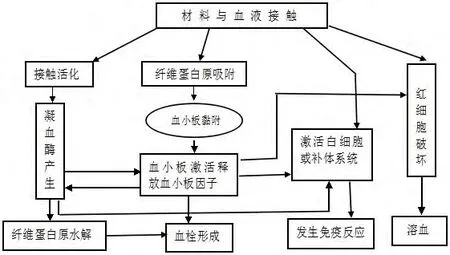
图1 材料对血液的作用[20]
2.3 遗传毒性和致癌试验
体外检测遗传毒性和致癌实验常用Ames实验,由细菌介导的检测基因毒物的一种方法,也是检测基因突变最常用的方法。由于Ames实验菌种的变异,致使假阴性率的实验结果由10%增加到30%~40%,[22]因此,需要进行体外染色体畸变试验和微核试验相互补充,对遗传毒性进行科学评价。[2]分子检测在遗传毒性和致癌试验的评价中有特殊意义,可取代某些大型动物试验(如啮齿类动物)。核酸(DNA、RNA)检测技术,可在基因转录水平和翻译水平上研究生物材料对细胞的影响。[23]
2.4 植入实验
植入实验是材料的生物相容性和安全性评价的主要检测方法,有两种方法:皮下植入和骨内植入。在实验动物的适当位置如皮下、肌肉等,埋植生物材料,按照试验时间定期取材制作组织学切片观察组织变化,材料与机体组织之间的理想反应是植入物周围形成纤维包膜,是材料生物相容性良好的一个重要指标。[24]对与机体组织长期接触的材料可选皮下植入实验以检测材料与皮下组织器官的反应。选择同种、同龄、同性别实验动物,将受试材料与对照材料分别植入同一部位,试验周期4至12周不等。定期取材评价动物的生物反应,进行大体观察和组织病理学评价。长期皮下植入外来生物材料条件下能否引发机体组织产生肿瘤是新一代人工器官及生物材料研发急需解决的问题。[25]骨内植入实验常选实验动物的左右肢股骨外侧或者胫骨内侧作为植入位置,在同一部位的一侧放置受试样品另一侧放置对照样品;另外可选牙槽骨植入。观察动物的反应并记录异常表现,至实验结束时对植入体周围组织进行生物评价。[26]
2.5 过敏反应实验
过敏实验中必须设立阴性对照组,遵循随机化原则分组。[2]以腹腔注射途径给予实验动物浸提液处理,观察动物的生理反应,特别观察末次注射后的变化,如用爪搔鼻、喷嚏、竖毛、抽搐、呼吸困难、尿便失禁、休克、死亡等反应。
3 展 望
生物医用材料生物相容性的评价研究是长期需要关注并不断更新发展的领域,是生物医用材料安全应用于人体的前提与根本保障。以现代分子生物学的方法检测生物医用材料的安全性是必然手段。[27]尽管对生物医用材料生物相容性的评价引入了分子方法,由于生物医用材料种类多样并用途不同,其检测方法也是多样的,因此评价方法尚未形成统一标准。相信随着生命科学整体研究水平的发展与创新,将会有更多精准的研究手段和多样化的检测方法涌现,促使生物医用材料的评价研究从整体与器官水平实现向细胞与分子水平的跨越,并将在分子水平建立综合的生物相容性评价标准体系,为开发出重建与修复功能优越的生物医用材料提供研究方向。
[1]生物医用材料在临床应用中的研究重点[J].中国组织工程研究与临床康复,2011,(34):6423.
[2]李瑞,王青山.生物材料生物相容性的评价方法和发展趋势[J].中国组织工程研究与临床康复,2011,(29):5471-5474.
[3]张真,卢晓风.生物材料有效性和安全性评价的现状与趋势[J].生物医学工程学志,2002,19(1):117-121.
[4]王向春.运动性关节软骨缺损支架材料的选择及其生物相容性[J].中国组织工程研究与临床康复,2011,(12):2233-2236.
[5]杨春蓉.高分子复合生物材料的研究进展[J].胶体与复合物,2009,(27):41.
[6]宣永华.不同口腔种植材料的应用及安全性评价[J].中国组织工程研究与临床康复,2011,(29):5433-5436.
[7]佘荣峰,邓江,黄文良,董志军,刘彬.丝素蛋白-壳聚糖复合支架材料的细胞相容性[J].中国组织工程研究,2012,(3):455-458.
[8]赵广建,赵耀.不同生物材料构建血管支架的组织相容性[J].中国组织工程研究与临床康复,2011,(25):4679-4682.
[9]徐忠华,吴清玉.血管组织工程的研究进展[J].国际外科学杂志,2006,33(4):301-305.
[10]陈梅,左保齐.组织工程软骨支架材料综述[J].现代丝绸科学与技术,2011,(3):110-114.
[11]郑旭,王莉芳,陈芳,孙发展,罗晶.MTT法评价4种医用材料的细胞毒性[J].西北药学杂志,2011,(5):363-364.
[12]林红赛,王春仁,王志杰,张华.生物材料的细胞生物相容性评价方法的研究进展[J].中国医疗器械信息,2011,(9):10-14,21.
[13]郝和平.医疗器械生物评价标准实施指南[M].北京:中国标准出版社,2000:10.
[14]郝建军.牙科材料的细胞毒性试验[J].牙体牙髓牙周病学杂志,1997,7(2):135-136.
[15]陆钰,徐培,甘朝兵,王鑫,赵玫,吴海珍.MTT法评价多孔纳米羟基磷灰石-壳聚糖支架材料的细胞毒性[J].安徽医学,2011,(11):1824-1826.
[16]袁艳波.牙科生物材料细胞毒性试验方法的研究进展[J].生物医学工程学杂志,2009,6(26):688-6,91.
[17]陈娟,柯军,颜林.壳聚糖创伤敷料的生物学评价[J].中国医疗器械信息,2011,3(8):40-42.
[18]段长恩,杨秀滨.医用生物可降解材料的生物学评价体系研究进展[J].新乡医学院学报,2012,29(3):214-216.
[19]黄梅芳,付苓,周燕.LDH释放法与形态学法测定细胞毒的对比研究[J].上海免疫学杂志,1989,9(2):16-18.
[20]杨立峰,许建霞,奚廷斐.生物材料血液相容性的研究与评价[J].生物医学工程学杂志,2009,26(5):1162-1166.
[21]GORBRT MB,SEFTON MV.Biomaterial-associated throm bosis:roles of coagulation factors,complement,platelets and leukocytes.Biomaterials.2004,25(26):5681-5703.
[22]殷实.生物材料植入体内引发肿瘤的机制研究[J].科技信息,2010,(3):384-385.
[23]杨晓芳,奚廷斐.生物材料生物相容性评价研究进展[J].生物医学工程杂志,2001,18(1):123-128.
[24]邵英,路来金,荣莉,彭维海,蓝珊珊,张舵.聚 L-乳酸/聚 L-乳酸接枝的羟基磷灰石复合材料的生物相容性[J].吉林大学学报医学版,2007,33(1):57-60.
[25]NAKAMURA T,SHIMIZU Y,OKUMURA N,et al.Tumori genicity of poly-L-lactide(PLLA)plate compared with medical-gradepolyethylene.Biomed Mater Res.1994,28(1):17-25.
[26]陈立今,陈治清,张敏.具有电学活性的硬组织替代材料的骨内植入实验研究[J].华西医科大学学报,2001,(4):526-528,554.
[27]戴建国.生物材料生物相容性的分子生物学研究进展[J].国外医学生物医学工程分册,2004,(6):360-364.

