猪源益生枯草芽孢杆菌的分离鉴定及培养条件优化
魏姗姗, 马红霞, 高云航, 幺乃全, 徐凤宇, 李茂辉
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.吉林正大实业有限公司,吉林长春 130052)
益生芽孢杆菌可产生脂肽、肽、磷脂、多烯、氨基酸、核酸等多种抑菌物质 (Tan等,2013;Chandraleka 和 Ramya,2011;吕艳艳等,2011),具有广谱抑菌活性,且无毒、无副作用、无残留、无耐药性(Jacquet和 Grimal,2012;Huyghebaet等,2011)。 基于仔猪腹泻的病原性细菌以革兰氏阴性菌为主、发病率和死亡率较高的生产实际,本研究从健康仔猪肠道内分离拮抗革兰阴性菌的芽孢杆菌,经抑菌试验,耐受人工胃、肠液试验和安全性试验,获得了一株益生芽孢杆菌,为其生产应用奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌种 解淀粉芽孢杆菌 (TR)、大肠杆菌(CVCC200)、大肠杆菌(AT52)、大肠杆菌(JMS)、金黄色葡萄球菌(K88)、白葡萄球菌(AK2)、耻垢分枝杆菌(mc2155)、新金分枝杆菌(NC18-1)、偶发分枝杆菌(NC19-2)、母牛分枝杆菌(NH55-2)、金新分枝杆菌(NC56-2)、黏质沙雷菌(jn01)、链球菌(CVCC100)、多杀性巴氏杆菌(CVCC500)、多杀性巴氏杆菌(PmA),均为吉林农业大学预防兽医学实验室保存。
1.1.2 主要试剂 NaCl、MgSO4·7H2O、NH4H2PO4、柠檬酸钠、酚红、猪胆盐、胃蛋白酶、胰蛋白酶、KH2PO4、NaOH、10%盐酸,均购自上海生工生物工程股份有限公司;DNA凝胶回收纯化试剂盒,购自北京鼎国生物有限责任公司;质粒小提试剂盒,购自北京索莱宝科技有限公司。人工胃液和人工肠液配制参考曹钰等(2006),略有改动。
1.1.3 培养基 LB固体、LB液体培养基和柠檬酸盐培养基按常规方法配制(周德庆,1986)。
1.1.4 试验动物 体重17~20 g的昆明系小鼠20只,购自长春生物制品研究所有限责任公司,20日龄长白杜洛克健康仔猪,购自长春市某猪场。
1.2 试验方法
1.2.1 菌株的分离 采集健康仔猪的空肠,置于装有5 mL无菌生理盐水的试管中,80℃水浴作用10 min,静置后吸上清100 μL涂于LB平板上,37℃培养至长出菌落。
1.2.2 拮抗试验 将分离到的菌株点接法接种于涂有大肠杆菌 (CVCC200)和金黄色葡萄球菌(K88)的LB平板上,37℃培养12~14 h,观察抑菌效果;取有抑菌作用的芽孢杆菌分别进行37℃厌氧和有氧培养,观察抑菌效果,若菌株无抑菌效果则舍去。
1.2.3 毒力试验 将抑菌效果较好的14株菌接种于液体LB培养基中,37℃培养24 h后,制备成浓度为1×109cfu/mL的菌液,腹腔注射试验鼠,1 mL/只,观察小鼠生存状况,若接种菌株的小鼠出现异常表现甚至死亡,则舍去该菌株。
1.2.4 抑菌谱试验 将毒力试验筛选出的菌株用点接法接种于涂有14种指示菌的平板上,观察抑菌效果,若菌株抑菌谱相对较广且抑菌效果较好,则保留该菌株。
1.2.5 耐胆盐试验 将筛选到的有广谱抑菌活性的菌株接种于含0%、0.2%、0.3%、0.4%、0.5%猪胆盐的LB液体培养基中,37℃培养40、80、120 min,进行活菌计数。
1.2.6 耐人工胃液、肠液试验 取已形成芽孢的分离菌培养物离心,用0.9%的生理盐水洗涤两次后重悬,接种于人工胃液中,振荡混匀,37℃水浴孵育,每隔40 min取样进行活菌计数。
将经pH为2.0的人工胃液处理后的菌体离心,用0.9%生理盐水洗涤两次后重悬接种于人工肠液中,振荡混匀,37℃水浴孵育,每隔40 min取样1次进行活菌计数。
1.2.7 菌株JN-16的菌落及形态观察 将耐受性和抑菌效果较好的菌株JN-16划线接于LB固体培养基表面,37℃培养12~14 h,观察菌落特征,经革兰染色,在光学显微镜下观察菌体的形态大小。
1.2.8 菌株JN-16的分子生物学鉴定 采用试剂盒法提取菌株JN-16基因组总DNA,应用PCR法扩增16S rDNA,反应体系见表1。得到的PCR产物用DNA凝胶回收纯化试剂盒纯化并回收1400~1500 bp片段,扩增产物经纯化后送上海生物工程有限责任公司测序。将测序得到的16S rDNA全序列递交 GenBank数据库中进行Blast比对及同源性比较,将与之同源性最高的15株细菌的16S rDNA序列采用DNAstar软件进行比对分析,并构建系统发育树。
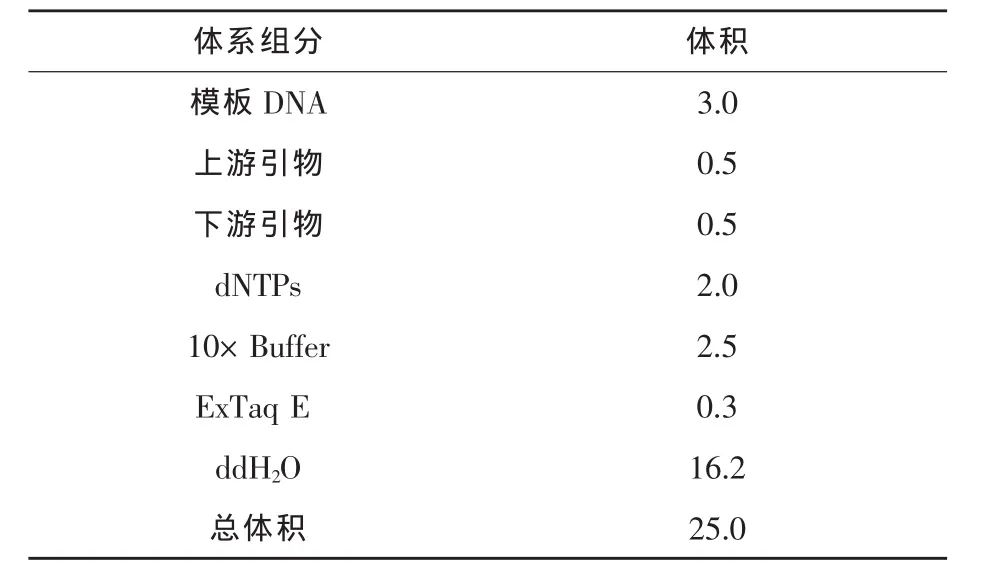
表1 PCR反应体系 μL
1.2.9 耐盐试验 挑取菌株JN-16和解淀粉芽孢杆菌(TR)的单个菌落分别接种于含5%NaCl的LB液体培养基中,37℃过夜培养,观察结果。
1.2.10 柠檬酸盐利用试验 分别钓取菌株JN-16和解淀粉芽孢杆菌(TR),将其单个菌落分别接种于柠檬酸盐斜面培养基上,37℃培养3 d,观察结果。
1.3 抑菌培养条件优化
1.3.1 最适培养时间及温度 将菌株JN-16种子液按照5%(V/V)接于LB液体培养基中置于28、32、33、34、37 ℃培养 12、24、48、72 h 后,10000 r/min离心15 min,收集上清,采用牛津杯法分别检测上清液对大肠杆菌(CVCC200)和金黄色葡萄球菌(K88)的抑菌效果,得到最适培养时间及温度。
1.3.2 最适pH 将菌株JN-16种子液按照5%(V/V) 接于 pH 分别为 4.5、5.5、6.5、7.5、8.5、9.5、10.5的LB液体培养基中,33℃培养24 h,10000 r/min离心15 min,收集上清,采用牛津杯法分别检测上清液对大肠杆菌(CVCC200)和金黄色葡萄球菌(K88)的抑菌效果,得到最适 pH。
1.3.3 碳源优化 将菌株JN-16种子液按照5%(V/V)接种于分别以羧甲基纤维素钠、马铃薯淀粉、葡萄糖、麸皮、秸秆、麦芽糖、乳糖、蔗糖作为碳源,pH为6.5的LB液体培养基中,33℃培养24 h,10000 r/min离心15 min,收集上清,采用牛津杯法分别检测上清液对大肠杆菌(CVCC200)和金黄色葡萄球菌(K88)的抑菌效果。
1.3.4 氮源优化 将菌株JN-16种子液按照5%(V/V)接种于分别以NH4Cl、牛肉膏、胰蛋白胨、大豆蛋白胨、蛋白胨混合酵母粉、NH4Cl混合牛肉膏作为氮源,pH为6.5的LB液体培养基中,33℃培养24 h,采用牛津杯法分别检测上清液对大肠杆菌(CVCC200)和金黄色葡萄球菌(K88)的抑菌效果。
2 结果与分析
2.1 菌株分离和拮抗试验结果 从仔猪空肠内共筛选出芽孢杆菌23株,通过抑菌试验得到14株对大肠杆菌(CVCC200)和金黄色葡萄球菌(K88)抑制效果较好的菌株,并将它们命名为菌株JN-4、JN-8、JN-10、JN-11、JN-12、JN-13、JN-14、JN-15、JN-16、JN-17、JN-18、JN-19、JN-21、JN-22。
2.2 毒力试验结果 灌服菌株JN-14的小鼠死亡,其他小鼠精神状况正常,未出现异常反应,剖检未见病变,这表明除菌株JN-14组外,其他13株菌株对试验小鼠无毒,所以可舍去菌株JN-14,将其他13株菌进一步筛选。
2.3 抑菌谱试验结果 对毒力试验筛选出的13株菌株进行抑菌谱测定,结果如表2所示。但13株菌株对白葡萄球菌(AK2)、链球菌(CVCC100)、大肠杆菌(JMS)、多杀性巴氏杆菌(CVCC500),多杀性巴氏杆菌(PmA)的抑菌能力较低,抑菌圈较小,对新金分枝杆菌 (NC18-1)、偶发分枝杆菌(NC19-2)、母牛分枝杆菌(NH55-2)均无抑制作用。 菌株JN-4、菌株JN-8、菌株JN-11、菌株JN-16、菌株JN-19抑菌谱较广,且抑菌效果较好,所以保留该5株菌株并进一步筛选。
2.4 耐胆盐试验结果 猪小肠中胆盐的高渗透压环境不利于菌体存活,0.3%的胆盐浓度被认为是筛选抗性菌的参考标准。由图1可见,菌株JN-16、菌株JN-8对一定浓度的胆盐环境具有良好的耐受性,浓度为0.2%和0.3%胆盐作用120 min后,仍可保持较高的存活率,当胆盐浓度达0.4%和 0.5%时,JN-8活菌数下降,而菌株JN-16对0.5%胆盐至少可耐受120 min。
2.5 耐人工胃肠液试验结果
2.5.1 耐人工胃液试验结果 健康动物的胃液pH一般为0.9~1.8,进食后胃液的pH为1.8~5,食物在胃中消化的时间一般为1~2 h。因此,菌株要有很好的耐酸能力才能通过高酸的胃环境而到达小肠发挥作用。由表3可知,菌株JN-16和菌株JN-8均对人工胃液有较好的耐受性。
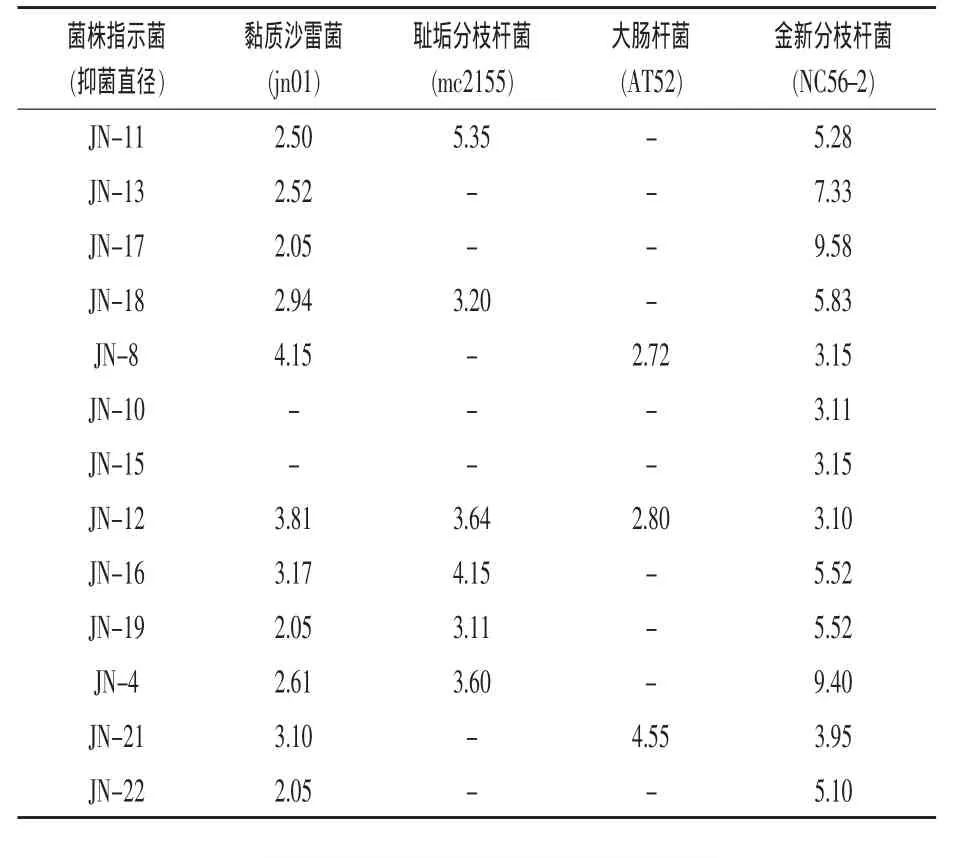
表2 抑菌试验结果 mm
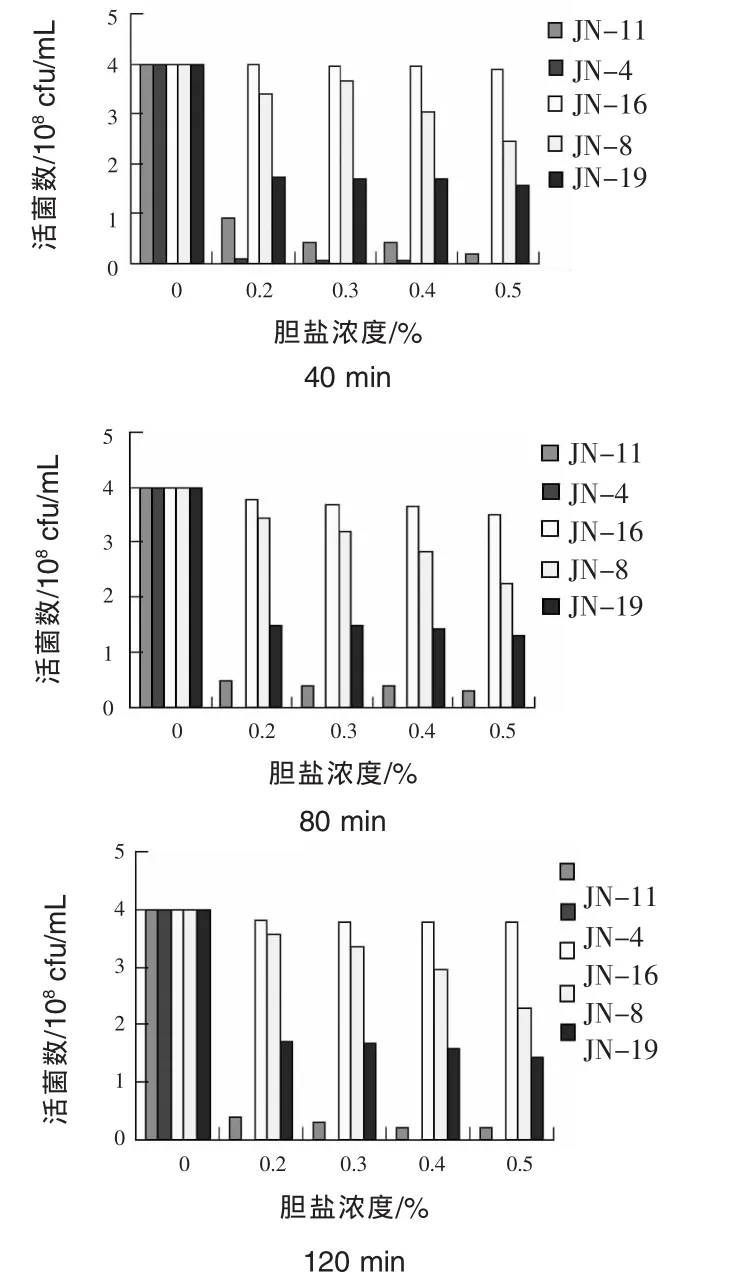
图1 不同胆盐浓度和作用时间对菌株活菌数影响(108cfu/mL)
2.5.2 耐人工肠液试验结果 小肠液的pH一般为7.6,食物通过的时间为1.5 h,因此,菌株只有耐受住小肠液的作用,并保持一定数量才能发挥作用。由表4可知,人工肠液对JN-16号菌株影响小,大部分菌株均能够在肠液中生长,这说明菌株JN-16对人工肠液的耐受能力最强。
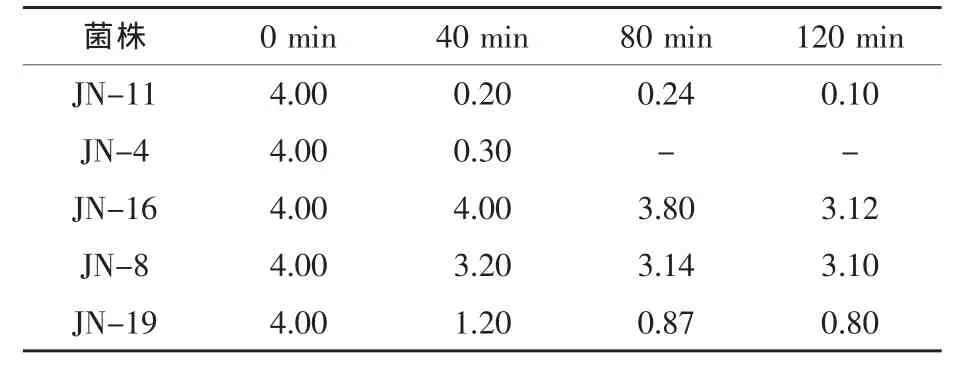
表3 在不同培养时间下菌株在人工胃液中的存活情况 108cfu/mL
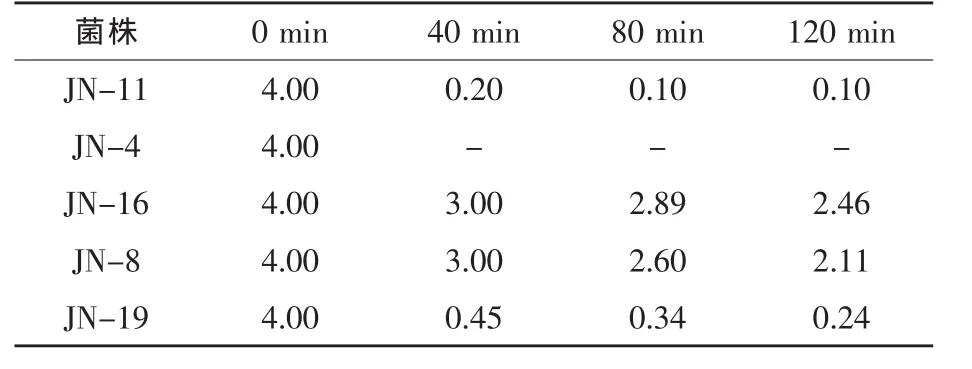
表4 在不同培养时间下菌株在人工肠液中的存活情况 108cfu/mL
2.6 菌株JN-16的菌落及个体形态 菌株JN-16菌落呈白色,扁平,半透明,边缘不整齐;在液体培养基表面形成皱醭;菌体长1.04~1.74 μm,革兰阳性,芽孢0.6~1.5 μm,椭圆,较菌体狭窄,位于菌体中央。
2.7 菌株JN-16的16S rDNA序列同源性分析以菌株JN-16基因组DNA为模板,利用细菌16S rDNA通用引物进行PCR扩增,得到特异性较高的唯一产物,大小为1500 bp左右,经测序和序列分析发现,所获得的DNA基因片段长度为1488 bp,与枯草芽孢杆菌X-01(序列登录号:EU723210.1)和解淀粉芽孢杆菌HY-7(序列登录号:JN382250.1)等菌株存在100%的同源性。
2.8 菌株JN-16基因序列系统进化树的构建结果 应用DNAstar软件,用测得序列和GenBank中收录的同源性最高的15株芽孢杆菌的16S rDNA序列构建系统发育树,见图2。表明菌株JN-16与解淀粉芽孢杆菌和枯草芽孢杆菌亲缘关系最近。
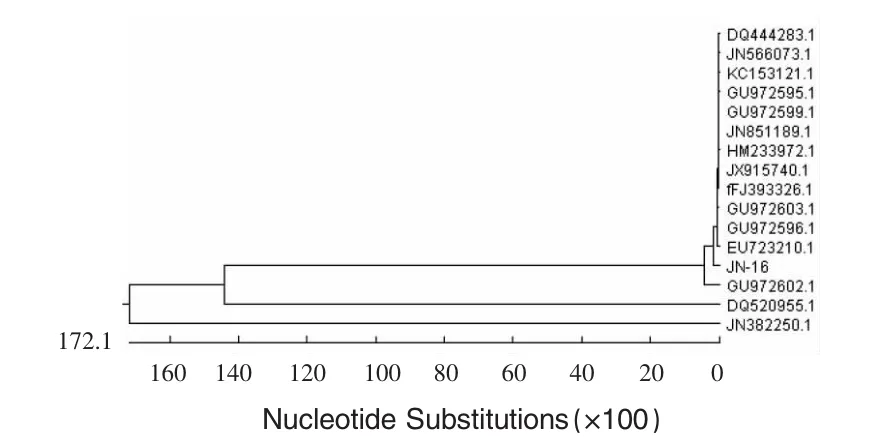
图2 基于菌株16S rDNA序列的进化树
2.9 含5%NaCl的LB培养基的培养结果 由培养结果可以看出,菌株JN-16能够在5%NaCl的LB的培养基中生长。通过《常见细菌系统鉴定手册》可知,枯草芽孢杆菌可在5%NaCl的LB培养基中生长而解淀粉芽孢杆菌(TR)则不能在其中生长,所以可初步认为菌株JN-16为枯草芽孢杆菌。
2.10 柠檬酸盐利用试验结果 将菌株JN-16和解淀粉芽孢杆菌分别接种于柠檬酸盐斜面培养基上,培养3 d,培养基为碱性(指示剂为蓝色或桃红色)者为阳性,否则为阴性。培养3 d后,观察结果。菌株JN-16在柠檬酸盐培养基上表现为阳性,这与枯草芽孢杆菌的性质相同。
2.11 抑菌培养条件优化结果
2.11.1 发酵时间对JN-16抑菌作用的影响 由图3可知,在发酵24 h时,菌株JN-16对大肠杆菌和金黄色葡萄球菌抑制作用相对其他发酵时间抑制效果好,抑菌圈直径分别达到11 mm和12 mm。发酵时间在12 h和36 h,抑菌圈差异均不显著。在发酵时间为72 h时,抑菌圈最小,由此可以看出,菌株JN-16对大肠杆菌和金黄色葡萄球菌的抑制能力均较强,同时当发酵时间达到24 h后,随着发酵时间的延长,抑菌能力逐渐减弱。所以,获得菌株JN-16的最适抑菌时间为24 h。
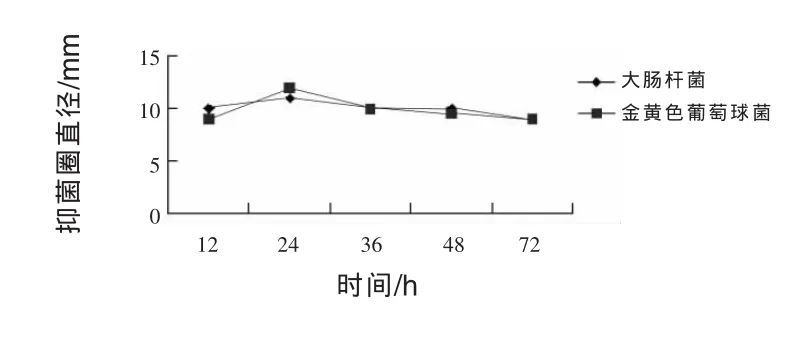
图3 不同培养温度对菌株JN-16抑菌作用的影响
2.11.2 温度对JN-16抑菌作用的影响 由图4可知,28~33℃,菌株JN-16抑菌能力随温度升高而增强,达到最大值后逐渐减弱。而菌株JN-16在发酵时间为33℃和37℃时抑菌圈大小相同,抑菌圈直径为11 mm,较其他发酵温度抑制大肠杆菌能力强。菌株JN-16对金黄色葡萄球菌最大抑制作用发生在发酵温度为33℃时,抑菌圈直径为12 mm。所以获得菌株JN-16的最适抑菌温度为33℃和37℃。
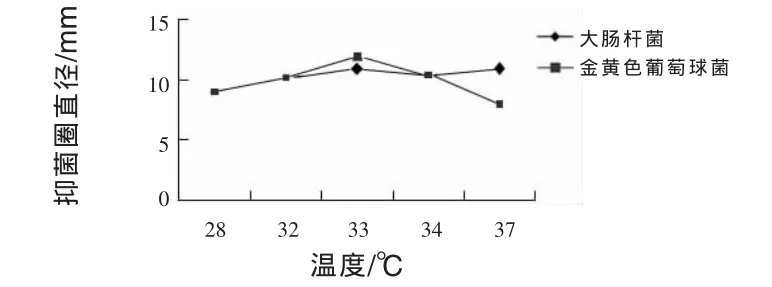
图4 不同培养时间对菌株JN-16抑菌作用的影响
2.11.3 pH对JN-16抑菌作用的影响 由图5可知,pH在达到6.5之前,抑制能力不断增强,pH达到6.5时,抑制金黄色葡萄球菌和大肠杆菌的能力最大,抑菌圈直径分别为20 mm和12.1 mm,随后抑制能力逐渐减弱。不同pH值对JN-16抑制大肠杆菌能力影响较大,但对抑制金黄色葡萄球菌能力影响较小。
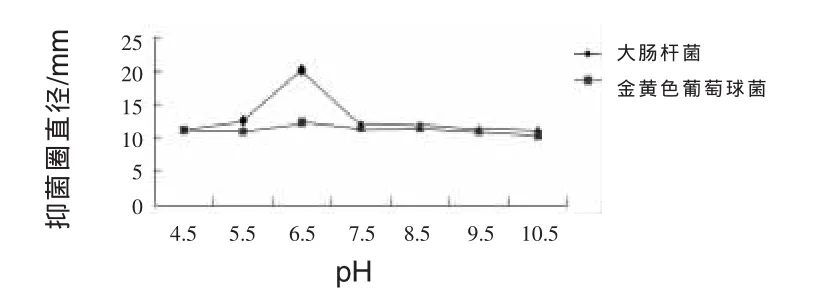
图5 不同pH对菌株JN-16抑菌作用的影响
2.11.4 改变碳源对JN-16抑菌作用的影响 由图6可知,以葡萄糖作为碳源时,JN-16抑制大肠杆菌能力最强,抑菌圈直径为14.42 mm,乳糖、马铃薯粉、麦芽糖次之,抑制大肠杆菌能力最低的碳源是羧甲基纤维素钠和蔗糖,抑菌圈直径均为12.1 mm。抑制金黄色葡萄球菌能力最强的碳源是马铃薯淀粉,抑菌圈直径为14 mm,羧甲基纤维素钠、麸皮、葡萄糖、乳糖、秸秆次之,抑制金黄色葡萄球菌能力最低的是麦芽糖,抑菌圈直径为11.7 mm。由于葡萄糖抑菌效果较好,价格低廉,故选葡萄糖为最佳碳源。
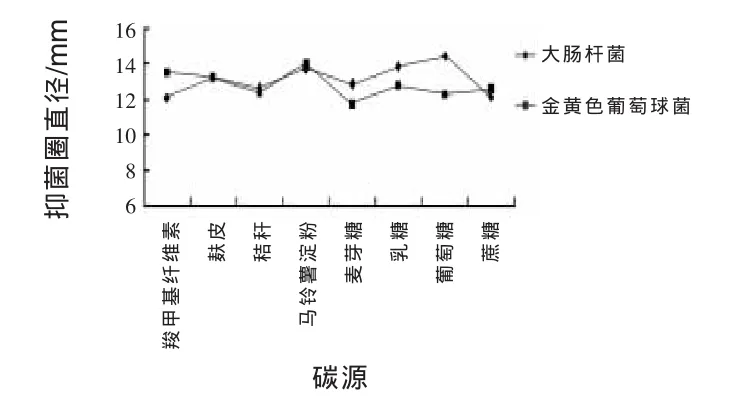
图6 不同碳源对菌株JN-16抑菌作用的影响
2.11.5 改变氮源对抑菌作用的影响 由图7所示,作为菌株JN-16抑制大肠杆菌能力最强的氮源是牛肉膏,抑菌圈直径为11.48 mm,其次为大豆蛋白胨和NH4Cl,抑菌圈直径分别为11.3 mm和11.1 mm,蛋白胨+酵母粉作为氮源抑菌能力最低,抑菌圈直径为10.4 mm。NH4Cl+牛肉膏和胰蛋白胨作为氮源,抑菌圈直径为10.8 mm和10.7 mm,差异不显著。NH4Cl和大豆蛋白胨作为氮源,JN-16抑制金黄色葡萄球菌能力最强,抑菌圈直径均为11.6 mm,其次为蛋白胨+酵母粉,抑菌圈直径为11.18 mm,胰蛋白胨和NH4Cl+牛肉膏作为氮源,抑菌能力差异不大,抑菌圈直径分别为1 0.8 mm和10.68 mm。作为氮源抑制金黄色葡萄球菌能力最低的是牛肉膏,抑菌圈直径为10.3 mm。大豆蛋白胨作为氮源时,JN-16对大肠杆菌和金黄色葡萄球菌的抑制能力均相对较强,可作为最佳氮源。
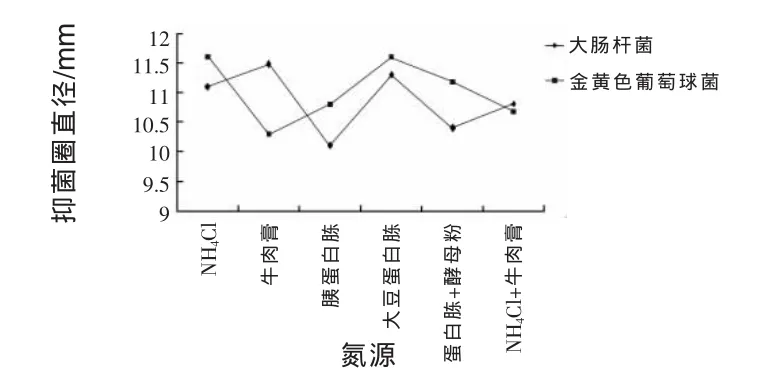
图7 改变氮源对菌株JN-16抑菌作用的影响
3 讨论
芽孢杆菌类是目前研究比较广泛的一类疫病防治微生物。已报道用于畜禽养殖中的芽孢杆菌种类主要有蜡样芽孢杆菌、纳豆芽孢杆菌、枯草芽孢杆菌、凝结芽孢杆菌、巨大芽孢杆菌、环状芽孢杆菌、坚强芽孢杆菌、短小芽孢杆菌、东洋芽孢杆菌等,它们具有拮抗病原菌活性,能够增强机体免疫力,提高养殖经济效益(Defoirdt等,2011)。
本试验结果表明,枯草芽孢杆菌JN-16对耻垢分枝杆菌、金新分枝杆菌有抑制作用,但对其他分枝杆菌抑制作用较弱或无抑制作用,这可能是由于不同分枝杆菌产生的抑菌物质及作用机理不同所致(Gil,2011)。对枯草芽孢杆菌JN-16进行了安全性试验及对胃肠道环境耐受性试验,结果显示,枯草芽孢杆菌JN-16能够耐受胃、肠液的消化,且该菌安全无毒,具备作为优良益生菌株的条件(Cheesman 等,2012;何若天,2011)。
枯草芽孢杆菌JN-16发酵条件优化结果显示,以葡萄糖为碳源、大豆蛋白胨为氮源、pH为6.5时在33℃或37℃培养24 h抑菌作用最强。王超等(2012)报道的一些枯草芽孢杆菌优化结果同样是以葡萄糖为氮源、33℃或37℃培养24 h抑菌效果均较好,而氮源大多选用酵母浸粉,且pH值在7.0~7.5。研究发现一些芽孢杆菌在不同温度、不同环境的培养条件下,抑菌作用发生了变化,可能是由于芽孢杆菌在不同温度和培养条件下产生的抑菌物质的不同,所以本株菌所产抑菌物质尚待研究。
[1]曹钰,孙玲玲,陆健.酸与胆汁耐性芽孢益生菌的筛选[J].科技动态,2006,8:31 ~ 34.
[2]何若天.益生芽孢杆菌在畜禽养殖中的应用效果和使用方法[J].科学种养,2011,2:4 ~ 5.
[3]吕艳艳,张首都,单春乔.细菌素的作用机理及在生产中的应用[J].动物微生态学杂志,2011,23(11):1053 ~ 1055.
[4]王超,陈启和,倪辉,等.1株枯草芽孢杆菌的鉴定及其弹性蛋白酶结构研究[J].微生物学杂志,2012,32(3):13 ~ 20.
[5]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[6]Chandraleka K,Ramya G C.Antimicrobial mechanism of copper(II)1,10-phenanthroline and 2,2-bipyridyl complex on bacterial and fungal pathogens[J].Saudi Chemical Society,2011,19(6):926 ~ 930.
[7]Cheesman L,Nair J N,Staden J N.Antibacterial activity of crinane alkaloids from Boophone disticha (Amaryllidaceae) [J].Ethnopharmacology,2012,140(2):405 ~ 408.
[8]Defoirdt T,Thanh L D,Delsen B V.N-acylhomoserine lactone-degrading Bacillus strains isolate from aquaculture animals[J].Aquaculture,2011,311(1):258~260.
[9]Gil F,Pimentel M,Moniz-Pereira J,et al.Function Analysis of the Holin-Like Proteins of Mycobacteriophage Ms6[J].Bacteriology,2011,193(11):2793 ~2803.
[10]Hughes M A,Silva J C,Geromanos S J,et al.Ouantitative proteomic analysis of drug-induced changes in mycobateria[J].J Proteome Res,2006,5(1):54 ~ 63.
[11]Huyghebaet G,Ducatelle R,Immerseel F V.An update on alternatives to antimicrobial growth promoters for broilers[J].The Veterinary Journal,2011,187(2):182 ~ 188.
[12]Jacquet T,Grimal C C.Antibacterial activity of class lla bacteriocin Cbn BM1 depends on the physiological state of the target bacteria[J].Research in Microbiology,2012,163(5):323 ~ 331.
[13]Tan Y N,Matthews K R,Di R,et al.Comparative antibacterial mode of action of purified alcalase-and tryptic-hydrolyzed palm kernel cake proteins on the food-borne pathogen Bacillus cereus[J].Food Control,2013,31(1):53~54.

