2D-HPLC-LVI测定人血浆中的利福平
李 威,邱细敏,郭思维,王 琼
(湖南师范大学医学院,湖南 长沙 410006)
结核是一种世界性的传染性疾病,每年引起数万人死亡,其中死亡人数最多的主要是在发展中国家,尤其是在亚洲[1]。近年来,尽管全球结核发病率正在下降,但耐药性也正在迅速发展和蔓延[2]。利福平(Rifampicin,RFP)是经典有效的一线药物,但RFP 因诱导肝脏微粒体氧化酶[3-4]、个体差异大、生物利用度变化大[2,5-6]等缺点,使其在血液中的浓度或高或低,导致一系列的不良后果,如耐药菌的产生、治疗的失败、治疗疗程的延长、严重的肝损害以及对其它药物产生影响[7-8]。因此,通过测定RFP血药浓度来调整给药剂量以维持RFP 的有效血药浓度已经变得非常重要。
目前有一些高效液相色谱法[3,9-11]用于人血浆中RFP 的测定,但这些方法样品处理复杂、成本高、干扰多,不适于用于RFP 长期的血药浓度监测。与以往方法比较,本文采用2D-HPLC-LVI 法测定人血浆中的RFP,具有样品处理简单、无需内标、结果准确度高和自动化程度高等优点,适于临床RFP 血药浓度监测。
1 仪器与试剂
1.1 仪器
2D-HPLC-LVI (large volμme injection,LVI)系统主要由萃取系统和分析系统两部分组成。萃取系统主要负责样品富集和初级去除杂质;分析系统主要负责样品的分离监测;中间接口采用“中心切割”的柱柱转换模式。整个系统主要由日本岛津高效液相色谱仪组成,包括2 个LC-10AT 单元泵(Pump1和Pump2)、LC-10ATvp 四元低压色谱泵(Pump3)、SIL-10ADvp 自进样器、SPD-10Avp 检测器、500 μL定量环和1 个六通阀;另外离心机为HS145 型(长沙安莱科分析仪器有限公司),电子天平(AND GH-202,十万分之一,日本)。
1.2 试剂
RFP(含量>99. 0%,批号:130496200501)。维生素C(含量>99.7%)。特丁基对苯二酚(TBHQ,含量>99.0%)。色谱纯:甲醇、乙腈;分析纯:磷酸二氢铵,磷酸;自制蒸馏水,空白血浆(中南大学湘雅二医院血液科),所有试剂经过检测,无干扰。
2 方法与结果
2.1 对照品储备液和质控品的配制
精密称取RFP 对照品200.0 mg,置于25 mL 棕色容量瓶中,加适量含0.5 mol/LTBHQ 的乙腈超声溶解,并用含0.5 mol/L TBHQ 的乙腈定容,混匀,置于-20℃的冰箱保存,即得浓度为8.0 mg/mL 的RFP 储备液。使用时用甲醇溶液稀释成所需浓度的工作液。
取相同体积的空白血浆加入相同体积不同浓度的工作液,配制成低(0.4 μg/mL)、中(6.0 μg/mL)和高(16.0 μg/mL)3 个浓度的质控品。所有质控品置于-70℃保存。
2.2 血样的处理
精密吸取0.3 mL 血浆于含30 μL2.8 mol/mL维生素C 和0.6 mL 乙腈的EP 管,涡旋震荡1. 0 min,再在14500 r/min 离心8 min,取上清液100 μL进样。
2.3 色谱条件
辅助液是2.0 mmol/L 磷酸溶液(pH =3.00)。萃取流动相:84 mmol/mL 磷酸二氢铵溶液(用磷酸调节pH 值为3.32)-乙腈-甲醇=55∶24∶21。分析流动相:42 mmol/mL 磷酸二氢铵溶液(pH =4.60)-乙腈-甲醇=48∶38∶14。样品经乙腈蛋白沉淀处理后,100 μL 上清液在PΜMP1 和PΜMP2 条件下进入萃取柱,并在PΜMP2 下,实现在线样品萃取除杂;接着在PΜMP2 条件下,采用“中心切割”模式将目标物转移到自制C18陷阱柱;最后用六通阀连接陷阱柱和分析柱,完成目标物的分离检测。柱温40℃,检测波长333 nm,进样量100 μL。
2.4 方法学考察
2.4.1 色谱行为和方法专属性 RFP 保留时间tR为9.80 min,色谱峰宽为0.55 min,通过萃取柱及分析柱的两级分离后色谱峰在tR±2.5 min 内无其他干扰峰(图1)。另外,目标物在萃取柱和分析柱之间转移时造成5.5 min ~6.5 min 之间的溶剂峰。
2.4.2 线性关系考察 精密吸取RFP 标准工作液,加空白血浆配制成浓度为0.2、0.6、2. 0、8.00、14.0、20. 00 μg/mL 的RFP 标准曲线样品,再按“2.2”项下步骤操作处理。结果RFP 在0. 20 ~20.00 μg/mL 呈良好的线性关系,以浓度为自变量(X),峰面积为因变量(Y),其回归方程为y =114716.4x-2533.8,R2=0.9999。
2.4.3 最低定量限考察 最低定量限(LLOQ)以RFP 色谱峰完全达到基线分离,峰面积RSD ≤20%,准确度在80% ~120%来计算。结果血浆中RFP 的最低定量限分别为0.12 μg、mL,完全满足临床RFP 的治疗药物检测要求。
2.4.4 绝对回收率考察 取低、中、高3 个浓度的RFP 质控品(n =6),按“2.2”项下操作处理。所得峰面积与对应相同浓度的同样处理的RFP 对照品溶液所的峰面积进行比较,其结果如表2。
2.4.5 准确度和精密度考察 取低、中、高3 个浓度的RFP 质控品,按“2.2”项下操作处理。日内精密度数据通过日内测定RFP 标准血样低、中、高3个浓度得到(n=6),日间精密度数据通过连续测定3 d 高、中、低3 个浓度,每日每个浓度6 份得到,其结果如表1。
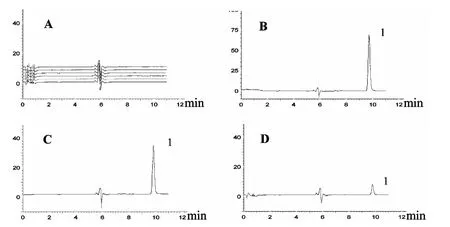
图1 A. 空白血浆;B. 对照品+空白血浆(14.0μg/mL);
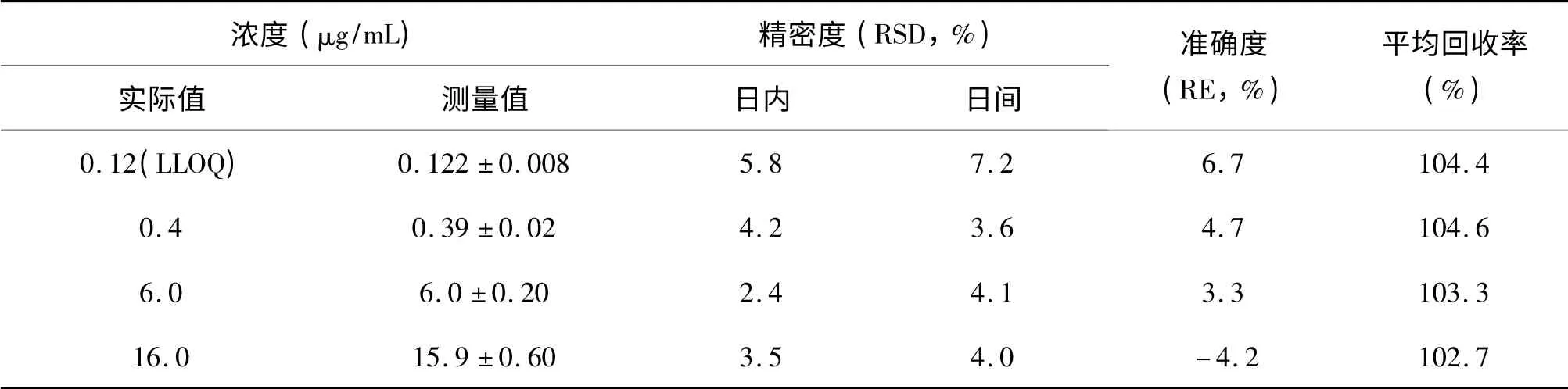
表1 方法的回收率、精密度和准确度
2.4.6 稳定性考察 取低、中、高3 个浓度的RIF质控样品和经处理的质控品,分别于室温放置0h、2h 和4h,4℃放置0h、12h 和24h,-20℃放置0d、7d和14d 后,按“2.2”项下操作处理(除经处理的质控品外)。另外,于-20℃冷冻保存24 h 后室温下解冻测定,连续3 次。结果表明血浆中的RIF 在实验条件下稳定性良好,符合治疗药物监测的要求。
2.5 临床样品的测定
本方法已成功用于RFP 口服剂量为0.45g 的15 例病人的血药浓度监测。在给药2 h 后进行样品采集,并且在2 h 内完成分析检测或者在被分析之前保存在-70℃。测定的浓度结果范围在1.25 ~13.8 μg/mL。
3 讨论
3.1 适合于日常治疗药物监测
近年来,许多文献报道了测定血浆中各种药物浓度的柱切换HPLC 法[12-14]。相比这些方法,本方法具有2 大特点:①具有聚焦体系,通过在特定时间内改变流动相来使分析物以“塞状”进入色谱柱,从而减小由大体积进样的峰扩散引起的误差。②引入了1 根陷阱柱,使该系统具备2 次除杂的能力。另外,该方法的自动化程度高,样品只需经乙腈蛋白沉淀处理。统计不同检测人员的测试结果发现:不同检测人员操作引入的误差被控制在5%以内。因此,无需内标校正,该系统也能获得很好的精密度、准确度和重复性。
3.2 大体积进样
为了满足临床上RFP 的检测要求,本方法通过采用LVI 来提高方法的灵敏度。实验考察了进样体积为100 μL、200 μL 和500 μL 时的方法最低定量限,结果见图2。当进样体积为500 μL 时,方法的最低定量限为0.03 μg/mL。但实验发现:随着进样体积的增加,萃取柱的寿命缩短,因此,在满足测定要求的前提下,尽可能选择小体积的进样量。当进样量为100μL 时,方法的最低定量限是0. 12μg/mL。
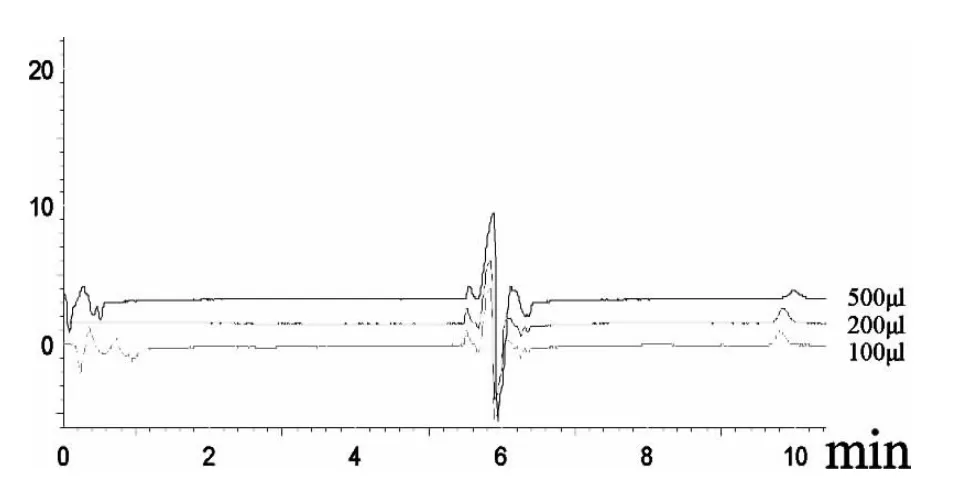
图2 进样体积为100μL、200μL 和500μL 最低定量限的色谱图
3.3 色谱条件的优化
鉴于RFP 分子结构式的特点,实验考察了Venusil SCX 和XtimateC18两种色谱柱。经过测试,选择柱效较好的XtimateC18柱作为分析柱,同时将Venusil SCX 柱作为萃取柱,使两者构成具有强抗干扰能力的二维色谱体系。对于陷阱柱,实验同样测试了自制SCX 柱和自制C18柱,结果:相对于自制SCX柱,自制C18柱更强的除杂能力。因此,本文将Venusil SCX 柱(50 mm×4.6 mm,5 μm),自制C18柱(10 mm ×4.6 mm,5 μm)和Xtimate C18柱(250 mm×4.6 mm,5 μm)分别作为系统的萃取柱、陷阱柱和分析柱。为了尽量缩短保留时间和使峰变得尖锐,聚焦液、萃取流动相和分析流动相的流速分别是2.0 mL/min、1.0 mL/min 和1.2 mL/min。
3.4 血样的处理
实验早期,样品用纯乙腈进行沉淀,但发现RFP峰面积随着放置的时间越长变的越小,同时其后出现一个未知的、随时间越来越大的色谱峰。有文献报道[2]RFP 血样在-20℃或室温容易被氧化。因此本文在RFP 血样和标准溶液中分别加入了一定量的抗氧化剂维生素C 和特丁基对苯二酚(易溶于有机溶剂),以确保其检测期间的稳定性。
[1]Zumla A,Abubakar I,Raviglione M,et al. Drug-resistant tuberculosis—current dilemmas,unanswered questions,challenges,and priority needs[J]. J Infect Dis,2012,205(Suppl2):S228-240.
[2]Damkier P,Hansen LL,Brøsen K. Rifampicin treatment greatly increases the apparent oral clearance of quinidine[J]. Pharmacol Toxicol,1999,85(6):257-262.
[3]Kwara A,Tashima KT,Dumond JB,et al. Modest but variable effect of rifampin on steady-state plasma pharmacokinetics of efavirenz in healthy African-American and Caucasian volunteers[J]. Antimicrob Agents Chemother,2011,55(7):3527-3533.
[4] Agrawa S,Panchagnula R. Implication of biopharmaceutics and pharmacokinetics of rifampicin in variable bioavailability from solid oral dosage forms[J]. Biopharm Drug Dispos,2005,26(8):321-334.
[5]Bhise SB,More AB,Malayandi R. Formulation and in vitro evaluation of rifampicin loaded porous microspheres[J]. Sci Pharm,2010,78(2):291-302.
[6]Wilkins JJ,Savic RM,Karlsson MO,et al. Population pharmacokinetics of rifampin in pulmonary tuberculosis patients,including a semimechanistic model to describe variable absorption[J]. Antimicrob Agents Chemother,2008,52(6):2138-2148.
[7]Ribera E,Azuaje C,Lopez RM,et al. Pharmacokinetic interaction between rifampicin and the once-daily combination of saquinavir and low-dose ritonavir in HIV-infected patients with tuberculosis[J]. J Antimicrob Chemother,2007,59(4):690-697.
[8]Friedland G,Khoo S,Jack C,et al. Administration of efavirenz(600 mg/day)with rifampicin results in highly variable levels but excellent clinical outcomes in patients treated for tuberculosis and HIV[J]. J Antimicrob Chemother,2006,58(6):1299-1302.
[9]Notari S,Mancone C,Sergi M,et al. Determination of antituberculosis drug concentration in human plasma by MALDI-TOF/TOF[J].IUBMB Life,2010,62(5):387-393.
[10]Baietto L,D'Avolio A,De Rosa FG,et al. Development and validation of a simultaneous extraction procedure for HPLC-MS quantification of daptomycin,amikacin,gentamicin,and rifampicin in human plasma[J]. Anal Bioanal Chem,2010,396(2):791-798.
[11]Zhou Z,Chen L,Liu P,et l. Simultaneous determination of isoniazid,pyrazinamide,rifampicin and acetylisoniazid in human plasma by high-performance liquid chromatography[J]. Anal Sci,2010,26(11):1133-1138.
[12]Khalil NY. A highly sensitive HPLC method with automated online sample pre-treatment and fluorescence detection for determination of reboxetine in human plasma[J]. Talanta,2010,80(3):1251-1256.
[13]Matsumoto D,Kotani A,Hakamata H,et al. Column switching high-performance liquid chromatography with two channels electrochemical detection for high-sensitive determination of isoflavones[J]. J Chromatogr A,2010,1217(17):2986-2989.
[14]Rao RN,Kumar KN,Shinde DD. Determination of rat plasma levels of sertraline enantiomers using direct injection with achiralchiral column switching by LC-ESI/MS/MS[J]. J Pharm Biomed Anal,2010,52(3):398-405.

