乌鸡低聚肽铁配合物的稳定性研究*
刘文颖,谷瑞增,林峰,鲁军,蔡木易
(中国食品发酵工业研究院,北京市蛋白功能肽工程技术研究中心,北京,100015)
铁是人体必需的微量元素之一,缺铁性贫血是我国常见的营养素缺乏病,主要通过服用补铁剂来防治,但常见的无机补铁剂吸收利用率很低,并且存在不同程度的胃肠道刺激和金属铁锈味等缺点。多肽铁配合物是一种新型的生物态铁,可直接被肠黏膜细胞吸收,吸收率远较无机铁高,并且天然安全,无消化道刺激,是理想的补铁剂。因此,通过酶解等手段从食物蛋白中获得生物活性短肽与铁配合,开发新型补铁产品,更符合现代消费者的需求[1,2]。
目前关于肽铁配合物的研究有一些报道,如猪血蛋白肽铁配合物、大豆肽铁配合物、米蛋白肽铁配合物等[3-5],但有关乌鸡低聚肽铁配合物的研究鲜有报道。乌鸡又名乌骨鸡(Gallus gallus domesticus Brisson),是传统的补气养血食材。乌鸡低聚肽是以乌鸡蛋白为原料,经过酶解后获得的小分子肽物质。本实验室前期研究结果表明,乌鸡低聚肽具有多种生理活性,并且具有吸收快、耗能低、易于被人体消化和吸收等特点[6-7]。以此为基础,利用乌鸡低聚肽制备肽铁配合物,能够多方面强化乌鸡补铁的功效。
但乌鸡低聚肽铁配合物作为食品原料,加工条件是否影响其稳定性目前尚不明确。因此,本文以乌鸡为原料制备乌鸡低聚肽铁配合物,以分子量分布和铁含量为指标,研究温度、pH值和蛋白酶消化对乌鸡低聚肽铁配合物稳定性的影响,以期为其在食品工业中的应用提供理论依据。
1 材料和方法
1.1 材料与仪器
1.1.1 材料
乌鸡,市售;抗坏血酸、氯化亚铁、无水乙醇、盐酸、氢氧化钠、硫酸亚铁铵、抗坏血酸、邻菲罗啉,北京化学试剂公司,分析纯;Alcalase 2.4L、木瓜蛋白酶、胃蛋白酶、胰蛋白酶,诺维信生物技术有限公司;三氟乙酸,英国Alfa Aesar公司,分析纯;乙腈,美国Fisher公司,色谱纯。
1.1.2 仪器
FE20K型pH计,瑞士梅特勒-托利多公司;YG30喷雾干燥机,无锡市阳光干燥设备厂;HH-4数显恒温水浴锅,普瑞斯机械有限公司;SHZ-3循环水多用真空泵,郑州朋来仪器有限公司;LC-20AD型高效液相色谱仪,日本岛津公司。
1.2 实验方法
1.2.1 乌鸡低聚肽铁配合物的制备
将乌鸡除去内脏,用水洗净后切块,用绞肉机绞碎,加适量水用匀浆机匀浆。转移到酶解罐中,用NaOH溶液调节pH值为8.5,升温恒定至60℃后,以每克蛋白质3000单位的酶量加入Alcalase 2.4 L,酶解2 h。之后调节pH值为7.0,温度保持60℃,以每克蛋白质2500单位的酶量加入木瓜蛋白酶,酶解2 h。酶解结束后,升温至100℃,保持10 min,灭酶。冷却后6 000×g离心15 min,取上清液。用截留分子量为2×106u的陶瓷膜过滤,以虹吸方法吸出中间清液,弃去上层油脂。然后用截留分子量为1 000 u的超滤膜超滤,得到分子量小于1 000 u的滤过液,将滤过液喷雾干燥,得到乌鸡低聚肽干粉。
称取8 g乌鸡低聚肽干粉,溶解于200 mL蒸馏水中。加入2.0 g抗坏血酸防止Fe2+被氧化。调节pH值为5。加入2.0 g FeCl2·4H2O,于50℃下水浴反应60 min,冷却至室温。加入4倍体积的无水乙醇,室温放置1 h。抽滤收集沉淀,干燥后制得海洋胶原低聚肽铁配合物样品,置于干燥器中保存。
1.2.2 肽铁配合物的分子量分布测定
用孔径0.2 μm聚四氟乙烯过滤膜将样品过滤,利用高效液相色谱仪进行凝胶过滤。流动相:V(乙腈)∶V(水)∶V(三氟乙酸)=45∶55∶0.1;进样体积:10 μL;流速:0.5 mL/min;检测波长:220 nm;柱温:30℃,利用紫外检测器检测,使用GPC软件处理数据。5种肽标准品为:乙氨酸-乙氨酸-乙氨酸(分子量189)、乙氨酸-乙氨酸-酪氨酸-精氨酸(分子量451)、杆菌酶(分子量1 450)、抑肽酶(分子量6 500)、细胞色素C(分子量12 500),分别配制成0.1%(M/V)溶液,过膜后进样,制作相对分子量校正曲线[8]。
1.2.3 肽铁配合物指标的测定
肽铁配合物经过不同温度、pH值和消化方式处理后,分别取5 mL转移至透析袋(分子质量8 000~14 000 u)中透析48 h后,测定铁离子含量。将硫酸亚铁铵配制成10 μg/mL铁离子标准溶液,分别取铁离子标准溶液 0、2.0、4.0、6.0、8.0、10.0 mL,加入10%抗坏血酸溶液2.0 mL,邻菲罗啉溶液3.0 mL,用蒸馏水定容至50 mL。37℃下反应60 min后,测定510 nm处的吸光度。以铁的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。然后称取0.05 g乌鸡低聚肽铁,加入1 mL HCl溶解,配制成0.1%乌鸡低聚肽铁溶液。称取1 mL溶液于50 mL容量瓶中,按照标准曲线步骤测定其吸光度。计算公式为:
铁含量/% =[C×10-3/(m×V1/V0)]×100
式中:C,标准曲线上查得样品试液相应的铁含量,μg;m,样品的质量,g;V1,测定时所取样品试液的体积,mL;V0,样品处理后的定容体积,mL。
螯合率/%=(m1/m0)×100
式中:m1为肽铁配合物中铁含量,mg;m0为加入反应体系中铁的总量,mg。
得率/%=(W1/W0)×100
式中,W1为肽铁配合物的总量,mg;W0为乌鸡低聚肽与铁盐的总质量,mg[9]。
1.2.4 热稳定性实验
将样品用蒸馏水配置成浓度为2 mg/mL的溶液,分装至50 mL离心管中,置于水浴锅中,分别在20、40、60、80 ℃下水浴,2 h 后冷却至室温,分别检测其分子量分布和铁含量。
1.2.5 酸碱稳定性实验
将样品配置成浓度为2 mg/mL的溶液,分装至50 mL离心管中,分别用1 mol/L HCl和1 mol/L NaOH调节各管pH为3、5、7、9,在37℃的水浴锅中放置2 h,冷却至室温后分别检测其分子量分布和铁含量。
1.2.6 体外模拟胃肠道消化实验
1.2.6.1 胃蛋白酶消化实验
将样品配置成浓度为2 mg/mL的溶液,将40 mL溶液置于50 mL离心管中,用1 mol/L HCl调节pH为2,在37℃的水浴锅中预热片刻,加入3%(E/S)胃蛋白酶,混匀后迅速取出样品20mL于另外1支50 mL离心管,沸水中灭酶活10 min,以此作为样品消化前对照。取出后,将剩余20 mL样品置于37℃水浴锅中消化3 h,沸水中灭酶活10 min,冷却至室温后分别检测消化前后的样品的分子量分布和铁含量。
1.2.6.2 胰蛋白酶消化实验
将样品配置成浓度为2 mg/mL的溶液,将40 mL溶液置于50 mL离心管中,用1 mol/L NaOH调节pH为6.8,在37℃的水浴锅中预热片刻,加入3%(E/S)胰蛋白酶,混匀后迅速取出样品20 mL于另外1支50 mL离心管,沸水中灭酶活10 min,以此作为样品消化前对照。取出后,将剩余20 mL样品置于37℃水浴锅中消化3 h,沸水中灭酶活10 min,冷却至室温后分别检测消化前后的样品的分子量分布和铁含量。
1.2.6.3 胃蛋白酶消化后再胰蛋白酶消化实验
按照1.2.6.1 的方法进行胃蛋白酶消化后,用1 mol/L NaOH调节pH为6.8,在37℃的水浴锅中预热片刻,加入3%(E/S)胰蛋白酶,混匀后迅速取出样品20 mL于另外1支50 mL离心管,沸水中灭酶活10 min,以此作为样品消化前对照。取出后,将剩余20 mL样品置于37℃水浴锅中消化3 h于沸水中灭酶活10 min,冷却至室温后分别检测消化前后的样品的分子量分布和铁含量。
1.2.7 统计学处理
实验数据采用SPSS 13.0软件进行统计处理,组间比较采用t检验,若P<0.05,两者有显著性差异。
2 结果与讨论
2.1 乌鸡低聚肽铁配合物的螯合率和得率
乌鸡低聚肽铁配合物的螯合率为83.92% ±0.13%,得率为41.49% ±0.14%。与方法相同的同类工艺相比[10],螯合率与得率相对较高。本研究中心前期研究结果表明,乌鸡低聚肽铁配合物中的Fe2+与低聚肽中 NH2+以及-COO-形成了配位键,与乌鸡低聚肽相比,物质结构发生了变化。因此,乌鸡低聚肽铁配合物是一种新型的肽铁配合物。
2.2 乌鸡低聚肽铁配合物的热稳定性
乌鸡低聚肽铁配合物分别在20、40、60、80℃水浴2 h之后,其分子量分布如表1所示。乌鸡低聚肽铁配合物经过不同的温度处理后,分子量分布基本没有变化,各个分子量区间的比例变化不超过2%,分子量小于1 000 u的总含量均在85%左右。不同温度处理后,乌鸡低聚肽铁配合物的铁含量如图1所示。与对照相比,乌鸡低聚肽铁配合物的铁含量无显著性差异(P>0.05),表明乌鸡低聚肽铁配合物经过不同温度处理后,铁含量无变化,乌鸡低聚肽铁配合物具有较好的热稳定性。这可能由于乌鸡低聚肽仅具有蛋白质结构中的一级结构,相对比较稳定,因此对温度作用的耐受能力强一些。包小兰[11]对大豆肽钙复合物的热稳定性进行了研究,结果表明大豆肽钙复合物对高温加热具有较好的稳定性,与本文结果一致。

表1 不同温度下乌鸡低聚肽铁配合物的分子量分布Table 1 Molecular weight distribution of BSFP-Fe treated by different temperatures
2.3 乌鸡低聚肽铁配合物的酸碱稳定性

图1 不同温度下乌鸡低聚肽铁配合物的铁含量(*P <0.05)Fig.1 Iron content of BSFP-Fe treated by different temperatures(*P <0.05)
乌鸡低聚肽铁配合物在pH值分别为3、5、7、9的条件下水浴2 h之后,其分子量分布如表2所示。乌鸡低聚肽铁配合物经过不同的pH值处理后,分子量分布有一定的变化,但变化不大。由表2可以看出,乌鸡低聚肽铁配合物在性条件和碱性条件下,分子量小于1 000u的总含量略有升高,但升高不超过6%。可能由于肽与铁形成的大分子环状结构在强酸或强碱的作用下断裂,形成小分子的结构。乌鸡低聚肽铁配合物在pH 7的条件下,分子量小于1 000 u的总含量升高最少,总含量为86.18%。

表2 不同pH值下乌鸡低聚肽铁配合物的分子量分布Table 2 Molecular weight distribution of BSFP-Fe treated by different pH values
乌鸡低聚肽铁配合物在不同pH值条件下的铁含量如图2所示。与对照相比,不同pH值处理下的乌鸡低聚肽铁配合物的铁含量均显著性降低(P<0.05)。从图2可以看出,在中性条件下,铁含量降低较少,而在强酸强碱条件下,铁含量降低较多,但在pH为3~9的范围内,乌鸡低聚肽铁配合物仍然有58.4%以上的铁含量,这表明乌鸡低聚肽铁配合物中肽与铁的结合具有一定的稳定性。
2.4 乌鸡低聚肽铁配合物的体外消化稳定性

图2 不同pH值下乌鸡低聚肽铁配合物的铁含量(*P <0.05)Fig.2 Iron content of BSFP-Fe treated by different pH values(*P <0.05)
乌鸡低聚肽铁配合物分别经胃蛋白酶、胰蛋白酶、先胃蛋白酶后胰蛋白酶消化后,其分子量分布如表3所示。乌鸡低聚肽铁配合物经过不同的消化模式处理后,分子质量分布有一定的变化,但变化不大。经过蛋白酶消化后,乌鸡低聚肽铁配合物的组分中分子量小于1 000 u的总含量略有升高,但升高不到8%,分子量小于1 000 u的总含量在85% ~93%。与未消化对照组相比,经过消化后,大于1 000 u和500~1 000 u的组分所占比例略有降低,140~500 u和小于140 u的组分所占比例略有升高。这表明分子量相对较大的肽段经过蛋白酶消化后分解成小分子量的肽段或氨基酸。包小兰[11]研究了大豆肽钙复合物的消化稳定性,结果表明经过胃蛋白酶和胰蛋白酶消化作用后,大豆肽钙复合物中大分子量组分含量减少,小分子量组分含量增加,但变化不明显,因此大豆肽钙复合物对消化酶的降解具有一定的耐受性。

表3 不同消化方式下乌鸡低聚肽铁配合物的分子量分布Table 3 Molecular weight distribution of BSFP-Fe treated by different digestion modes
经过不同消化方式处理后,乌鸡低聚肽铁配合物的铁含量如图3所示。与对照相比,乌鸡低聚肽铁配合物在胃蛋白酶、胰蛋白酶分别消化作用3 h后,铁含量分别为57.1%、50.2%,先经过胃蛋白酶消化再经过胰蛋白酶消化后,乌鸡低聚肽铁配合物仍然有37.6%的铁含量。这说明乌鸡低聚肽铁配合物具有一定的耐受胃蛋白酶和胰蛋白酶的作用。聂瑞艳等[12]考察了罗非鱼鱼鳞肽钙复合物的消化稳定性,结果表明肽钙复合物经过胃蛋白酶、胰蛋白酶共同作用后,钙结合量降低了32%,证明其具有一定的抗消化性。
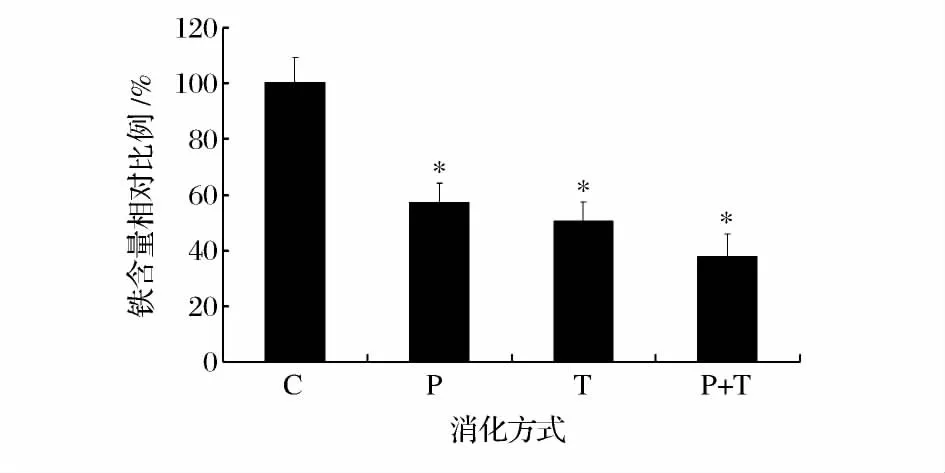
图3 不同消化方式下乌鸡低聚肽铁配合物的铁含量(*P <0.05)Fig.3 Iron content of BSFP-Fe treated by different digestion modes(*P <0.05)
从消化稳定性实验结果可以看出,乌鸡低聚肽铁配合物的组分中分子量小于1 000u的总含量增加不到8%,但其铁含量降低了62.4%,分子量较小的变化导致铁含量较大的变化。乌鸡低聚肽铁配合物的酸碱稳定性实验结果中也表明了这一点,分子量小于1 000 u的总含量增加不到6%,但铁含量降低了41.6%。因此,乌鸡低聚肽的结构可能是影响乌鸡低聚肽铁配合物中铁含量的重要因素。
3 结论
本研究以乌鸡为原料制备出乌鸡低聚肽铁配合物,并对乌鸡低聚肽铁配合物的热稳定性、酸碱稳定性和消化稳定性进行了考察。结果表明,乌鸡低聚肽铁配合物具有良好的热稳定性,各个分子质量区间的比例变化不超过2%,配合物的铁含量无显著性差异;在酸性和碱性条件下,分子质量小于1 000 u的总含量略有升高,但升高不到6%,铁含量有所降低,但仍然有58.4%以上的铁含量;经过蛋白酶消化后,分子量小于1 000 u的总含量略有升高,但升高不到8%,经过胃蛋白酶消化和胰蛋白酶共同消化后,仍然有37.6%的铁含量。乌鸡低聚肽铁配合物的这些特性有利于在食品加工中的应用,并且被人体摄入后,能在体内发挥原有的生理活性。乌鸡低聚肽铁配合物可作为一种新型的生物态铁,开发成适用于病人和特殊人群的营养与功能食品。
[1] 刘永,叶娴,韦寿莲.罗非鱼鳞胶原蛋白肽铁螯合物制备工艺的优化[J].精细化工,2013,30(7):761-765.
[2] 郑炯,汪学荣,阚建全.血红蛋白多肽螯合铁的抗贫血功能研究[J].食品工业科技,2009,30(10):312-314.
[3] 汪学荣,郑炯,阚建全.猪血多肽铁螯合盐的制备工艺[J].食品与发酵工业,2010,36(6):89-93.
[4] LÜ Y,LIU Q,BAO X,et al.Identification and characteristics of iron chelating peptides from soybean protein hydrolysates using IMAC Fe3+[J].Journal of Agricultural and Food Chemistry,2009,57(11):4 593-4 597.
[5] 曹银娣,陈巧云,熊华,等.米蛋白肽铁的螯合条件优化[J].食品与发酵工业,2007,33(4):61-64.
[6] 刘文颖,马永庆,金振涛,等.乌鸡低聚肽体外抗氧化活性研究[J].食品与发酵工业,2010,36(10):19-23.
[7] GU R Z,LIU W Y,LIN F,et al.Antioxidant and angiotensin I-converting enzyme inhibitory properties of oligopeptides derived from black-bone silky fowl(Gallus gallus domesticus Brisson)muscle[J].Food Research International,2012,49(1):326-333.
[8] 林峰,马勇,徐亚光,等.基于分子质量分布的食源性低聚肽品质评价研究[J].食品与发酵工业,2008,34(9):128-131.
[9] 宋莎莎,高菲,任迪峰,等.乌鸡肽铁(Ⅱ)螯合物的制备及红外光谱鉴定[J].食品与发酵工业,2013,39(6):13-17.
[10] 蔡冰娜,陈忻,潘剑宇,等.响应面法优化鳕鱼皮胶原蛋白肽螯合铁工艺[J].食品科学,2012,33(2):48-52.
[11] 包小兰.大豆肽与钙结合形成可溶性复合物的机制及其稳定性的研究[D].北京:中国农业大学,2007.
[12] 聂瑞艳,刘月娇,刘敏,等.罗非鱼鱼鳞肽钙复合物的稳定性研究[J].食品工业科技,2014,35(4):88-91.

