硒含量对大鼠心肌表观遗传因子的作用分析*
陕西省人民医院心内二科(西安710068) 杨 光 朱延河 魏 瑾 董 新 朱参战 高登峰
最新数据表明,一些膳食补充剂,包括硒(Se),通过对细胞表观遗传过程的调控,可预防多种疾病(如癌症、阿尔茨海默氏病、心脏疾病等),其中可能的机制为硒通过抑制DNA转移酶的表达和活性,影响DNA和组蛋白的表观遗传修饰调控的一些抗癌基因的表达,但具体是何种因子起决定作用尚未可知[1]。为了确定DNA甲基化修饰在由硒缺乏诱导的心肌损伤中作用并探索其潜在机制,本文将进行具体探讨。
资料与方法
1 动物模型与样品采集 60只8周龄非特异性病原体(SPF)级SD(Sprague Dawley)雄性大鼠,体重约为250g,购自维通利华实验所(VRL,北京)。所有大鼠以缺硒的圆酵母为基础日粮,含圆酵母300g/kg,DL-蛋氨酸3g/kg,蔗糖590g/kg,玉米油50g/kg,缺硒 AIN-76A矿物组合35g/kg,碳酸钙12g/kg,AIN-76A维生素混合物10g/kg,重酒石酸胆碱0.1g/kg和甲萘醌亚硫酸氢钠复合物0.01g/kg,并按照0,0.1、2mg/kg的亚硒酸钠饲料,进行膳食补充。将上述大鼠正常喂养1周后,随机分为3组,每组15只,含正常对照组,充足硒饲料组,缺硒饲料组。禁食过夜的大鼠用氯胺酮(Ketamine,100mg/kg)麻醉,通过颈动脉插管法,观测血流动力学变化,通过含有EDTA的注射器心脏穿刺收集血液,得到最终浓度为约1g EDTA/L的血液,之后处死大鼠,将心脏取出,用生理盐水冲洗,在4%多聚甲醛4℃下储存,然后,心肌组织切片脱水,石蜡包埋,进行伊红染色(HE),观察心肌的炎症细胞浸润。
2 细胞模型研究 新生大鼠心室肌细胞原代培养,参照早期文献得到。简单地说,取2d龄新生SD大鼠,皮肤消毒后 ,开胸取心脏,用0.06%胰蛋白酶的Hank平衡液于4℃离解过夜,培养基中清洗,然后用含胶原酶II,0.1%(W=V)HBSS溶液经过一系列的消化(37℃75rpm,8min),收集细胞,并重新悬浮于培养基中,自然沉降收集除第1次以外的细胞,悬液于离心试管中,将上述细胞悬液接种于6孔板中,溴脱氧尿甙(BrdU,100uM;Sigma-Aldrich公司)加入到生长培养基中3~4d,以消除增殖的成纤维细胞和祖细胞,确保大于95%剩余心肌细胞是杆形的和存活后,将细胞接种于在6孔板中,贴壁生长24h,用亚硒酸盐处理,7/14d加入5-氮-2'-脱氧胞(5-aza-dC),处理试剂每两天换一次[2]。
心肌细胞裂解物用10%SDS-PAG分离并转移至硝酸纤维素膜上,使用 Toll样受体2(Toll-like receptor 2,TLR2),细胞间黏附因子-1(Intercellular Adhesion Molecule 1,ICAM1)和β-肌动蛋白抗体(圣克鲁斯生化科技公司,Santa Cruz)和辣根过氧化物酶标记的二抗检测TLR2,ICAM1和β-肌动蛋白。ECL检测系统(安玛西亚,Arlington Heights)检测蛋白条带。抗GSTP1和DNMT1抗体分别稀释到1∶2000和1∶500。蛋白条带置于X射线胶片,用增强的化学发光系统(Pierce公司,Rockford)观测。实验中,通过AFS 2201A氢化物原子吸收光谱(北京万拓仪器公司)测定血硒浓度[3]。
结 果
1 体重、心脏重量及心脏重量/体重 不同硒浓度处理影响大鼠体重增加。缺硒饲料组体重明显低于对照组(P<0.001);同时硒补充饮食组大鼠体重也显著高于缺硒组(P<0.001)。与体重一致,缺硒组心脏重量明显低于对照组(P<0.001)和硒补充饮食组(P<0.001)。同样,缺硒组的心脏重量/体重比值明显低于对照组(P<0.001)和硒补充饮食组(P<0.001)。
2 动物模型研究 不同硒浓度处理影响大鼠体重增加,饲喂硒充足饲料(0.1mg/kg)的大鼠体重为343±4g超过饲喂缺硒(278±2g),而硒的补充饮食大鼠体重(317±3g)也高于缺硒组,组间比较差异显著(P<0.01)。血流动力学的结果表明,LVP,+DP/DT max和-dp/dt max的缺硒组较对照组显著降低(t=56.29,14.89,P<0.05)。
3 HE染色结果 HE染色显示饲喂缺硒饲料大鼠比饲喂硒的补充日粮大鼠心肌的炎症细胞浸润更丰富。相反,当大鼠喂食适当的硒食物(0.1mg/kg),可以显著减少心肌浸润的炎症细胞。
4 各组大鼠的血清硒浓度 饲喂缺硒饲料大鼠的血清硒浓度为0.031±0.001ug/ml,显著低于喂食充足硒饲料大鼠0.112±0.002ug/ml。同样,饲喂硒适当的饮食(0.1mg/kg)大鼠血清硒浓度(0.095±0.001 ug/ml)显著低于喂食高浓度硒饲料(2mg/kg)大鼠,组间比较差异有显著性(t=140.29,29.44,P<0.001)。
5 甲基化状态和TLR2在大鼠心肌中的表达水平 喂食缺硒饲料大鼠的DNA甲基化水平(33.4±4.3%)较喂食充足硒饲料大鼠(100.0±3.6%)降低66.8±11.5% (t=11.86,P<0.001),但其 TLR2的蛋白水平(245.0±13.5%)较喂食充足硒饲料大鼠100.0±10.3)升高121.3±58.5%(t=20.51,P<0.001)。可见,硒处理可增加心肌DNA甲基化的水平,并抑制TLR2的表达。
6 细胞培养的研究
6.1 DNA甲基化降低与缺硒新生大鼠:心肌细胞TLR2的表达的再活化通过 MS-PCR,RT-PCR和Western blot分析验证大鼠心肌细胞的甲基化状态和TLR2和ICAM1的表达。将在缺硒(0μM)环境与0.5或1.5μM的硒环境下的大鼠心肌细胞进行比较(附图A),在缺硒环境下,心肌细胞具有显著较低的(TLR2和ICAM1)启动子甲基化水平(在本次研究中为对照组的12.1±1.7%,P<0.001),但显著更高的为 1.5μMTLR2mRNA和蛋白水平(分别为对照组的341±49%及449±102%,P<0.001),ICAM1mRNA和蛋白水平(分别为对照组的265±37%及231±44%,P<0.001),通过亚硒酸钠治疗可部分激活TLR2和ICAM1的启动子甲基化和抑制TLR2和ICAM1的表达。
为确定负责启动子低甲基化和上调TLR2的基本机制,将大鼠心肌细胞分别用不同浓度的硒和5-azadC进行处理7d。MS-PCR结果显示,5-aza-dC处理没有改变TLR2和ICAM1启动子的甲基化状态(附图B、C),在研究中使用硒的剂量为无毒的剂量,造成轻微的细胞生长抑制与14%细胞数量的降低。在研究中使用的5-aza-dC是对DNA甲基化的最佳效果的处理剂量,但是对细胞造成显著杀伤。
通过亚硒酸钠处理的细胞的TLR2和ICAM1的mRNA和蛋白表达的结果与MS-PCR检测方法一致,补硒处理组细胞TLR2和ICAM1的mRNA及蛋白表达较缺硒处理组均降低(分别为对照组的78%±6%),但5-aza-dC处理存在差异(附图C)。
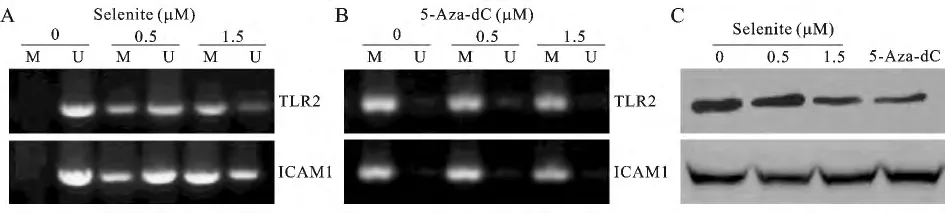
附图 不同硒浓度下大鼠心肌细胞蛋白表达水平
6.2 Gadd45α可能介导大鼠心肌硒缺乏对DNA去甲基化的影响:为确定亚硒酸钠处理是否会改变大鼠心肌细胞的生长停滞与DNA损伤诱导蛋白45α(growth arrest and DNA damage inducible alpha,Gadd45α)的活性,用亚硒酸盐或者5-aza-dC处理大鼠心肌细胞,通过RT -PCR和 Western blot分析检测mRNA和DNMT1、Gadd45α蛋白水平。经1.5μM 亚硒酸盐处理的大鼠心肌细胞,Gadd45α的蛋白水平随时间显著下降 (P<0.01),而用5-aza-dC处理4d的心肌细胞显示,DNMT1蛋白的显著减少 (为对照组的32.3±10.1%,P<0.01),但并没有改变 TLR2和Gadd45α的表达 (分别为对照组的97.1±11.3%和12.5±21.8%,P>0.05)。
讨 论
克山病表观遗传中,受DNA甲基化和翻译组蛋白修饰影响,二者在基因表达调控和维持细胞功能的调节这两方面起着重要作用[4]。
本研究以大鼠心肌细胞为模型系统,通过与正常大鼠心肌细胞对比,研究亚硒酸盐处理前后缺硒大鼠心肌细胞,TLR2、ICAM1及其蛋白含量变化,来阐明TLR2和ICAM1的表观遗传调控机制[5]。我们的结果表明,缺乏硒饮食将增加TLR2和ICAM1的蛋白水平,而硒处理后,将降低TLR2,ICAM1和DNMT1的蛋白水平,且亚硒酸钠对上述3个基因的作用呈剂量和时间相关性。结果表明[6],硒可以通过DNA甲基化相关的染色质修饰抑制某些炎性基因的表达。
DNA甲基化转移酶(Dnmt1)主要功能是维持DNA的CpG甲基化,其活性的高低是影响DNA甲基化水平的重要因素[7],但是本次实验,低硒使得甲基化酶Dnmt1表达上调,但基因组DNA甲基化水平却在一个较低水平,并有多个炎症因子相关基因发生低甲基化。这一矛盾现象说明这种基因组DNA甲基化水平逐渐下降现象可能不是通过下调或抑制DNA甲基化酶基因的作用实现的[8]。我们进一步证明了硒缺乏在Gadd45介导的DNA去甲基化中的作用。Gadd45α是抑癌基因p53和BRCA1的下游靶基因,多种DNA损伤因素例如电离辐射、紫外线照射、化疗药物等作用于细胞时,可以通过不同通路诱导Gadd45α的表达上调,而诱导表达增加的Gadd45α可参与细胞周期、细胞凋亡、DNA损伤修复、DNA脱甲基化以及信号传导等生命活动的调节。研究人员证明Gadd45a的过量表达会激活甲基化沉默报告质粒,并且促使全部的DNA去甲基化。进一步研究发现Gadd45a的敲除会导致基因表达沉默和DNA的高度甲基化,且近日浙江大学生命科学学院细胞与发育生物学研究所的研究人员在新研究中证实机体存在DNA主动去甲基化调控机制,生长阻滞与DNA损伤诱导蛋白Gadd45a在该过程中发挥了关键作用。硒缺乏饮食,增加Gadd45α表达和调制TLR2启动子低甲基化,而且效果呈剂量和时间相关性。这些结果表明,硒可能通过启动子再次甲基化,减少Gadd45α活性,来抑制或部分抑制这些基因。
本次实验结果表明,在缺硒饮食的大鼠心肌细胞活性DNA去甲基化过程Gadd45a蛋白可能起着关键性的调节作用。在缺乏硒的环境下,大鼠心肌细胞比细胞中硒的存在下培养的Gadd45α和炎性因子蛋白的表达显著增多。硒处理后,抑制去甲基化和炎症因子的表达,保护因炎症性细胞因子过度表达引起的大鼠心肌损伤,推测硒抑制Gadd45α活性,可能是因其化学预防活性的表现。今后将从硒对KD易感性、整体DNA和基因特异性DNA甲基化酶活性和DNA脱甲基酶的活性进行研究,以确定硒的预防作用是否可能是由于改变了DNA甲基化、DNA脱甲基酶和DNA转移酶的活性。
[1] Hou J,Wang T,Liu M,et al.Suboptimal selenium supply--a continuing problem in Keshan disease areasin Heilongjiang province[J].Biol Trace Elem Res,2011,143(3):1255-1263.
[2] Asrih M,Steffens S.Emerging role of epigenetics and miRNA in diabetic cardiomyopathy [J]. Cardiovasc Pathol,2013,22(2):117-125.
[3] Haas J,Frese KS,Park YJ,et al.Alterations in cardiac DNA methylation in human dilated cardiomyopathy[J].Embo Mol Med,2013,5(3):413-429.
[4] Webster AL,Yan MS,Marsden PA.Epigenetics and cardiovascular disease[J].Can J Cardiol,2013,29(1):46-57.
[5] Severin PM,Zou X,Gaub HE,et al.Cytosine methylation alters DNA mechanical properties[J].Nucleic Acids Res,2011,39(20):8740-87451.
[6] Haas J,Frese KS,Park YJ,et al.Alterations in cardiac DNA methylation in human dilated cardiomyopathy[J].Embo Mol Med,2013,5(3):413-429.
[7] Webster AL,Yan MS,Marsden PA.Epigenetics and cardiovascular disease[J].Can J Cardiol,2013,29(1):46-57.
[8] Severin PM,Zou X,Gaub HE,et al.Cytosine methylation alters DNA mechanical properties[J].Nucleic Acids Res,2011,39(20):8740-87451.

