交替糖蔗糖酶受体反应产低聚四糖及其条件优化
许 婷,缪 铭,张 涛,江 波
(江南大学食品科学与技术国家重点实验室,江苏无锡214122)
交替糖蔗糖酶(alternansucrase,EC2.4.1.140)最早是由 Côté[1]等发现,由肠膜明串珠菌 NRRL B-1355在蔗糖的诱导下分泌,该酶可以合成含有交替α-(1→3),α-(1→6)糖苷键的葡聚糖,故 Côté等人根据此种葡聚糖的结构特征将其命名为交替糖(alternan),而合成该糖的酶则将其命名为交替糖蔗糖酶。在对交替糖蔗糖酶进行研究时,Côté等发现,当反应体系中存在一些低分子量的受体糖分子时,交替糖蔗糖酶可以催化其合成含有交替α-(1→3),α-(1→6)糖苷键的低聚糖[2]。
交替糖蔗糖酶的受体反应产生的低聚糖产物具有一些优良的特性,Maria[3]等人研究了以蔗糖和麦芽糖为底物,由交替糖蔗糖酶催化生产的麦芽糖低聚糖的益生特性,发现其能促进肠道有益菌的生长,抑制有害菌的生长,是一种良好的益生元。此外,除了可以作为益生元,这些低聚糖还可以改善食品的苦味[4],增加某些糖类、黄酮类的溶解性[5-6]。
本实验研究了嗜柠檬酸明串珠菌 Leuconostoc citreum SK 24.002所产的交替糖蔗糖酶,在上清及细胞膜上的分布情况,并研究了反应时间、加酶量、pH、温度及底物浓度对该酶受体反应产低聚四糖的影响。
1 材料与方法
1.1 材料与设备
菌种 嗜柠檬酸明串珠菌Leuconostoc citreum SK 24.002,为实验室自筛菌种;蔗糖、果糖、麦芽糖、酵母粉、胰蛋白胨、磷酸氢二钾、无水氯化钙、硫酸镁、氯化钠、硫酸锰、硫酸铁、抗坏血酸、醋酸钠、冰醋酸、尿素、3,5-二硝基水杨酸、酒石酸钾钠、无水亚硫酸钠、牛白蛋白、考马斯亮蓝G250、溴酚蓝、β-巯基乙醇、甘氨酸等 均为分析纯,国药集团化学试剂有限公司;TEMED、过硫酸铵 均为分析纯,BBI公司。
Delta 320s型pH计 美国Metolee-toledo仪器有限公司;Centrifuge 5804R冷冻离心机 德国Eppendorf公司;Agilent 1260高效液相色谱仪 美国安捷伦公司;Optima L-80XP超速离心机 美国贝克曼公司;DV-2102 PC型紫外可见分光光度计 尤尼科(上海)仪器有限公司。
1.2 实验方法
1.2.1 菌种的发酵 发酵培养基成分为(g/L):蔗糖20、酵母粉7.5、胰蛋白胨7.5、磷酸氢二钾10、吐温80 10、无水氯化钙0.02、混合盐溶液20mL/L(混合盐成分:七水硫酸镁0.05g/L、氯化钠0.05g/L、一水合硫酸锰0.05g/L、七水合硫酸亚铁 0.25g/L、抗坏血酸0.25g/L),pH7.5。菌种接种量为 5%,接种后于30℃、160r/min的条件下培养20h。
1.2.2 酶活的分布 将培养20h后的发酵液于4℃下离心20min(8000r/min),分别得到上清和沉淀。所得沉淀用50mmol/L pH5.4的NaAc-HAc缓冲液清洗两遍。采用50mmol/L pH5.4 NaAc-HAc缓冲液溶解沉淀,并对其进行高压破碎,将所得裂解液于4℃,10000r/min下离心30min,得到上清(S1)和沉淀(P1)。再次用50mmol/L pH5.4 NaAc-HAc缓冲液洗涤P1两遍,之后用同样的缓冲液溶解。对S1进行超高速离心,即于4℃,35000r/min的条件下离心1h,得到上清(S2)和沉淀(P2),用 50mmol/L pH5.4 NaAc-HAc缓冲液洗涤P2两遍,之后用相同的缓冲液溶解。测定各部分:发酵液、发酵液上清、发酵液沉淀、S1、P1、S2、P2的酶活及蛋白含量,具体操作见1.3.1及1.3.2。
1.2.3 细胞膜上的酶的提取 将发酵液于4℃下离心 20min(8000r/min),用 50mmol/L pH5.4 NaAc-HAc缓冲液清洗沉淀两遍,得到湿菌体。据报道,利用尿素可以提取细胞膜上的酶[7],故采取用8mol/L尿素溶液处理菌体沉淀,具体操作为:将洗涤后的湿菌体充分混匀于8mol/L尿素溶液中,在0℃下处理1h(间接震荡摇晃),之后于8000r/min离心15min,取上清,将其于50mmol/L pH5.4 NaAc-HAc缓冲液中充分透析,所得透析后的溶液便为细胞膜上的酶的粗酶液。测定其酶活及蛋白含量,具体操作见1.3.1及1.3.2。
1.2.4 受体反应产低聚四糖的条件优化 以蔗糖为供体、麦芽糖为受体,细胞膜上的交替糖蔗糖酶为酶液,进行受体反应产低聚四糖(DP4)。研究不同加酶量、pH、温度、底物浓度及反应时间对麦芽四糖产量的影响。
1.2.4.1 反应时间对产物DP4糖含量的影响 以蔗糖和麦芽糖为底物,反应体系为100g/L蔗糖+100g/L麦芽糖+0.3U/mL的酶液,反应在50mmol/L pH5.4的醋酸缓冲体系中进行,反应温度为40℃。分别于10、20、30、40、50、60min、2、3、4、5、6h 取样,测定其DP4糖含量。各组反应重复三次。
1.2.4.2 加酶量对产物DP4糖含量的影响 以蔗糖和麦芽糖为底物,反应体系为:100g/L蔗糖+100g/L麦芽糖+不同加酶量,加酶量分别为:0.1、0.2、0.3、0.4、0.5、0.6U/mL。反应在 50mmol/L pH5.4 的醋酸缓冲体系,40℃下进行,采取最优反应时间,反应结束后对各组DP4糖含量进行测定。各组反应重复三次。
1.2.4.3 反应体系pH对产物DP4糖含量的影响 以蔗糖和麦芽糖为底物,在最优时间和最适加酶量的条件下,分别用 NaAc-HAc缓冲液和 Na2HPO4-NaH2PO4缓冲液将反应体系的pH调至3.0、4.0、5.0、6.0、7.0、8.0,其他条件同上,反应结束后测定各组DP4糖的含量。各组反应重复三次。
1.2.4.4 反应温度对产物DP4糖含量的影响 以蔗糖和麦芽糖为底物,在最优时间、最适加酶量与最适pH 的条件下,分别于 25、30、40、50、60℃ 下反应,其他条件同上,反应结束后测定各组DP4糖的含量。各组反应重复三次。
1.2.4.5 底物浓度比例对产物DP4糖含量的影响 以蔗糖和麦芽糖为底物,在最优时间、最适加酶量、最适pH及最适温度的条件下,改变供体分子蔗糖与受体分子麦芽糖的比例进行反应,采取的比例(蔗糖∶麦芽糖)为:5∶1,4∶1,3∶1,2∶1,1∶1,1∶2,1∶3,1∶4,1∶5,其中,供体分子蔗糖的浓度为 100g/L,麦芽糖的浓度根据上述比例进行计算调整。反应结束后,测定各组酶反应产物中的DP4糖的含量。各组反应重复三次。
1.3 测定方法
1.3.1 酶活测定方法 反应体系为900μL 10%的蔗糖缓冲液+100μL酶液,反应前将底物10%的蔗糖缓冲液在40℃下保温30min,酶液在45℃下热处理30min[8]。反应温度为 40℃,时间为 30min。用 DNS方法[9]测定反应液中还原糖含量。酶活定义:在40℃下,每分钟产生1μmol果糖所需的交替糖蔗糖酶的含量。
1.3.2 蛋白含量的测定 采用考马斯亮蓝法,以牛白蛋白为标样。具体操作:每1mL样品加入5mL考马斯亮蓝试剂,充分混匀后静置5min,在595nm下测定吸光度。
1.3.3 受体反应产物DP4糖含量的测定 利用高效液相色谱HPLC对其含量进行测定。将受体反应的反应液煮沸5min以终止反应,然后按1∶1比例加入乙醇,混合均匀后于10000r/min下离心30min,取上清,用去离子水稀释三倍后上样。HPLC条件:Anglent 1260;色谱柱:APS-2 Hypersil(250mm×4.6mm);流动相:75%乙腈;流速:1.0mL/min;检测器:示差检测器;柱温:室温(25℃);进样量:10μL。受体反应的产物及DP4糖标准品的HPLC图见2.2.2中图2所示。
2 结果与分析
2.1 酶活分布
肠膜明串珠菌所产的交替糖蔗糖酶有部分存在于细胞膜上,而各部位的酶可以通过不同的离心速度进行提取分离[10]。将细胞裂解液在10000r/min下离心30min,所得到的沉淀P1基本为菌体碎片,所得上清S1继续在110000×g的条件下离心得到的沉淀P2为细胞膜上蛋白,而上清S2则为可溶性蛋白。图1为各部分比酶活大小的比较。

图1 各部位比酶活的比较Fig.1 Comparison of alternansucrases from different parts
从图1可以看出,各部位比酶活中,膜蛋白(P2)比酶活最大,可见由该肠膜明串珠所产的交替糖蔗糖酶主要分布在细胞膜上,而分布于上清中的酶活很低。所以在后续研究中,以细胞膜上的酶为研究对象。
2.2 受体反应产DP4糖的条件优化
2.2.1 时间对产物DP4糖含量的影响 由图2可见,在反应前60min内,DP4产量较低,但速度较快;直至180min时,反应速度才有所降低,在此期间,DP4产量大幅增加;当时间达到300min时,DP4产量基本维持不变,可见此时反应体系已达到饱和状态。因而,从效率的角度考虑,300min为最优的反应时间,此时体系的反应已达到稳定,且时间较短,故接下来的受体反应的反应时间都采用300min,即5h。
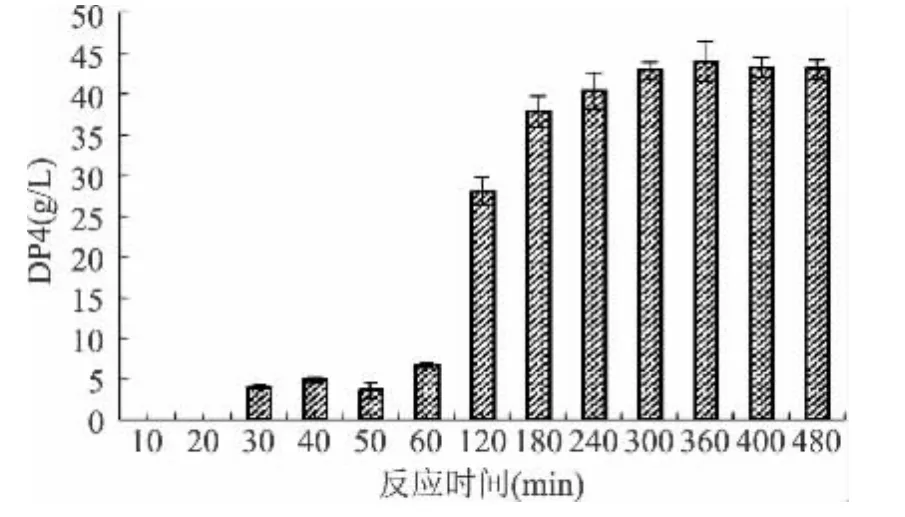
图2 反应时间对产物DP4糖含量的影响Fig.2 Effects of reaction time on DP4 yield
2.2.2 加酶量对产物DP4糖含量的影响 由图3可见,当加酶量不断增加时,DP4糖的含量也逐渐增加,在加酶量小于0.3U/mL时,DP4的产量增加的比较明显;当加酶量大于0.3U/mL时,虽然加酶量增加了,但是DP4的产量增加得较为缓慢,考虑到酶液的利用率,以DP4产量/加酶量为衡量标准,作为纵坐标,加酶量为横坐标作图,比较各种加酶量的条件下酶液的利用率。

图3 加酶量对产物DP4含量的影响Fig.3 Effects of enzyme contents on DP4 yield
从DP4浓度/加酶量与加酶量的关系可以看出(图4),当加酶量为0.3U/mL时,DP4浓度/加酶量的比例最大,即此时交替糖蔗糖酶的利用率较高;当加酶量大于0.3U/mL时,DP4浓度/加酶量的比例减小,可见加酶量过大时,交替糖蔗糖酶的利用率反而降低,可能是因为此时酶过量,产生抑制作用。故在后续实验中,采用0.3U/mL的加酶量。
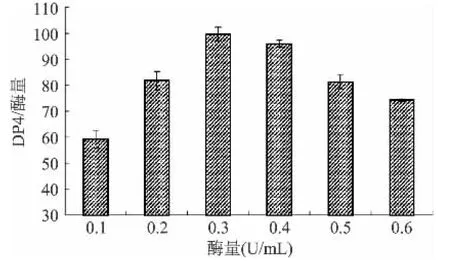
图4 DP4浓度/加酶量与加酶量的关系Fig.4 Correlation between enzyme content and DP4 yield/enzyme content
2.2.3 反应体系pH对产物DP4糖含量的影响 酶反应体系的pH会影响交替糖蔗糖酶的活性,继而可能会影响产物DP4糖的产量,故对不同pH(3.0、4.0、5.0、6.0、7.0、8.0)下反应的 DP4 糖的含量进行分析。所得结果见图5。

图5 反应pH对产物DP4糖含量的影响Fig.5 Effects of reaction pH on DP4 yield
从图5可以看出,pH对产物的影响还是比较大的。当pH为3时,DP4糖的产量只有5g/L,而当pH为4时,产量略有增加,达到约20g/L;当pH为5时,DP4糖的产量最大,达到43.7g/L,而pH为6时,产量略有下降;但是pH为7时,产量又急剧下降,甚至在pH为8时,DP4产量很低。可见当pH在5~6间时,DP4糖的产量最大,这与上清中的交替糖蔗糖酶酶的最适pH[8]是相符合的,故在接下来的实验中,采取pH为5.4的缓冲体系,即50mmol/L的pH5.4的NaAc-HAc缓冲液。
2.2.4 反应温度对产物DP4糖含量的影响 反应体系的温度会影响交替糖蔗糖酶的活性,进而影响反应产物DP4糖的含量。将相同的酶反应体系于不同的温度下反应,测定产物DP4糖的含量,所得结果见图6。

图6 反应温度对产物DP4糖含量的影响Fig.6 Effects of reaction temperature on DP4 yield
当反应温度为25℃时,DP4糖产量约为28g/L,温度升至30℃时,DP4糖产量大大增加,当温度升至40℃时,DP4糖产量达到最大值,接近50g/L;当温度继续上升,DP4糖产量又急剧下降,当温度升至60℃时,DP4产量甚至为零,此时酶活可能已经全部丧失。故确定最佳反应温度为40℃。
2.2.5 底物浓度比例对产物DP4糖含量的影响 在本实验的酶反应体系中,蔗糖为供体分子,麦芽糖为受体分子,当两者的比例不同时,蔗糖分子作为供体分子提供葡糖基的情况,以及麦芽糖分子作为受体分子接受受体分子的情况都有可能不同。即当蔗糖与麦芽糖浓度比例不同时,受体反应的产物情况也不同,但产物大致都包括DP3糖,DP4糖和DP5糖。先采取不同的蔗糖与麦芽糖比例进行酶反应,测定产物中的各成分含量。所得结果见图7。

图7 底物浓度比例对产物DP4糖、DP5糖、DP6糖含量的影响(S-蔗糖;M-麦芽糖)Fig.7 Effects of substrates concentrations on DP4 yield(S-sucrose;M-maltose)
由图7可见,蔗糖与麦芽糖浓度的比例对于受体反应的产物中DP3糖、DP4糖、DP5糖的分布影响很大。当两者的比例大于1∶1,即供体分子蔗糖的浓度大于受体分子麦芽糖的浓度时,受体产物中DP4糖的含量比DP3糖和DP5糖都高,DP3糖和DP4糖的含量都随着受体分子麦芽糖浓度的增加而逐渐增大,DP5糖的含量变化幅度则不大。这可能是因为在供体分子充足的情况下,除了蔗糖分子可以作为受体分子外,其受体反应产物DP3糖也可以作为受体分子,去竞争供体分子上的葡萄糖基,从而合成DP4糖;同样的,受体反应产物DP4糖仍可以作为受体分子接受麦芽糖分子提供的葡萄糖基合成DP5糖。但是受体分子连接的葡糖基越多,其继续竞争葡糖基的能力也会下降[11-12],故总体上DP3的产量最大,DP4次之,DP5的产量最少。DP5糖作为受体分子的竞争葡萄糖基的能力很弱,故反应体系中几乎不存在聚合度大于5的低聚糖了。
当供体分子蔗糖与受体分子麦芽糖的浓度比例小于1∶1,即受体分子的浓度大于供体分子的情况下,产物主要是DP3糖,DP4糖的产量也随着受体分子的浓度的增大而减少,而DP5的产量减少的幅度更大,在蔗糖与麦芽糖两者比例为1∶4和1∶5时,DP5产量甚至为零。这主要是由于受体分子麦芽糖的大量存在,导致供体分子相对不足,受体反应中葡糖基的转移大部分都以麦芽糖作为受体分子,而其受体反应产物DP3只有少量的能竞争到供体分子,合成DP4糖;而DP4糖作为受体分子,由于其碳链比麦芽糖、DP3糖长,竞争获取供体分子上的葡萄糖基的能力更低,而且DP4含量本身也较少,所以合成DP5糖的能力就更低,导致合成的DP5的含量非常小。
从上述结果中可以看出,在交替糖蔗糖酶的受体反应中,供体分子与受体分子的浓度比例对于产物中不同聚合度的低聚糖的分布有着较为明显的影响。所以,在以后的研究中,可以通过对反应体系中供体分子与受体分子的浓度比例的控制,有目的的来改变产物中不同聚合度的低聚糖的含量的分布,以获得目的产物。本课题的目标产物为DP4糖,故综合上述分子,采用供体分子蔗糖与受体分子麦芽糖的浓度比例为1∶1。
2.2.6 受体反应产物的HPLC图 由述实验确定最优条件:100g/L蔗糖+100g/L麦芽糖+0.3U/mL酶液,反应温度为40℃,反应体系50mmol/L pH5.4的醋酸缓冲液的反应体系,在该条件进行受体反应,其产物的HPLC检测结果如图8所示,图9为DP4标准品结果。
从图8、图9可以看出,在优化条件下进行的受体反应产物中,除了残余的底物(蔗糖和麦芽糖)以及副产物果糖外,主要低聚糖为DP3糖和DP4糖。结合DP4糖标准品的HPLC图,经计算,得出此条件下,DP4糖产量达52.8g/L,为本研究中最大产量。故确定受体反应最优条件。
3 结论
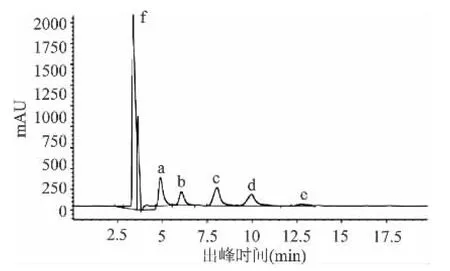
图8 受体反应产物HPLC图Fig.8 HPLC of receptor reactions of alernansucrase

图9 DP4糖标准品HPLC图Fig.9 HPLC of DP4 standard
本实验采用的嗜柠檬酸明串珠菌Leuconostoc citreum SK24.002在蔗糖的诱导下可分泌交替糖蔗糖酶,该酶同时分泌于发酵液和菌种的细胞膜上,通过差异离心法确定了该酶的分布状况,确定该酶主要分布在细胞膜上。该交替糖蔗糖酶可以以蔗糖为供体,麦芽糖为受体进行受体反应从而生产低聚糖,以产物中的DP4糖为指标,进行条件优化,得到最优条件为:100g/L蔗糖+100g/L麦芽糖 +0.3U/mL酶液,反应温度为40°C,反应体系50mmol/L pH5.4的醋酸缓冲液的反应体系,在此条件下,低聚四糖的产量最高可达52.8g/L。
[1]Côté G L,Robyt J F.Isolation and partial characterization of an extracellular glucansucrase from Leuconostoc mesenteroides NRRL B-1355 that synthesizes an alternating(1→6),(1→3)-α -D-glucan[J].Carbohydrate Research,1982,101:52-74.
[2]Gregory L,Côté,John F.Acceptor reaction of alternansucrase from Leuconostoc mesenteroides NRRL B-1355[J].Robyt Carbohydrate Research,1982,111:127-142.
[3]Gregory L Cote,Glenn R Gibson,Robert A Rastall,et al.Prebiotic properties of alternansucrase maltose- acceptor oligosaccharides[J].Journal of Agriculture and Food Chemistry,2005,53:5911-5916.
[4]Gregory L Côté.Acceptor products of alternansucrase with gentiobiose.Production of novel oligosaccharides for food and feed and elimination of bitterness[J].Carbohydrate Research,2009,344:187-190.
[5]Gregory L Côté,Christopher A Dunlap,Karl E Vermillion.Glycosylation of raffinose via alternansucrase acceptor reactions[J].Carbohydrate Research,2009,344:1951-1959.
[6]Anne Bertrand,Sandrine Morel,Francois Lefoulon,et al.Leuconostoc mesenteroides glucansucrase synthesis of flavonoid glucosides by acceptor reactions in aqueous-organic solvents[J].Carbohydrate Research,2006,(341):855-863.
[7]Shigeyuki Hamada,Toshis Horikoshi,Takahiro Minami,et al.Purification and characterization of cell - associated glucosyltransferase synthesizing water-insoluble glucan from Serotype c Streptococcusmutans[J].JournalofGeneral Microbiology,1989,135:335-344.
[8]López-Munguia A,Pelenc V,Remaudet M,et al.Production and purification of alternansucrase,a glucosyltransferase from Leuconostoc mesenterotdes NRRL B-1355,for the synthesis of oligoalternans[J].Enzyme and Microbial Technology,1993,15:77-85.
[9]张惟杰.复合多糖生化研究技术[M].上海:上海科技出版社,1987:1-2.
[10]James C Zahnley,Michael R Smith.Cellular Association of Glucosyltransferases cin Leuconostoc mesenteroides and Effects of Detergent on Cell Association[J].Applied Biochemistry and Biotechnology,2000,87:57-70.
[11]Robyt J F.Mechanism and action of glucansucrases[J].Progress in Biotechnology,1996,12:1-22.
[12]Robyt J F,Walseth T F.The mechanism of acceptor reactions of Leuconiostoc mesenteroides B-512F dexrtransucrase[J].Carbohydr.Res,1978,61:433-445.

