乳杆菌源抗菌肽的代谢条件优化及其特性研究
吴燕利,祁克宗,涂 健,汪雪雁,张 明,付瑞燕
(安徽农业大学,安徽合肥230036)
长期以来,抗生素在畜禽养殖中的广泛使用,造成许多病原菌对其产生耐药性而难以被消灭,增加了疾病爆发风险,而且畜禽产品中抗生素药物残留也严重威胁着人类的健康。抗生素的使用也严重破坏了动物肠道中的微生态平衡,影响畜禽产品的品质,进而影响畜禽养殖业的良性发展。抗菌肽因具有广谱抗菌作用且抗菌机理独特,而成为目前抗生素替代品和新型饲料添加剂及食品防腐剂的研究热点[1-2]。乳酸菌是食品中常见微生物,也是构成人和大多数动物天然的肠道菌群,其在代谢过程中能产生有机酸、二乙酰、过氧化氢及细菌素等活性物质,能够抑制致病微生物和腐败微生物生长,而被广泛应用[3-4]。乳酸菌源抗菌肽包括细菌素和类细菌素等活性物质,是乳酸菌在代谢过程中通过核糖体合成机制产生的一类分子质量小、无毒、具有抗菌活性的蛋白质、多肽或者前体多肽及其修饰物[5]。该类抗菌肽能抑制或杀灭其他微生物[6],而宿主乳酸菌对其有自身免疫性[7-8],还具有能被人和动物体内的蛋白酶降解、不在体内蓄积、不造成体内药物残留等优点[9];此外,乳酸菌还具有改善动物消化道微生态平衡、增强机体免疫力、促进机体营养利用及生长等特点[10],因而利用乳酸菌及其抗菌肽开发抗生素替代品及新型饲料添加剂在畜禽养殖业中有着潜在的应用价值。已有研究发现,乳杆菌能产生抑菌活性强、抑菌范围广的抗菌肽[11-13],能够抑制 DNA的合成。本实验通过比较三株乳杆菌的抑菌活性大小,从中筛选出了一株有较强抗菌活性的干酪乳杆菌,研究了其所产抗菌物质的特性,并优化了其产生抗菌肽的代谢条件,为该菌株及其抗菌肽在天然防腐剂和畜禽饲料添加剂上的研究开发利用奠定了科学基础。
1 材料与方法
1.1 材料与仪器
干酪乳杆菌(Lactobacillus casei 1.2435)、发酵乳杆菌(Lactobacillus fermentum 1.2133)、嗜酸乳杆菌(Lactobacillus acidophilus 1.1854) 中国普通微生物菌种保藏管理中心;大肠埃希氏菌(Escherichia coli CMCC44102)、金黄色葡萄球菌(Staphylococcus aureu ATCC25923)等 安徽农业大学基础病理实验室;MRS培养基 Oxoid公司;蛋白酶K Sigma公司;胰蛋白酶 BBI;木瓜蛋白酶和中性蛋白酶 Sangon;胃蛋白酶和α-淀粉酶 北京索莱宝科技有限公司。
真空冷冻干燥机 alpha-2型,德国chrst公司;离心机 2K15型,Sigma公司;紫外可见分光光度计 WFZ UV-2100,尤尼柯(上海)仪器有限公司;培养箱 SPX-250B-Z型,上海博讯实业有限公司。
1.2 实验方法
1.2.1 产抑菌物质乳酸菌的筛选 用接种环从冻存管中取出干酪乳杆菌、发酵乳杆菌和嗜酸乳杆菌分别于MRS斜面上划线,密封后于37℃培养至出现菌落,活化2次后挑取单菌落接种于MRS液体培养基中37℃过夜培养。取其过夜培养物,以1%的接种量接种到MRS液体中,37℃静置培养30h,培养液于4℃、8000×g离心10min收集上清液,用0.22μm无菌微孔滤膜过滤,制成浓缩液。以大肠杆菌和金黄色葡萄球菌为指示菌,琼脂扩散法[14]测定其抑菌活性,每种指示菌重复一次。
1.2.2 抑菌物质属性鉴定 取适量培养上清浓缩液于80℃水浴10min以排除H2O2,测定其抑菌活性;用6mol/L NaOH溶液将培养上清液调至 pH5.0,以pH5.0的乳酸溶液作对照测定其抑菌活性变化;将培养上清液用HCl、NaOH溶液分别调为酶的最适作用pH,分别加入ɑ-淀粉酶和胰蛋白酶,使其终浓度为1mg/mL,37℃温浴2h,将pH调回到5.0,测定上清液的抑菌活性。
1.2.3 无细胞发酵上清液的制备 将筛选出的抑菌乳酸菌于MRS液体中发酵培养,培养液于4℃、8000×g离心10min收集上清液,用5mol/L NaOH溶液调至pH5.0,再用0.22μm无菌微孔滤膜过滤,以除去菌体和其它杂质,冷冻浓缩,-20℃冰箱中备用。后续实验所用发酵液均采用此操作。
1.2.4 抑菌乳酸菌的生长量与抑菌活性相关性测定 取干酪乳杆菌的过夜培养物以1%的接种量接种到MRS液体中,37℃静置培养,定时取样,测定其10倍稀释培养物的OD600及其发酵上清液的抑菌活性,绘制抑菌活性与生长量关系曲线,分析二者之间的相关性。
1.2.5 产抑菌物质的最适培养条件优化 以干酪乳杆菌为发酵菌株,以大肠埃希氏菌为指示菌,对培养条件中的温度分别设置在 27、30、33、37、42℃,接种量分别设置为0.5%、1%、2%、4%、8%和装液量分别调整为5%、10%、20%、40%、60%,以 MRS液体为发酵培养基发酵36h,进行单因素分析,以检测这些因素对发酵上清液抑菌活性的影响。
为了提高发酵上清液的抑菌活性,根据单因素实验的结果,选择发酵时间、温度、接种量和装液量4个因素,并选取适当的3水平优化干酪乳杆菌产抗菌肽的最佳培养条件,设计了L9(34)正交实验(如表1)。根据正交实验分析表,安排了9组实验(如表3),每组3个平行,所有实验组均于厌氧条件下静置培养,随后分别取样测定发酵上清的抑菌圈直径。
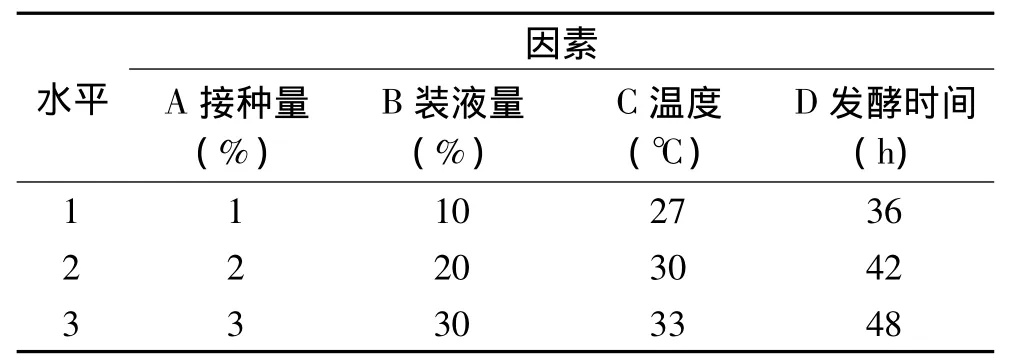
表1 正交分析表Table 1 The table of orthogonal analysis
1.2.6 发酵上清液对温度、pH和酶的稳定性 a.取等量发酵上清液(pH5.0),分别在 60、80、100 和121℃保持10、30min,于冰中迅速冷却后测定其抑菌活性;b.取等量发酵上清液,用HCl、NaOH分别调pH为2~10,37℃下温育2h后测定其抑菌活性;c.取等量发酵上清液,用 HCl、NaOH调到酶的最适作用pH,分别加入中性蛋白酶、胃蛋白酶、蛋白酶K和木瓜蛋白酶,使其终浓度为1mg/mL,37℃温浴2h,将pH调回到5.0,测定其抑菌活性。
1.2.7 发酵上清液对指示菌的作用方式 取4mL发酵上清浓缩液加入到20mL培养到稳定期的大肠埃希氏菌CMCC44102菌液中,37℃培养,每隔1h从中取适量菌液稀释10倍后测定OD600,并取1mL菌液进行梯度稀释后,平板计数法测定其活菌数。以4mL MRS浓缩液处理的大肠埃希氏菌培养液作为对照。
1.2.8 抑菌谱的测定 利用琼脂扩散法,制作含不同指示菌的平板,指示菌终浓度为106CFU/mL(酵母菌为104个/mL),取发酵上清液40μL加入孔内,于各指示菌最适生长温度下培养适当时间,用游标卡尺测量各抑菌圈直径。
2 结果与分析
2.1 产抑菌物质乳酸菌的筛选结果
分别收集三种乳杆菌的培养上清液,以大肠埃希氏菌、金黄色葡萄球菌为指示菌,采用琼脂扩散法分析其抑菌圈大小,结果如图1,可知三种乳杆菌均有抑菌活性,其中干酪乳杆菌的抑菌圈最为明显,对大肠埃希氏菌的抑菌圈直径达到20.08mm(孔径为7mm)。

表2 抑菌物质性质的研究Table 2 The study on nature of antimicrobial components

图1 三株乳杆菌发酵上清液的抑菌作用Fig.1 Antimicrobial activity of fermentation supernatants from three lactobacillus
2.2 抑菌活性物质属性鉴定
乳酸菌在代谢过程中产生的强氧化剂H2O2以及乳酸、乙酸等有机酸能够强烈抑制微生物生长,尤其抑制G-菌的生长。利用H2O2对热不稳定的特性,通过热处理来去除H2O2的作用,处理前后的抑菌圈直径基本无变化;以pH5.0的有机酸溶液为对照,检测同样条件下的发酵液仍有很高的抑菌活性;经ɑ-淀粉酶处理前后的发酵上清液的抑菌圈大小无显著变化,而经胰蛋白酶处理后的发酵上清液,抑菌圈消失,结果见表2。这些说明了发酵上清液中起主要抑菌作用的物质既不是H2O2和有机酸也不是多糖,而是蛋白质类,是一种细菌素类抗菌肽,且该蛋白无糖基化结构或者其活性不依赖于糖基化。
2.3 生长量与抑菌活性的相关性
干酪乳杆菌在MRS液体中于37℃培养,其生长量OD600和发酵上清液抑菌活性随时间的变化曲线如图2所示。该菌株在6h时已度过了延滞期而进入对数生长期,18h开始进入稳定期,在60h后菌株开始衰亡;抑菌物质在稳定期初期(18h)开始产生,进入稳定期后其产量继续增加,在稳定期中期36h后其产量不再增加,其抑菌活性基本维持稳定,60h后其抑菌活性开始下降。其活性下降的原因可能是抗菌肽被菌体衰亡过程中产生的蛋白酶降解,或是被吸附到菌体上,也可能是反馈调节作用抑制其产生[15]。
2.4 产抑菌物质的最适培养条件优化

图2 发酵上清抑菌活性与生长量的相关性Fig.2 The correlation of antibacterial activity of fermentation supernatant and growth of lactobacillus
2.4.1 培养温度对菌体密度及发酵液抑菌效果的影响 由于温度能够影响生物膜的液晶结构以及蛋白类酶活性从而影响微生物的生命活动[16],影响代谢产物的类型及产量,进而影响其抑菌活性。当以1%接种量和40%装液量为基础条件,培养温度对菌体密度和发酵液抑菌活性的影响如图3。由图3可知,该菌株在37℃下菌体生长状况最好(菌体密度最高),但在30℃下培养时的发酵液抑菌圈直径最大,随着温度的升高,该菌株的生物量及其产物抑菌圈直径均明显减小,原因是由于干酪乳杆菌的最适生长温度为37℃,但是最适生长温度只能说明该温度有利于其生长繁殖,并不等于也有利于其产生抗菌肽。故选择30℃作为其最佳发酵温度。

图3 温度对菌体密度及其发酵液抑菌活性的影响Fig.3 Effect of culture temperature on antimicrobial activity of fermentation liquid and growth of lactobacillus
2.4.2 接种量对发酵液抑菌活性的影响 由于接种量的高低直接影响着菌株延滞期的长短及其达到最大菌体量所需时间的长短,进而也影响了抗菌肽的产量。当以40%装液量于30℃培养为基础时,不同接种量对菌体密度和发酵液抑菌活性的影响如图4。由图4可知,较高接种量不是促进反而限制了菌体生长和抗菌肽的产生,原因可能是由于种子液中夹杂的一些菌体代谢产物影响了菌体的进一步生长,也可能是由于过高的接种量使得菌体浓度增长过快,造成营养物质过度消耗及有害代谢产物的积累增多,加速了细胞的衰亡。故选择2%作为发酵的最佳接种量。

图4 接种量对菌体密度及其发酵液抑菌活性的影响Fig.4 Effect of inoculum dose on antimicrobial activity of fermentation liquid and growth of lactobacillus
2.4.3 装液量对发酵液抑菌活性的影响 当以1%接种量于30℃培养为基础时,不同装液量5%、10%、20%、40%、60%对菌体密度和发酵液抑菌活性的影响如图5。由图5可知,装液量为20%时菌体量和抑菌圈直径都最大,装液量过高或过低均不利于菌体生长和抗菌肽的产生,原因可能是装液量过低,培养瓶中的氧气浓度过高,不利于厌氧菌的生长;而装液量过高时由于静置培养使得菌体集中于底部,产生了局部高浓度菌体,进而产生了局部高浓度的有害代谢产物,加速了菌体的衰亡并抑制了抗菌肽的产生,然而测定时将发酵液混匀后使得菌体浓度和抗菌肽浓度稀释。故选择20%为发酵的最佳装液量。
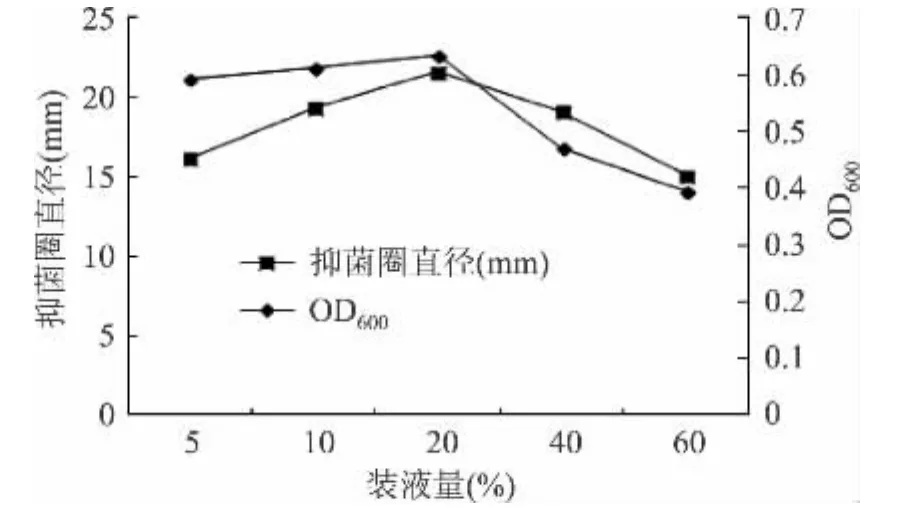
图5 装液量对菌体密度及其发酵液抑菌活性的影响Fig.5 Effect of broth volume on antimicrobial activity of fermentation liquid and growth of lactobacillus
2.4.4 正交实验确定产抑菌物质的最适条件 根据单因素实验的结果,以影响抗菌肽产生的接种量、装液量、温度、发酵时间为正交实验的四个设计因素,分别取三个水平。以最佳值及其左右值进行取值,但由于最初确定的发酵时间是在较高温度下,而最佳温度略低,最适发酵时间可能会延长,故将发酵时间作适当延长,而选择36、42、48h三个水平。根据L9(34)设计正交实验,实验方案和结果分析如表3。
由表3可以看出,影响发酵液抑菌圈直径的因素顺序为B>A>C>D,抗菌肽产生的最佳培养条件为A2B2C2D2。极差分析显示:装液量对发酵液抑菌圈直径影响最大,其次是接种量,而发酵时间对发酵液抑菌圈直径的影响最小。

表3 正交实验分组及结果Table 3 The groups and results of orthogonal tests
2.4.5 最适培养条件的验证 由于正交实验所得结果A2B2C2D2与单因素实验所得最佳条件A2B2C2D1不一致,为了确定代谢产抗菌肽最佳培养条件,按照两种组合方案分别进行5批次的发酵培养,并分别测定发酵液的抑菌圈直径。在A2B2C2D2培养条件下,抑菌圈直径为24.35mm,高于在A2B2C2D1培养下的抑菌直径为23.41mm(数据未显示)。为了得到干酪乳杆菌发酵上清液有最佳的抑菌活性,故选择其代谢产生抗菌肽的最佳培养方案为A2B2C2D2,即干酪乳杆菌在装液量20%、接种量2%、培养温度30℃下静置培养42h时的发酵液上清的抑菌圈直径最大,也即代谢产生的抗菌肽含量最高。
2.5 发酵上清液对温度、pH和酶的稳定性
由表4中发酵上清液在不同热处理条件下的抑菌活性变化可知,60℃处理10、30min和80℃处理10、30min对其抑菌活性基本无影响,随着温度的进一步升高和时间的延长,抑菌活性有所下降,121℃处理30min后,抑菌活性下降了22.28%,但仍有较强的抑菌活性,说明该菌株所产抑菌物质具有一定的热稳定性;发酵上清液的抑菌活性随着pH的升高逐渐降低,当pH高于6.0抑菌活性明显下降,而在酸性环境中显示出较强的抑菌活性,可能是由于酸增强了该抑菌物质的稳定性,而且酸对指示菌也有一定的抑制作用,该抑菌物质与酸共同作用能更好的抑制指示菌的生长;发酵上清液经过胃蛋白酶处理后活性无明显变化,而经过蛋白酶K处理后抑菌活性下降了38.55%,经过木瓜蛋白酶、中性蛋白酶、胰蛋白酶处理后抑菌活性则完全丧失,原因可能是该抗菌肽未被胃蛋白酶酶解或其活性中心未遭破坏,而经蛋白酶K处理使该多肽的活性中心遭到部分破坏,经木瓜蛋白酶、中性蛋白酶、胰蛋白酶酶解却使其活性中心遭受大面积破坏以致丧失活性。

表5 发酵上清浓缩液的抑菌谱Table 5 Antimicrobial spectrum of fermentation liquid
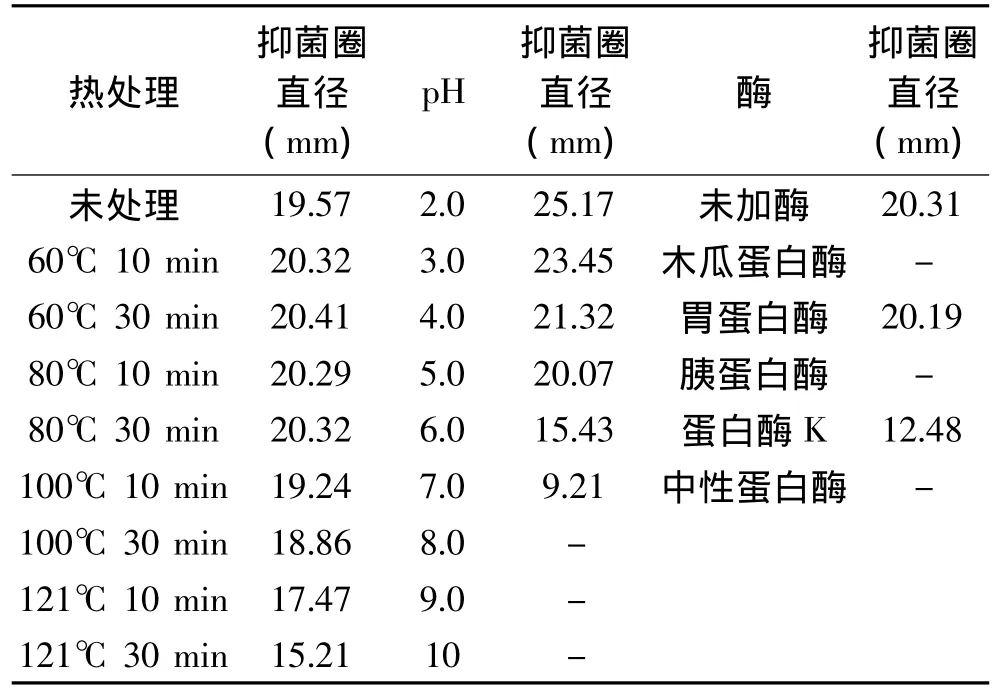
表4 发酵上清浓缩液对温度、pH和酶的敏感性Table 4 Factors affecting the antimicrobial activity of fermentation supernatant
2.6 发酵上清液对指示菌的作用方式
实验中直接将干酪乳杆菌的发酵上清浓缩液加入到培养至稳定期的大肠埃希氏菌菌液中,37℃下作用5h后,大肠杆菌活菌数迅速减少,由起始菌数3.84×108CFU/mL下降至8.34×106CFU/mL,而加入相同处理的MRS培养基的对照组菌液中活菌数未见减少,见图6。OD600在2h后与对照相比未发生明显变化,说明指示菌总菌数无显著变化,但活菌数却减少了约1.6个单位,由此可见,干酪乳杆菌发酵上清液的抗菌作用方式是杀菌。
2.7 所产抑菌物质的部分抑菌谱
从表5中可以看出,该菌株所产抗菌肽能够抑制或杀灭多种革兰氏阴性细菌和部分革兰氏阳性菌,具有较广的抗菌活性。发酵上清液对常见病原菌大肠杆菌、金黄色葡萄球菌、粪肠球菌、巴氏杆菌、铜绿假单胞菌都有较强的抑菌作用,对枸橼酸杆菌、沙门氏菌也有一定的抑菌活性,但对白色念珠菌、毕赤酵母无显著抑菌活性。因此,其在新型食品防腐剂和饲料添加剂领域有着较广阔的应用前景。
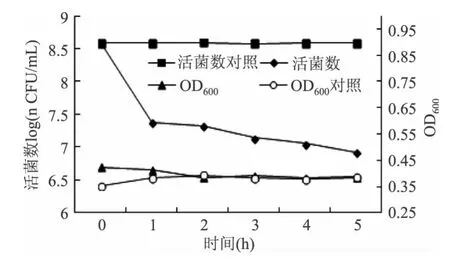
图6 发酵上清液对大肠埃希氏菌的作用Fig.6 The effect of fermentation liquid on the growth of Escherichia coli CMCC44102
3 结论
利用琼脂扩散法对嗜酸乳杆菌、发酵乳杆菌和干酪乳杆菌等三株乳杆菌的发酵上清液抑菌活性分析表明,在相同条件下,干酪乳杆菌的发酵上清液对大肠杆菌和金黄色葡萄球菌均有较强的抑菌活性,而嗜酸乳杆菌和发酵乳杆菌的抑菌活性较弱。其发酵上清经过有机酸和过氧化氢排除及酶解实验进而确定所产抑菌物质具有蛋白质属性。
通过单因素实验和正交分析最终确定了干酪乳杆菌代谢产生抗菌物质的最佳培养条件,即干酪乳杆菌在装液量20%、接种量2%、培养温度30℃下静置培养42h时的发酵液上清的抑菌圈直径最大,也即代谢产生的抗菌肽含量最高。
本实验中干酪乳杆菌所产的抗菌物质具有较好的热稳定性,可被胰蛋白酶、中性蛋白酶和木瓜蛋白酶完全酶解,被蛋白酶K部分酶解,而不被胃蛋白酶酶解,其活性受pH影响很大,酸性环境中活性较高。同时,对其作用方式的研究发现,其对大肠埃希氏菌的作用为杀菌;对其抑菌谱的研究发现,该抗菌物质对G+和G-菌株均有较强的抑制作用,能够抑制大肠埃希氏菌、金黄色葡萄球菌、铜绿假单胞菌、沙门氏菌、巴氏杆菌等食源性病原菌。这些为干酪乳杆菌及其抗菌物质在食品工业和养殖业上的进一步研究奠定了基础,并为开发天然防腐剂[17]和畜禽用新型饲料添加剂提供了广阔的市场前景。
[1]朱勇,徐建雄.抗菌肽饲料添加剂的研究进展[J].饲料工业,2006,27(3):14-16.
[2]谷巍.抗菌肽在畜牧养殖业中的应用[J].养殖与饲料,2010,9(10):66-68.
[3]Musikasang H,Sohsomboon N,A Tani,et al.Bacteriocinproducing lactic acid bacteria as a probiotic potential from Thai indigenous chickens[J].Czech J Anim Sci,2012,57(3):137-149.
[4]Messaoudi S,Manai M,Kergourlay G,et al.Lactobacillus salivarius:bacteriocin and probiotic activity[J].Food Microbiol,2013,36(2):296-304.
[5]刘文丽,张兰威,John shi,等.Ⅱa类乳酸菌细菌素构效关系的研究进展[J].食品工业科技,2013,34(21):369-373.
[6]赵爱珍,徐兴然.Ⅱa类乳酸菌细菌素的分类[J].食品科学,2013,34(17):356-359.
[7]Deegan L H,Cotter P D,Hill C,et al.Bacteriocins:biological tools for biopreservation and shelf-life extension[J].International Dairy Journal,2006,16(9):1058-1071.
[8]Perdigon G,Fuller R,Raya R.Lactic acid bacteria and their effect on the immune system[J].Curr Issues Intest Microbiol,2001,2(1):27-42.
[9]张旭,赵斌,张香美,等.产细菌素乳酸菌的筛选及细菌素相关基因的分析[J].中国农业大学学报,2013,18(4):168-177.
[10]徐义刚,崔丽春,唐丽杰,等.干酪乳杆菌 Lactobacillus casei 393在鼠消化道内定植能力及分布规律的研究[J].中国乳品工业,2007,35(4):20-22.
[11]曹珂珂,王娣,李妍.1株产广谱细菌素乳酸菌的筛选及其抑菌物质的特性[J].食品与发酵工业,2012,38(11):88-91.
[12]Hata T,Tanaka R,Ohmomo S.Isolation and characterization of plantaricin ASM1:A new bacteriocin produced by Lactobacillus plantarum A-1[J].International Journal of Food Microbiology,2010,137(1):94-99.
[13]王小娜,宋达峰,顾青.产细菌素乳酸菌的鉴定及其特性研究[J].中国食品学报,2011,11(3):181-185.
[14]王海霞,缪刘,祁克宗,等.鸡防御素2成熟肽基因在毕赤酵母中的表达及其抗菌活性分析[J].中国兽医科学,2012,42(7):719-724.
[15]李琳,贾士儒,谭之磊,等.嗜热链球菌 CGMCC1.1864所产的一种新型细菌素 ST9[J].微生物学通报,2010,37(3):349-354.
[16]周德庆 .微生物学教程[M].北京:高等教育出版社,2002.
[17]Mills S,Stanton C,Hill C,et al.New developments and applications of bacteriocins and peptides in foods[J].Annual Review of Food Science and Technology,2011,2:299-329.

