鲢鱼和草鱼下脚料中CPIs抑制活性比较及其分子量分布的鉴定
李树红,陈 海,蒋然然,李美良,李艳芳,吴 睿,姜海洋,肖安蓬,何 杰
(四川农业大学食品学院,四川雅安625014)
草鱼(Ctenopharyngodonidellus)和鲢鱼(Hypophthalmichthys molitrix)是我国最主要的淡水经济鱼类,产量分别位居第一和第二位[1]。同时,在鲢鱼及草鱼的加工过程中,会产生大量内脏、鱼皮等废弃物或下脚料。而有研究表明,鱼类卵[2]、皮[3]和血浆[4]、肝胰、心脏、肾、鳃、肠[5]等中均存在半胱氨酸蛋白酶抑制因子(cysteine proteinase inhibitors,CPIs)抑制活性。
对陆生动物源CPIs的研究表明,其不仅参与机体蛋白周转代谢,而且在生物防御[6]、抑菌[7]、细胞凋亡[8]、免疫调节[9]、疾病和癌症抑制[10]、胚胎发育保护[11]、骨生长调节[12]等中均发挥着重要作用,因此日益受到关注。此外,在食品领域的相关研究表明,CPIs还可通过抑制残留在鱼糜中的内源半胱氨酸组织蛋白酶活性,而防止鱼糜凝胶的软化[13]。目前对陆生哺乳动物CPIs研究相对较透彻,其中主要的类群Cystatins超家族包括了低分子量的家族I Stefin(约11ku)和家族II Cystatin(约13ku),以及高分子量的家族III Kininogen(约50~120ku)中的多个成员[14]。但是对于进化地位和生存环境不同的鱼类,其CPIs在分类、结构、活性特征、生理功能等方面的研究尚存在较多空白。
作者所在团队报道了鲢鱼卵高分子CPIs的部分特性[15],而关于鲢鱼其他下脚料及草鱼各组织中CPIs的活性分布和性质等研究,目前尚未见报道。为此,本研究首先确定了鲢鱼和草鱼卵、皮中CPIs粗提、层析过程中适宜的测活方法,进而比较了各下脚料粗提液中CPIs活性量的种间差异。在此基础上,利用分子筛层析结合反相酶谱法,初步鉴定了两种鱼卵、皮各部位中CPIs分子量分布情况。本研究结果不仅可为后续的分离纯化及分析工作奠定实验基础,而且为依据抑制活性量的差异,充分利用鲢鱼、草鱼各类下脚料资源,提供理论依据,具有一定的现实意义。
1 材料与方法
1.1 材料与试剂
怀卵期(Ⅳ期)鲢鱼和草鱼的卵、皮均采集于四川崇州通威养殖中心。样品于冰上运回实验室后,液氮速冻,于-80℃冻藏,使用前4℃解冻。
荧光合成肽(Z-Phe-Arg-MCA)、偶氮酪蛋白(Azocasein)、木瓜蛋白酶(Papain)、荧光标品AMC、苯甲基磺酰氟(PMSF)、明胶、牛血清白蛋白(BSA)、层析用蛋白分子量标品 美国sigma;中分子量蛋白标品(14.3~97.4ku) 美国 promega;中分子量蛋白标品(14.4~94ku) 北京天根;蛋白浓度试剂盒 南京建成生物有限公司;Sephacryl S-200 美国GE公司。
1.2 仪器与设备
BR4i大容量高速冷冻离心机 美国Thermo公司;8050和8003磁搅拌超滤装置 美国Millipore公司;Varioskan Flash全波长多功能酶标仪 美国Thermo公司;V-1200可见分光光度计 上海美谱达仪器有限公司;Biologic DouFlow全自动中高压层析系统、Mini Protein电泳槽及PowerPac 3000电泳电源 美国Bio-Rad公司。
1.3 实验方法
1.3.1 鲢鱼和草鱼卵中CPIs的粗提取 鲢鱼卵和草鱼卵中CPIs的粗分离提取参照宋川[15]方法。
1.3.2 鲢鱼和草鱼皮中CPIs的粗提取 鲢鱼/草鱼皮(约30g)经去鳞洗净后用四倍体积的提取缓冲液(含0.1mmol/L PMSF、5mmol/L 苯甲脒、15mmol/L 叠氮化钠、0.25mol/L蔗糖、10mmol/L乙二胺四乙酸的10mmol/L Tris-HCl pH7.4)匀浆[3]。经离心(10000×g,20min),取上清用四层纱布过滤,滤液经80%硫酸铵盐析、透析(20mmol/L Tris-HCl缓冲液,pH8.0)后离心(10000×g,5min),取上清液。样液经Amicon YM-3超滤膜(截留分子质量为3ku)超滤浓缩得皮CPIs浓缩粗提液。样品液氮速冻后,于-80℃保存。使用前4℃解冻。
以上步骤均在4℃操作,以分别以Z-Phe-Arg-MCA和Azocasein为底物,测定每一步骤后的粗酶液的总活力和比活。总活(units)=反应体系产生的抑制活性单位数×(CPIs提取液总体积/反应体系中加入的 CPIs提取液体积);比活(units/mg)=总活/CPIs提取液的总蛋白
1.3.3 蛋白质量浓度测定 采用Bradford方法,按照蛋白浓度试剂盒说明的各步骤测定提取液的蛋白浓度。
1.3.4 Azocasein法测定CPIs抑制活性 Azocasein法,即测定CPIs对Papain水解Azocasein反应的抑制能力。Papain水解Azocasein的反应体系基本参考Rowan等的方法[16],但由于每个实验所选用的Papain来源各不相同(即酶的纯度、unit不同),为了准确测定CPIs的抑制活性,必须准确测定Papain酶活,因此实验首先需要确定该酶反应初速度线性范围对应的酶加量。当反应体系中含2.5mg Azocasein时,37℃ 下测定不同质量(3.125、6.25、7.8125、12.5、18.75、21.875、25μg)Papain 在 30min 内的酶反应曲线,取其线性部分作为适宜的酶用量和反应时间。此后,调节CPIs的加入量,使测得的对木瓜蛋白酶的抑制率在30%~70%之间[17]。CPIs的抑制活性单位定义为:反应条件(37℃、pH7.0)下,440nm处吸光值降低0.01即为一个单位。
抑制比率(%)=(对照管酶活-实验管酶活)/对照管酶活×100
1.3.5 荧光合成肽法测定CPIs抑制活性 荧光合成肽法,即测定CPIs对Papain水解荧光合成肽Z-Phe-Arg-MCA反应的抑制能力,基本参考Barrett等[18]和 Anastasi等[19]的方法。该方法中首先要求对Papain(本实验配制的原始浓度为1.25mg/mL)的有效摩尔浓度进行定量,其具体方法基本参考Barrett等[18]的E-64活性位点滴定法,即测定不同E-64浓度(0、0.5、1、1.5、2、2.5、3、3.5、4、4.5、5、5.5、6、6.5、7、8、9、10、15μmol/L)下,Papain(1.25mg/mL)的残余活性。由已知的E-64摩尔浓度计算Papain(1.25mg/mL)的有效摩尔浓度。此外,根据文献在适宜的Z-Phe-Arg-MCA水解反应体系中,为保证酶反应处于线性范围,8nmol/L Papain的适宜加量范围为20~50μL。因此,实验设计了12.5、25、37.5、50μL 的 Papain 加量,在此范围内进行测定以判断酶反应初速度的线性情况。最后在测定CPIs的抑制活性时,调节CPIs的加入量,使测定的抑制率在30%~70%之间[17]。上述反应所用温度为40℃,检测波长为激发波长360nm,发射波长440nm。酶活单位定义为:在反应条件(40℃、pH6.8)下,能够在1min内水解底物并释放出1nmol AMC产物的酶活性量(1nmol AMC/min)。抑制活性单位定义为:抑制1个单位的酶活性。
1.3.6 Sephacryl S-200分子筛层析 取上述两种鱼的卵及皮的浓缩粗提液,经微滤后4℃下分别上Sephacryl S-200分子筛(1.0cm×90cm)。用含0.2mol/L NaCl的20mmol/L磷酸盐缓冲液(pH6.0)洗脱,流速0.07mL/min,每管收集1.0mL,检测波长为280nm。分别以Azocasein法和荧光合成底物肽法测定每个收集管中的CPIs抑制活性,对监测效果进行比对。收集活性部分,浓缩后用于鉴定分析。
1.3.7 分子筛层析法测定鲢鱼和草鱼卵、肝、皮CPIs的分子质量 以分子筛层析标品蓝色葡聚糖-2000测定Sephacryl S-200分子筛层析柱(1.0cm×90cm)的空体积 V0,分别以分子质量为 150、66、36、24、13、3.5ku的标准蛋白作为层析标品,相同条件下进行层析,求得各自的洗脱体积Ve。以Ve与V0的比值作为纵坐标(y),标准蛋白分子质量对数为横坐标(x)作图,求得Sephacryl S-200分子筛层析标准曲线。
1.3.8 明胶底物-SDS-PAGE-反相酶谱法分析 反相酶谱中SDS-PAGE参考Laemmli体系[20]。采用含0.2%明胶的14%分离胶,样品上样缓冲液中不含β-巯基乙醇,上样前样品不煮沸。电泳结束后,蛋白酶抑制的复性活性带的形成在 García-Carreňo 等[21]的方法基础上略有改动。用含2.5%Triton-100、1mmol/L DTT的50mmol/L磷酸盐缓冲液,pH7.0漂洗复性凝胶3次,15min/次;再用双蒸水漂洗凝胶3次,15min/次。复性后的凝胶于含0.4mg/mL木瓜蛋白酶的50mmol/L的磷酸盐缓冲液(pH7.0)中4℃浸泡1h。最后用50mmol/L的磷酸盐缓冲液(pH7.0)37℃反应9~12h。考马斯亮蓝R-250染色,脱色液(95%乙醇∶冰醋酸∶蒸馏水 =4.5∶0.5∶5)脱色。
2 结果与分析
2.1 Papain水解Azocasein酶反应的初速度线性范围确定
由图1可知,当酶反应的底物量一定(即2.5mg)时,Papain用量≤7.8125μg,30min内反应呈线性;Papain用量12.5μg时,20min以内反应保持线性;Papain用量18.75μg时,10min以内反应保持良好线性。综合考虑反应时间及吸光值高低等因素(对于后续的抑制反应而言,酶反应的初始吸光值过低,不方便测定抑制活性),最终选 Azocasein底物量2.5mg时,Papain用量18.75μg,37℃反应10min的适宜条件。

图1 Papain水解Azocasein的酶反应曲线Fig.1 The curve of enzyme reaction about papain hydrolyzing azocasein
2.2 E-64滴定法测定Papain有效摩尔浓度
由图2、图3可见,由于E-64摩尔浓度已知,取E-64滴定曲线的线性部分,通过趋势线(R2=0.999),可以准确测出Papain(1.25mg/mL)的有效活性浓度为6.05μmol/L。

图2 E-64滴定曲线Fig.2 Titration curve of papain with E-64
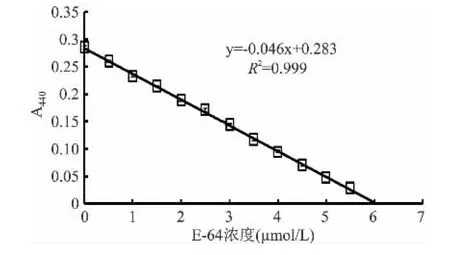
图3 E-64滴定曲线线性部分Fig.3 Extrapolation of linearity of E-64 titration curve
2.3 荧光合成肽水解反应体系中8nmol/L Papain的适宜加量
由图4可知,在8nmol/L Papain的加量为12.5~50μL范围内,Z-Phe-Arg-MCA水解反应的初速度一直呈线性。因此,为方便后续测定CPIs的抑制活性,确定荧光合成肽水解反应体系中,8nmol/L Papain的用量以50μL为宜,即反应体系中Papain加量为0.0835μg(图4)。

图4 8nmol/L Papain水解荧光肽底物的反应初速度Fig.4 Initial velocity of hydrolysis reaction of Z-Phe-Arg-MCA by 8nmol/L Papain
2.4 鲢鱼和草鱼卵及皮中CPIs粗分离提取及活性比较
粗提过程中,采用荧光合成肽法测定鲢鱼和草鱼卵及皮粗分离各步骤中CPIs抑制活性(数据省略)时,发现该法不能准确监测CPIs抑制比活性的变化,其原因可能是在成分相对复杂的卵、皮粗提液中,存在同样能够水解荧光合成肽底物的干扰酶类,如组织蛋白酶L、B[18]等。但是用Azocasein法监测各步骤的比活是逐渐上升(表1、表2),且鲢鱼组织蛋白酶B和组织蛋白酶L(本实验室制备)均不水解Azocasein底物(数据尚未发表)。因此在粗分离过程中,Azocasein法更适合用于监测各步骤粗提液CPIs的活性和比活。

表1 Azocasein法测定鲢鱼卵及皮粗提各步骤CPIs活性Table 1 Inhibitory activities of CPIs of the crude extracts from Silver carp eggs and skins by azocasein method

表2 Azocasein法测定草鱼卵及皮粗提各步骤CPIs活性Table 2 Inhibitory activities of CPIs of the crude extracts from Grass carp eggs and skins by azocasein method
此外,采用Azocasein法进行抑制活性比较,发现无论鲢鱼还是草鱼,其同质量的卵(30g)和皮(30g)的粗提液中CPIs总活性,均是卵明显高于皮;但是对于CPIs抑制比活,则是鲢鱼皮(14.14units/mg)高于鲢鱼卵(3.98units/mg),草鱼卵(332units/mg)高于草鱼皮(87units/mg);另一方面,将相同组织的提取液中CPIs抑制活性进行比较,发现同质量的卵(30g)和皮(30g)中,草鱼卵和皮中的总活、比活(卵:349600units、332units/mg,皮:25600units、87units/mg),均分别显著高于鲢鱼卵和皮中的总活、比活(卵:10620units、3.98units/mg,皮:3726units、14.14units/mg)。同质量的草鱼卵及皮中CPIs的抑制活性量和比活均极显著高于同期的鲢鱼,可能与鱼种间差异有关,一方面可能CPIs的表达量在草鱼卵及皮组织中高于鲢鱼,另一方面可能草鱼CPIs的抑制能力强于鲢鱼,这尚待通过测定两种鱼纯化后的CPIs的Ki值以及测定CPIs在mRNA及蛋白质水平上的表达量加以分析判断。
2.5 鲢鱼和草鱼卵及皮粗提CPIs的Sephacryl S-200分子筛层析
Sephacryl S-200层析过程中,分别采用荧光合成肽底物法和Azocasein法对各个收集管进行抑制活性测定。结果发现,在azocasein反应体系允许的最大抑制剂加量下(100μL),仍无法检测到有效的抑制活性,而在灵敏度高的荧光合成肽底物法反应体系中,只需根据层析样品的浓度加入20~50μL收集液,即可检测到有效的抑制活性。
在粗提取过程中,虽然荧光合成肽底物法不能有效监测到CPIs的抑制活性,但是已有报道酸处理可以将可逆结合的内源半光氨酸组织蛋白酶与其抑制因子CPIs分开[22]。因此,在后续的 Sephacryl S-200分子筛层析过程中,可能由于分子量不同,干扰酶与CPIs彻底分离,所以荧光合成肽底物法能够监测到层析收集液中CPIs的抑制活性。而且该法灵敏度高,体系中所需 Papain的量(0.0835μg)仅为Azocasein法(18.75μg)的1/225,所以当收集液中目的蛋白被层析缓冲液高倍稀释后,该法便体现出优势。
根据计算得到Sephacryl S-200分子筛层析的标品的标准曲线,为y=-0.6685x+4.5345,R2=0.9686。根据在Sephacryl S-200分子筛层析上活性峰尖处(如图5中各虚横线所示)的Ve与V0的比值,经标准曲线公式初步推测,鲢鱼卵中CPIs分子量约分布在119ku(35100s)、53.8ku(42300s)、14.3ku(54000s)和7.7ku(63000s)处,鲢鱼皮中CPIs分子量约分布在68~112ku(36000~39600s)、19ku(51300s)和 7ku(63900s)附近。草鱼卵在 50~128ku(34200~45000s)、11.6ku(55800s)和 7.7ku(63000s)附近有活性CPIs分布;草鱼皮约在119ku(35100s)、53.8ku(42300s)和8.6ku(58500s)处有活性CPIs分布。而且两种鱼在小于20ku的低分子处,其CPIs抑制比活均明显高于50~120ku的高分子处。
2.6 CPIs的Sephacryl S-200收集物的反相酶谱鉴定
收集鲢鱼、草鱼卵及皮的Sephacryl S-200分子筛层析中高、低分子量CPIs的活性峰尖,分别进行明胶底物-SDS-PAGE-反相酶谱的鉴定。如图6所示,以鲢鱼皮和草鱼卵中高分子部分CPIs的反相酶谱图为例(鲢鱼卵和草鱼皮高分子CPIs亦可得到清晰鉴定,电泳图省略),对照蛋白BSA条带以及样品泳道中的非抑制剂条带,在反相酶谱中几乎水解殆尽,而CPIs抑制条带在反相酶谱中则清晰可见。
本实验发现,通过反相酶谱鉴定到的CPIs抑制条带均为高分子形式。对Sephacryl S-200层析图上高分子部分抑制活性峰较宽的鲢鱼皮(36000~39600s,68~112ku)和草鱼卵(34200~45000s,50~128ku),结合反相酶谱鉴定,可基本得到确定的抑制条带位置(如箭头所示)。此外,鲢鱼皮中还检测出约30ku的CPIs。但是,对于分子量小于20ku的低分子CPIs,两种鱼的各个组织中都未得到鉴定(图省略)。
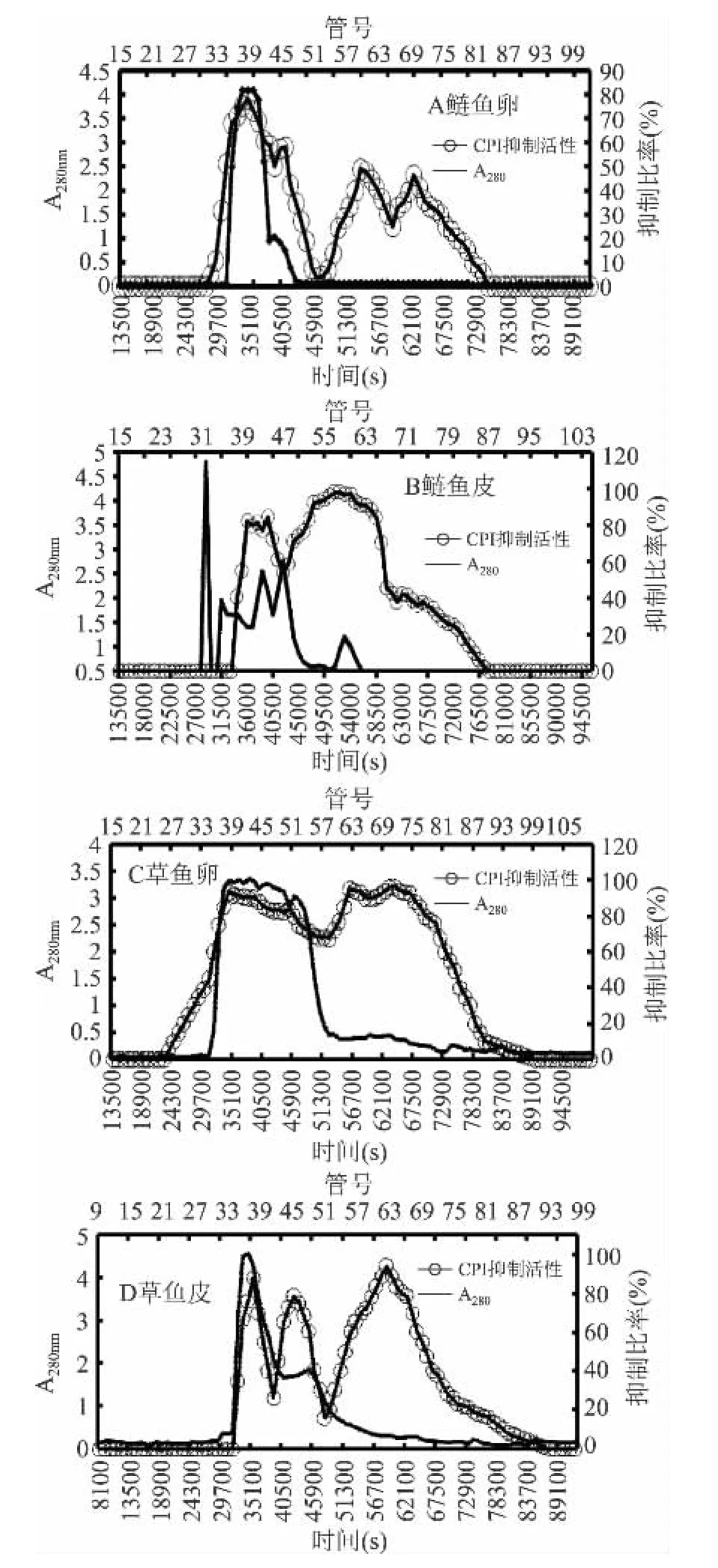
图5 鲢鱼和草鱼卵及皮中CPIs的Sephacryl S-200分子筛层析Fig.5 Sephacryl S-200 chromatography of CPIs from eggs and skins of Silver carp and Grass carp
目前仅Okamoto报道通过反相酶谱法能够鉴定日本鳗鱼(Anguilla japonica)的16ku的类凝集素类的Eel-CPI-2[23]。而本研究中,尽管层析活性监测表明鲢、草各下脚料组织中低分子CPIs部分的抑制比活性显著高于高分子部分,特别是草鱼卵和皮中的总活和比活都分别显著高于鲢鱼卵和皮,但是在反相酶谱中两种鱼的低分子CPIs部分均未能得到鉴定。一方面可能是鲢、草中低分子CPIs在初步纯化物中含量过低,不易检出;另一方面对鲤鱼小分子Cystatin(家族II成员)的同源模型研究表明其表面均匀分布正电荷[24],而鲢鱼和鲤鱼同属鲤科,所以可能正如我们之前的分析[25],电泳中带负电荷的非离子型去垢剂SDS会导致其构象改变,进而丧失抑制活性。因此,对粗分离纯化的鲢、草中低分子CPIs进行初步鉴定时,反相酶谱法虽然可以基本确定高分子CPIs的分子量分布情况,但是仍存在局限性,需与分子筛层析结合,并采用有效的活性监测方法——荧光合成肽底物法,才能够鉴定到小分子CPIs的存在和分布。

图6 鲢鱼皮及草鱼卵中CPIs的反相酶谱分析Fig.6 Reversed-phase enzyme spectrometry of CPIs in silver carp skin and grass carp egg
已有学者从某些鱼类卵、皮、血浆组织中分离纯化了 9ku 到 18ku 的各种低分子量[2,23,26-27]及 45.8ku到 72.6ku 的各种高分子量[3,4,28]形式的 CPIs,而且不同鱼种中纯化的 CPIs 的 Ki差异明显[4,26-27,29]。目前除作者所在实验室从鲢鱼卵中分离了89ku的高分子CPI[15]和 10ku 的低分子 CPI[30],尚未见对鲢鱼皮和草鱼下脚料中CPIs分子量分布和分离纯化的报道。本实验中经分子筛层析初步鉴定出鲢、草各下脚料组织中均存在多种高(50~120ku)、低分子量(<20ku及<10ku)形式的CPIs,但它们分别属于哪类家族、各自的生物学活性特征等,还有待进行深入纯化、鉴定研究。
3 结论
本文利用适宜体系的Azocasein反应法分析测定了鲢、草鱼下脚料(卵、皮)粗提液中CPIs的抑制活性差异。进而通过Sephacryl S-200分子筛层析分析,并根据荧光合成肽法监测到的CPIs活性峰位置,同时结合明胶底物-SDS-PAGE反相酶谱法,初步判断两种鱼卵和皮组织中CPIs的分子量分布情况,即均存在高(50~128ku)及低(7~19ku)分子量的形式。
[1]农业部渔业局.2013年中国渔业统计年鉴[M].北京:中国农业出版社,2013:1-145.
[2]Tzeng S S,Wu H C,Sung W C,et al.Purification and characterization of cysteine proteinase inhibitors from crucian carp Carassius auratus eggs[J].Fishers Science,2009,75(6):1453-1460.
[3]Ylonen A,Helin J,Bogwald J,et al.Purification and characterization of novel kininogens from spotted wolffish and Atlantic cod[J].European Journal of Biochemistry,2002,269(11):2639-2646.
[4]Li D K,Lin H,Kim S M.Purification and characterization of a cysteine protease inhibitor from chum salmon(Oncorhynchus keta)plasma[J].Journal of Agricultural and Food Chemistry,2008,56(1):106-111.
[5]Yamashita M,Konagaya S.A comparison of cystatin activity in the various tissues of chum salmon Oncorhynchus keta between feeding and spawning migrations[J].Comparative Biochemistry and Physiology Part A:Physiology,1991,100(3):749-751.
[6]Fast M D,Sims D E,Burka J F,et al.Skin morphology and humoral non-specific defense parameters of mucus and plasma in rainbow trout,coho and Atlantic salmon [J].Comparative Biochemistry and Physiology-Part A:Molecular and Integrative Physiology,2002,132(3):645-657.
[7]Nordahl E A,Rydengard V,Morgelin M,et al.Domain 5 of high molecular weight kininogen is antibacterial[J].The Journal of Biological Chemistry,2005,280(41):34832-34839.
[8]LiangX,Nagai A,Terashima M,et al.Cystatin C induces apoptosis and tyrosine hydroxylase gene expression through JNK-dependent pathway in neuronal cells[J].Neuroscience Letters,2011,496(2):100-105.
[9]Staun-Ram E,Millea A.Cathepsins(S and B)and their inhibitor Cystatin C in immune cells:modulation by interferon-β and role played in cell migration[J] .Journal of Neuroimmunology,2011,232(1-2):200-206.
[10]Jin L,Zhang Y,Li H,et al.Differential secretome analysis reveals CST6 as a suppressor of breast cancer bone metastasis[J].Cell Research,2012,22(9):1356-1373.
[11]Wang S C,Huang F L.Carp ovarian cystatin binds and agglutinates spermatozoa via electrostatic interaction[J].Biology of Reproduction,2002,66(5):1318-1327.
[12]Yamamura J,Morita Y,Takada Y,et al.The fragments of bovine high molecularweightkininogen promote osteoblast proliferation in vitro[J].Journal of Biochemistry,2006,140(6):825-830.
[13]Tzeng S S,Jiang S T.Glycosylation modification improved the characteristics of recombinant chicken cystatin and its application on mackerel surimi[J].Journal of Agricultural and Food Chemistry,2004,52(11):3612-3616.
[14]Barrett A J.The cystatins:a diverse superfamily of cysteine peptidase inhibitors[J].Biomedica Biochimica Acta,1986,45(11-12):1363-74.
[15]宋川,李艳芳,任阳阳,等.鲢鱼卵高分子质量CPI-I的纯化与鉴定[J].食品科学,2012,33(13):100-103.
[16]Rowan A D,Buttle D J.Pineapple cysteine endopeptidases[J].Methods in Enzymology,1994,244:555-568.
[17]Wu J,Haard N F.Purification and characterization of a cystatin from the leaves of methyl jasmonate treated tomato plants[J].Comparative Biochemistry and Physiology Part C,2000,127(2):209-220.
[18]Barrett A J ,Kirschke H,Cathepsin B,et al.Methods in Enzymology[J].1981,80(41):535-561.
[19]Anastasi A,Brown M A,Kembhavi A A,et al.Cystatin,a protein inhibitor of cysteine proteinases.Improved purification from egg white,characterization,and detection in chicken serum[J].Biochemical Jourmal,1983,211(1):129-138.
[20]Laemmlii U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[21]Garcia-Carreno F L,Dimes L E,Haard N F.Substrate-gel electrophoresis for composition and molecular weight of proteinases or proteinaceous proteinase inhibitors[J].Analytical Biochemistry,1993,214(1):65-69.
[22]An H,Margo Y,Thomas S A,et al.Isolation and activation of cathepsin L-inhibitor comples from Pacific whiting(Merluccius productus)[J].Journal of Agricultural Food Chemistry,1995,43:327-330.
[23]Okamoto E,KasaharahH,Chibba,et al.Purification and characterization of two novel cysteine protease inhibitors,Eel-CPI-2 and Eel-CPI-3,in the skin mucus of the Japanese eel Anguilla japonica[J].Fisheries Science,2009,75(2):463-471.
[24]Suyc,Li J C,Lin H L.Homology model and molecular dynamics simulation of Carp Ovum cystatin[J].Biotechnology progress,2005,21(4):1315-1320.
[25]李树红,任阳阳,李艳芳,等.鲢鱼CPIs的三种电泳鉴定方法的比较研究[J].食品工业科技,2013,34(21):56-59.
[26]Ustadi,Kim K Y,Kim S M.Purification and identification of a protease inhibitor from glassfish(Liparis tanakai)eggs[J].Journal of Agricultural and Food Chemistry,2005,53(20):7667-7672.
[27]李德昆.蛋白酶抑制剂的制备及其抑制鳕鱼糜凝胶软化的研究[D].青岛:中国海洋大学,2008.
[28]Kim K Y,Ustadi and Kim S M.Characteristics of the protease inhibitor purified from chum salmon(Oncorhynchus Keta)eggs[J].Food Science and Biotechnology,2006,15(1):28-32.
[29]Tsai Y J,Chang G D,Huang C J,et al.Purification and molecular cloning of carp ovarian cystatin[J].Comparative Biochemistry Physiology.PartB,Biochemistry & Molecular Biology,1996,113(3):573-580.
[30]宋川.鲢鱼卵CPIs的纯化鉴定及其抑制鱼糜凝胶软化的研究[D].雅安:四川农业大学,2011.

