膜联蛋白7在转移性激素敏感前列腺癌原发灶组织中的表达及其意义
林国文 ,叶定伟,戴 波,张海梁,沈益君,朱 耀,朱一平,施国海,马春光,肖文军,秦晓健,曹达龙
(复旦大学:1.附属肿瘤医院泌尿外科;2.上海医学院肿瘤学系,上海 200032)
去势抵抗性前列腺癌(castration resistant prostate cancer,CRPC)治疗手段有限,预后差。多数确诊晚期的前列腺癌患者经过1.5~2年内分泌治疗后,不可避免进展为CRPC 阶段,其发生机制至今未明。近年有报道膜联蛋白7(Annexin A7,ANXA7)与前列腺癌进展关系密切[1-2],但对激素敏感前列腺癌(hormone sensitive prostate cancer,HSPC)进展为CRPC过程中ANXA7的作用尚不明确。本文利用免疫组化技术检测ANXA7蛋白在转移性HSPC患者的原发灶组织中表达情况,并探讨其表达差异的对预后意义。
1 资料与方法
1.1 临床资料 收集2003年6月至2013年6月本院资料完整的转移性HSPC 患者106例,均经病理证实且确诊时已发生骨转移。患者年龄56~89岁,平均年龄70岁;确诊时血清PSA 3~5 577ng/mL,中位值为170ng/mL;采用TNM 分期,T1~T2期22例,T3期59例,T4期25例;N0期65例,N1期41例;Gleason评分<8分36例,≥8分70例。另取前列腺增生组织20 例、CRPC 原发灶组织22 例作比较。CRPC判断标准(文献[3]):①血清睾酮达去势水平(<50ng/dL);②间隔2周连续3次PSA 升高;③二线内分泌治疗期间PSA 进展;④可出现骨或软组织病变进展。所有患者临床资料由原始病史获得,内分泌治疗采用最大限度雄激素阻断方法。生存期随访时间截止为2014年3月。
1.2 方法
1.2.1 免疫组织化学染色方法 上述病例的原发灶组织石蜡切片脱蜡水化,采取煮沸修复(置入pH 值为8.0的EDTA 抗原修复液,煮沸30min);PBS冲洗后滴加50μL 一抗(ANXA7,兔抗人,1∶60,ProteinTech公司),4℃过夜;PBS冲洗后滴加通用二抗,室温下孵育60min;PBS冲洗后滴加100μL DBA 显色液;蒸馏水冲洗,0.1%盐酸分化,梯度乙醇脱水干燥,二甲苯透明,香柏油封固。显微镜下观察,阳性显色为棕黄色颗粒,阴性对照采用PBS缓冲液代替一抗。
1.2.2 结果分析 ANXA7 表达定位于胞核和胞质,阳性细胞为棕黄或棕褐色[4]。按阳性细胞占全部细胞的百分率计算。400倍高倍镜下观察至少5 个视野,取其平均值。根据染色强度分为3个等级:阴性表达(-):<10%细胞出现着色;弱阳性表达(+):>10%细胞出现轻中度着色;强阳性表达(++):>10%细胞出现重度着色。切片由我院2位病理科医生独立阅片。
1.2.3 预后指标 疾病无进展生存期(progressionfree survival,PFS)定义为从一线激素治疗开始到进入CRPC阶段的时间长度;总生存期(overall survival,OS)定义为从一线激素治疗开始到因任何原因患者死亡的时间长度。
1.3 统计学方法 应用SPSS13.0统计软件分析,ANXA7在前列腺增生以及转移性前列腺癌间表达差异,以及ANXA7表达与临床病理指标的相关分析通过χ2检验完成,生存分析采用单因素和多因素Cox回归模型,P<0.05提示差异有统计学意义。
2 结果
2.1 转移性HSPC 和前列腺增生组织中ANXA7蛋白的表达 ANXA7蛋白均在两类组织中表达,显微镜下可见细胞质和细胞核内DAB 染色的棕黄色颗粒。其中,转移性HSPC 组织阳性表达率50/106(47.2%);前列腺增生组织全部阳性表达。前者的ANXA7蛋白阳性率明显低于后者,两组比较差异有统计学意义(P<0.01,图1A、1B、1C)。
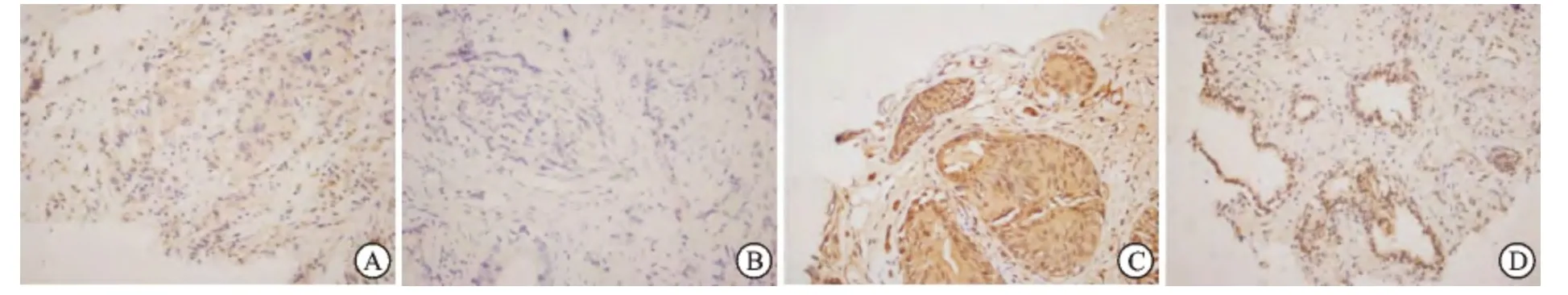
图1 转移性HSPC和前列腺增生组织中ANXA7蛋白的表达(免疫组化,×400)
2.2 转移性HSPC与CRPC组织中ANXA7蛋白的表达 转移性HSPC 组织阳性表达率50/106(47.2%),CRPC 组织阳性表达率为3/22(13.6%)。其中,转移性HSPC 和CRPC 组织中弱阳性率分别为44/106(41.5%)和3/22(13.6%),而强阳性率则为6/106(5.7%)和0,统计分析提示CRPC组相比前者ANXA7蛋白阳性表达率明显降低,两组比较差异有显著统计学意义(P=0.014,图1A、1B、1D)。
2.3 ANXA7蛋白表达与转移性HSPC 患者临床病理特征的关系 将106例转移性HSPC 患者病例进行相关分析比较(表1)。ANXA7蛋白表达率与患者T 分期、N 分期和Gleason分期关系密切,差异均有显著统计学意义。

表1 ANXA7蛋白表达与转移性HSPC患者临床病理指标的关系
2.4 ANXA7蛋白表达与HSPC 的转移性前列腺癌患者PFS与OS 的相关分析 至随访结束,80.2%(85/106例)患者出现疾病进展,PFS中位值为21.3月;62.3%(66/106例)患者最终死亡,OS 中位值为39.1月。将106 例HSPC 患者临床病理特征及其ANXA7蛋白表达情况纳入Cox回归模型(表2、表3),单因素分析PFS相关因素包括ANXA7 蛋白表达、活检Gleason评分,OS相关因素包括ANXA7蛋白表达、PSA 最低值、多西他赛化疗疗程;多因素分析提示仅ANXA7蛋白表达与PFS 正相关(阳性表达者PFS 中位值为24.4月、阴性表达者为15.5月),ANXA7蛋白表达、PSA 最低值<0.4ng/mL与OS正相关(阳性表达者OS中位值为56.4月、阴性表达者为36.1月),差异均有显著统计学意义(图2)。
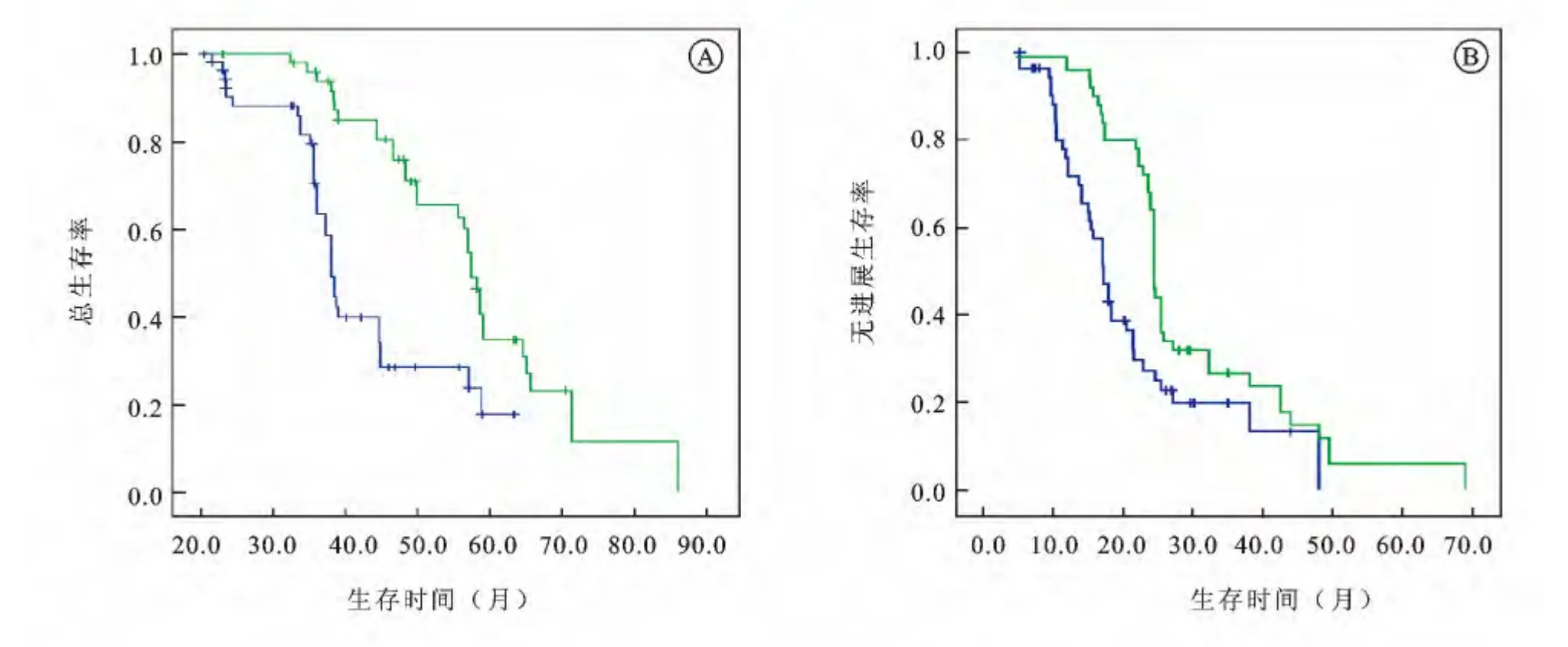
图2 ANXA7蛋白差异表达的转移性HSPC患者生存曲线
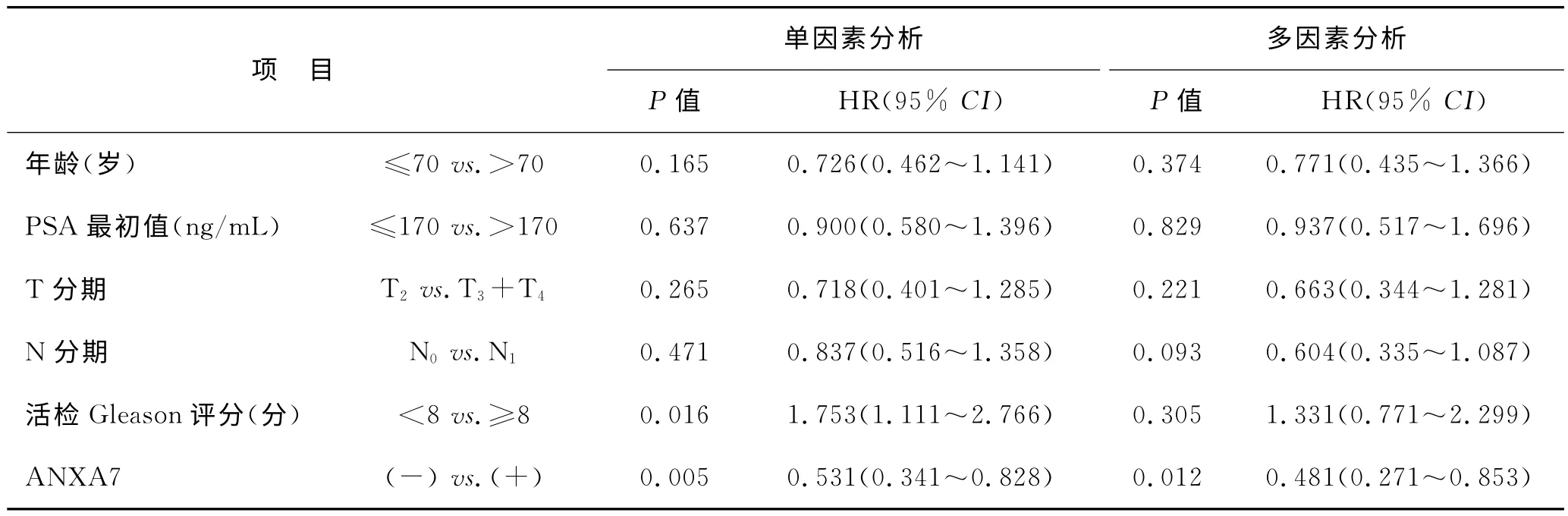
表2 106例转移性HSPC患者ANXA7蛋白表达与其PFS的相关性分析
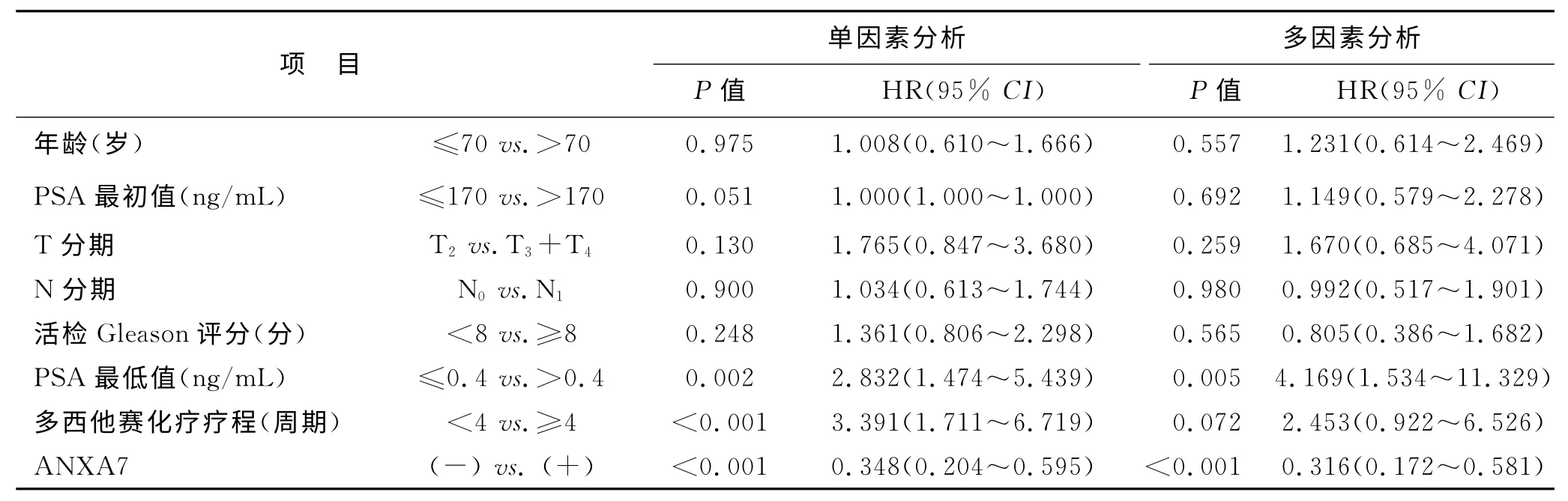
表3 106例转移性HSPC患者ANXA7蛋白表达与其OS的相关性分析
3 讨论
前列腺癌由HSPC转变成CRPC 阶段是多种机制共同作用的疾病进展过程。涉及信号通路传导改变,癌基因与抑癌基因调节失衡,细胞因子表达异常以及雄激素受体(androgen receptor,AR)变异等诸多因素。其中,癌基因的激活和抑癌基因的失活或缺失被普遍认为是肿瘤发生发展的重要机制,许多研究也报道癌基因/抑癌基因的调节改变与前列腺癌关系密切[5]。NOMURA等[6]发现癌基因Vav3 能 够提高AR 的活性,加速CRPC 的发展,沉默Vav3可以抑制AR 的磷酸化,进而加强多西他赛促进肿瘤细胞凋亡的作用。KOH等[7]综述了前人研究认为,癌基因MYC在前列腺癌发生过程中扮演至关重要的角色,特别是在早期阶段,MYC 通过异常激活核糖体合成和细胞分化过程中的信号通路加速了前列腺癌的发生发展。PTEN 是常见的抑癌基因,SIRCAR等[8]研究发现CRPC患者病理组织中PTEN 表达缺失高达77%,而且PTEN 表达缺失与Akt基因表达异常以及患者不良预后有关。
近年,抑癌基因ANXA7的表达缺失与恶性肿瘤发生发展的关系被逐步揭示[9]。HSU等[10]比较不同分化类型的胃癌组织ANXA7表达情况,结果提示ANXA7表达减少或者缺失大多出现在分化较差的胃癌组织中。JIN等[11]研究发现ANXA7基因可抑制肝细胞癌淋巴结转移,敲除ANXA7基因则淋巴结转移明显增加。YADAV等[12]探索在恶性胶质瘤中ANXA7表达缺失的可能机制,发现ANXA7表达缺失与表皮生长因子受体(epidermal growth factor receptor,EGFR)过表达有关,敲除ANXA7基因可使肿瘤细胞中EGFR 表达量升高,EGFR 信号通路异常激活。该研究还提示ANXA7低表达与患者病死率高、生存期 较短有 关。SONG等[13]研究发 现ANXA7与galectin-3蛋白相互作用,影响肝细胞肝癌的生物活性。DONG等[14]观察到前列腺癌中同样存在ANXA7的缺失表达。特别是在局部复发的晚期前列腺癌中,ANXA7蛋白表达相比早期前列腺癌组织显著缺失。TOROSYAN等[15]则进一步研究得出前列腺癌中ANXA7结构改变和功能缺失可能与异常的核糖核蛋白表达有关。
为深入分析 HSPC 进展为CRPC 过程中ANXA7的作用,本实验设计比较HSPC与CRPC组织、前列腺增生组织中ANXA7蛋白的表达情况。结果显示,ANXA7在前列腺增生组织中全部表达,而在前列腺癌组织中表达率明显下降,不到前者一半。这与以往研究结论类似,ANXA7表达减少或缺失与前列腺癌发生有关。我们针对HSPC 与CRPC 组织的比较研究发现伴随疾病进展,ANXA7蛋白的表达率逐步下降,HSPC 组织中有近五成表达,而CRPC组织仅有13.6%表达,且全部属弱阳性,表达差异显著不同。这一结果初步证实ANXA7的表达缺失在前列腺癌疾病进展为CRPC阶段扮演重要角色。
在ANXA7蛋白表达与HSPC 患者临床病理特征及生存期进一步的相关分析中,我们发现T 分期和N 分期越高,ANXA7 蛋白表达率越低;Gleason评分越高,ANXA7蛋白表达率也越低。考虑到上述临床病理指标一般认为是前列腺癌恶性程度高、预后不佳的危险因素,这一相关性研究提示ANXA7阴性表达可能与患者不良预后有关。我们进一步行ANXA7与患者PFS及OS的生存分析证实了上述推断,ANXA7表达阴性者,其PFS中位值较阳性表达者少9个月,而OS中位值相比阳性表达者则明显减少达20个月,统计分析认为ANXA7表达缺失是患者不良预后的预测因子。
本文在研究中探索抑癌基因ANXA7在前列腺癌发生发展中的作用,得到初步的相关性结论,但针对ANXA7促进前列腺癌疾病进展的具体作用机制还有待进一步探索,以往报道认为AR 在疾病进展中扮演不可或缺的重要角色,因此有关其作用机制的探讨还需将ANXA7 放置在AR 信号通路异常激活、AR 突变及上调改变等相关方面深入研究。
总之,本研究结果提示抑癌基因ANXA7蛋白表达减少可能在转移性前列腺癌疾病进展中具有重要作用并与患者不良预后密切相关。尽早进行ANXA7表达检测有助于判断患者预后、指导个体化治疗以及为临床试验提供分组依据。
[1]GUO C,LIU S,GREENAWAY F,et al.Potential role of annexin A7in cancers[J].Clin Chim Acta,2013,423:83-89.
[2]TOROSYAN Y,SIMAKOVA O,NAGA S,et al.Annexin-A7 protects normal prostate cells and induces distinct patterns of RB-associated cytotoxicity in androgen-sensitive and-resistant prostate cancer cells[J].Int J Cancer,2009,125(11):2528-2539.
[3]HEIDENREICH A,BASTIAN PJ,BELLMUNT J,et al.EAU guidelines on prostate cancer.Part II:Treatment of advanced,relapsing,and castration-resistant prostate cancer[J].Eur Urol,2014,65(2):467-79.
[4]MEERA S,LUKAS B,MARK R,et al.Prognostic impact of ANX7-GTPase in metastatic and HER2-negative breast cancer patients[J].Clin Cancer Res,2004,10(7):2344-2350.
[5]JU X,ERTELA,CASIMIRO MC,et al.Novel oncogene-induced metastatic prostate cancer cell lines define human prostate cancer progression signatures[J].Cancer Res,2013,73(2):978-89.
[6]NOMURA T,YAMASAKI M,HIRAI K,et al.Targeting the Vav3oncogene enhances docetaxel-induced apoptosis through the inhibition of androgen receptor phosphorylation in LNCaP prostate cancer cells under chronic hypoxia[J].Mol Cancer,2013,12:27-38.
[7]KOH CM,BIEBERICH CJ,DANG CV,et al.MYC and Prostate Cancer[J].Genes Cancer,2010,1(6):617-28.
[8]SIRCAR K,YOSHIMOTO M,MONZON FA,et al.PTEN genomic deletion is associated with p-Akt and AR signalling in poorer outcome,hormone refractory prostate cancer[J].J Pathol,2009,218(4):505-513.
[9]SRIVASTAVA M,TOROSYAN Y,RAFFELD M,et al.ANXA7expression represents hormone-relevant tumor suppression in different cancers[J].Int J Cancer,2007,121(12):2628-2636.
[10]HSU PI,HUANG MS,CHEN HC,et al.The significance of ANXA7expression and its correlation with poor cellular differentiation and enhanced metastatic potential of gastric cancer[J].J Surg Oncol,2008,97(7):609-614.
[11]JIN Y,WANG S,CHEN W,et al.Annexin A7suppresses lymph node metastasis of hepatocarcinoma cells in a mouse model[J].BMC Cancer,2013,13:522.
[12]YADAV AK,RENFROW JJ,SCHOLTENS DM,et al.Monosomy of chromosome 10associated with dysregulation of epidermal growth factor signaling in glioblastomas[J].JAMA,2009,302(3):276-289.
[13]SONG L,MAO J,ZHANG J,et al.Annexin A7and its binding protein galectin-3influence mouse hepatocellular carcinoma cell line in vitro[J].Biomed Pharmacother,2014,68(3):377-384.
[14]DONG JT.Prevalent mutations in prostate cancer[J].J Cell Biochem,2006,97(3):433-447.
[15]TOROSYAN Y,DOBI A,GLASMAN M,et al.Role of multihnRNP nuclear complex in regulation of tumor suppressor ANXA7in prostate cancer cells[J].Oncogene,2010,29(17):2457-2466.