MRS对可疑前列腺癌鉴别诊断价值的研究
方志海,王行环,刘 涛,吴文博,廖正明,刘 庆,杨中华
(武汉大学中南医院泌尿外科,湖北武汉 430071)
前列腺癌(prostate cancer,Pca)是当今世界发病率最高的男性恶性肿瘤,是造成美国男性癌症死亡的第二大原因[1]。在我国由于医疗条件的改善、人民生活方式的变化等,Pca发病率显著升高。Pca准确的定位、定性诊断及对惰性和侵袭性的区分在对临床治疗方案的选择上具有重要参考意义。目前受检查条件限制,直肠指诊、前列腺特异抗原(prostate specific antigen,PSA)检测、前列腺穿刺活检等只能提供参考形式单一且准确度较低的诊断信息。近年发展较快的前列腺核磁波谱成像技术可以利用化学位移原理从分子水平上提高癌灶检测率[2],提供丰富的形态学、代谢学信息,然而将其在临床广泛推广仍存在争议[3]。本研究旨在评价核磁共振波谱成像(magnetic resonance spectroscopy,MRS)对可疑Pca患者鉴别诊断的价值。
1 资料与方法
1.1 一般资料 回顾性收集2013年1月至2014年4月期间在中南医院因常规检查直肠指诊、PSA、经直肠超声检查后提示异常而怀疑Pca并进一步行核磁共振(magnetic resonance imaging,MRI)和MRS检查的患者共83例。所有患者在MRS检查前均未行穿刺活检或接受治疗,检查后行经直肠超声引导下前列腺穿刺活检和(或)经尿道前列腺电切术并取得病理结果。
1.2 MRI和MRS检查方法 ①采用Siemens公司Magnetom Trio Tim 3.0T 超导磁共振仪行前列腺常规扫描,前列腺轴位快速自旋回波亿加权序列,重复时间3 000~5 000 ms,回波时间95 ms,层厚3 mm,层间隔1 mm,激励次数4,视野256 mm×256 mm,采集矩阵324×315。②采用三维多体素波谱成像的方法,点分辨自旋回波波谱序列进行三维定域采集,尽量将整个组织置于三维矩形兴趣区域内,同时减少周围脂肪及直肠内气体的干扰。
1.3 MRS图像分析诊断 仪器自带软件计算每个MRS体素代谢物质Cho、Cit、Cre及CC/C 值。采用前列腺2分区法(轴位MRI图像上将前列腺分为左、右两叶),将相应体素归区定位,取每区体素最大值,以CC/C值>0.99作为诊断阈值,即比值≥0.99诊断为Pca,<0.99诊断前列腺增生(benign prostatic hyperplasia,BHP)[4]。
1.4 病理 所有采集标本常规处理制作病理切片。以病理诊断作为标准将患者分为Pca和BHP组,按前列腺左右叶分区定位癌灶位置。根据Gleason评分,以高、中分化(2~7 分)与低分化(8~10 分)将Pca患者分为相应2组,并分析各组MRS表现。
1.5 统计学分析 采用SPSS 19.0软件对相关数据行统计学处理。以病理结果为诊断标准计算MRS对Pca诊断的敏感度、特异度、准确度、阳性预测值及阴性预测值。统计前列腺癌区、非癌区和BPH MRS检查的CC/C值及不同病理分级患者癌区CC/C 值,用One-way ANOVA 行不同组间两两比较,以α=0.05为检验水准。并绘制受试者工作曲线(receiver operating characteris-ticcurve,ROC)曲线。
2 结果
2.1 一般资料 经病理证实32例Pca患者51个癌区,13个非癌区,52例BHP 患者(102区)。Gleason病理分级无高分化癌患者,17例中分化患者,15例低分化患者。患者年龄、PSA 值见表1。

表1 两组例数、年龄及PSA值比较
2.2 MRS波谱表现 BPH 组织MRS表现为较高的枸橼酸Cit峰,而胆碱Cho与肌酸Cre峰相对较低(图1A)。前列腺癌癌灶MRS主要表现为Cit峰降低,而Cho 峰明显升高(图1B)。Pca 患者非癌区MRS表现与BPH 类似。
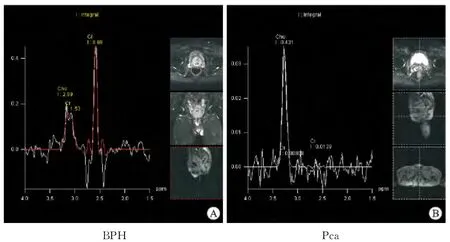
图1 BPH(A)、Pca(B)患者MRS波谱表现及定位
2.3 MRS检查定性结果 参照病理诊断结果,MRS定性诊断情况见表2,MRS对Pca诊断效率分别为敏感性87.5%、特异性86.27%、误诊率13.73%、漏诊率12.5%、准确度86.75%。
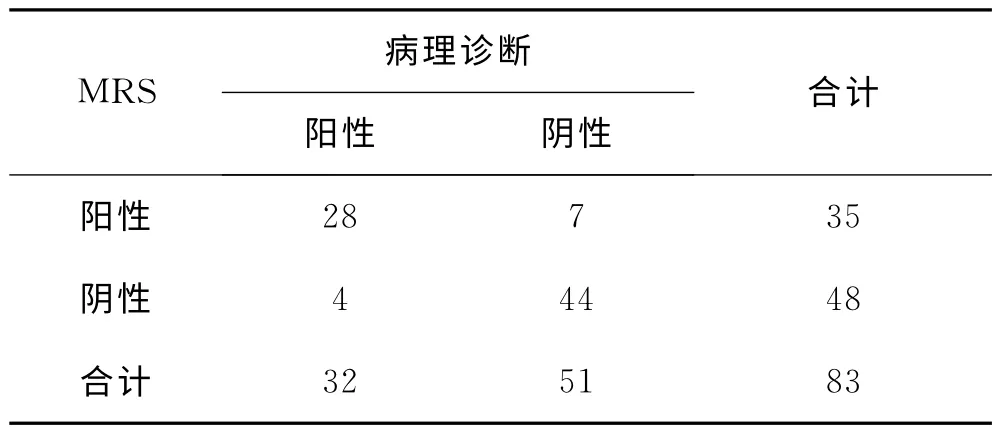
表2 83例病理确诊患者MRS诊断结果
2.4 MRS检查定量结果 前列腺癌癌区与非癌区、BPH 波谱表现及CC/C 值存在一定差异,癌区具有较高比值。非癌区与BPH MRS检查CC/C 值无统计学差异(表3)。根据病理Gleason评分分级,17例中分化组患者CC/C值为1.81±1.09,而15例低分化组患者CC/C值为3.38±0.98,中分化组CC/C值低于低分化组,且P<0.05。根据绘制的ROC 分析CC/C诊断Pca的最佳诊断域值为0.938,此诊断域值的敏感度78.4%、特异度89.2%、曲线下面积为0.898,见图2。
表3 前列腺良恶性病变波谱分析CC/C值结果 ()

表3 前列腺良恶性病变波谱分析CC/C值结果 ()
*与Pca非癌症相比;**:与BPH 相比;***:与Pca癌区相比。
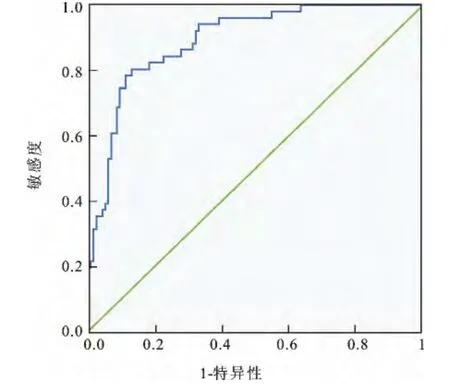
图2 CC/C值诊断Pca的ROC曲线
3 讨论
目前Pca公认的诊断标准是经直肠超声引导下穿刺活检术[5],而以PSA 异常等作为选择患者穿刺的指标往往导致穿刺阳性率较低,造成不必要的穿刺增加了患者的损伤,且超声引导下穿刺活检存在一定的取样误差且难以克服,约30%~45%病理分级结果过高或过低[6],使患者面临治疗方式选择不当的风险。本文83例患者穿刺阳性率为38%,可能存在过度穿刺的可能,而穿刺阴性的患者仍面临着漏诊、重复穿刺等风险。提高Pca的影像诊断能力不仅可以有效指导穿刺活检避免误差,而且为评估、主动监测Pca生长情况提供有效的非侵袭性工具,而三维核磁共振波谱分析技术能有效改善上述困境,且在MRI联合MRS引导下的穿刺不仅减少穿刺针数而且能明显提高穿刺阳性率[7]。
磁共振波谱分析利用化学位移原理,检测组织的代谢物质含量,从代谢学上提供疾病信息,有助于癌变的早期诊断。目前前列腺波谱扫描主要检测胆碱、肌酸、枸橼酸盐在单位体素前列腺组织中的含量。Cho是一种组成细胞膜成分的重要物质,在正常前列腺组织中Cho含量相对较少,但在Pca组织中因癌细胞代谢旺盛其含量明显增高。Cit是三羧酸循环的中间物质,正常前列腺组织中高浓度的锌能够抑制顺乌头酸酶的活性,Cit因此得以高浓度聚集;而在Pca中锌减少,顺乌头酸酶活性增强,Cit消耗增加;同时癌灶引起前列腺形态变化失去官腔样的结构,也使其储存量降低。Cre在前列腺良恶性组织之间的含量无明显差别[8]。波谱分析正是利用检测这三种代谢物质的含量变化来鉴别前列腺良恶性病变[9]。
近年文献报道联合应用MRS 有助于提高常规MRI诊断Pca 的效率,其特异度和灵敏度分别为79%~93%、72%~89%[10],且病理评分越高其诊断的灵敏度越大[11]。本研究的敏感度87.5%、特异度86.27%,较高的特异度可有助于临床医生排除一部分不需穿刺的患者。52例患者CC/C为0.70±0.77,32例Pca患者癌区CC/C 为2.52±1.42,且Gleason评分>7患者组CC/C为3.38±0.98,评分≤7患者组CC/C 为1.81±1.09,与文献描述Pca 和BPH 的物质波谱成像特点相符,说明Pca合成和储存Cit能力较良性前列腺组织明显下降,且Pca组织细胞膜的代谢活跃。
目前前列腺3D MRS主要应用于前列腺疾病的鉴别诊断,国外开展的MRS引导下前列腺穿刺也取得较理想结果[7]。然而MRS 仍存在不足之处。MRS对前列腺中央腺体的分辨能力相对较低,对较小的病灶诊断仍有一定困难,本研究中MRS就漏诊1例隐癌、1例只有1针阳性穿刺的患者;炎症及间质增生型BHP 也容易导致MRS 误诊,本文误诊的7例患者其中4例伴有慢性前列腺炎。此外繁琐的人工操作程序、高昂的检查费用也限制其临床应用[2,12]。
总之,MRS诊断Pca具有较高的准确性,减少不必要的穿刺且对病理分级有积极的参考价值,随着科学技术的发展,有代谢学特征“虚拟穿刺”之称的MRS将具有广泛的应用前景。
[1]SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics,2013[J].CA:a cancer journal for clinicians,2013,63(1):11-30.
[2]王芳.MRS 对前列腺癌诊断的研究现状[J].放射学实践,2013,28(11):1181-1183.
[3]KOBUS T,WRIGHT AJ,SCHEENE TW,et al.Mapping of prostate cancer by 1hMRSI[J].NMR BIOMED,2014,27(1):39-52.
[4]王霄英,周良平,丁建平,等.MRS对中国人前列腺癌鉴别诊断标准的初步研究[J].中国医学影像技术,2004,20(8):1150-1153.
[5]陈友干.前列腺穿刺活检[J].国际泌尿系统杂志,2011,31(3):346-351.
[6]THOMPSON J,LAWRENTSCHUK N,FRYDENBERG M,et al.The role of magnetic resonance imaging in the diagnosis and management of prostate cancer[J].BJU Int,2013,112(Suppl 2):6-20.
[7]VILLEIRS GM,DE MEERLEER GO,De VISSCHERE PJ,et al.Combined magnetic resonance imaging and spectroscopy in the assessment of high grade prostate carcinoma in patients with elevated PSA:A single-institution experience of 356 patients[J].Eur J Radiol,2011,77(2):340-345.
[8]MOORE CM,ROBERTSON NL,ARSANIOUS N,et al.Image-guided prostate biopsy using magnetic resonance imaging-derived targets:A systematic review[J].Eur Urol,2013,63(1):125-140.
[9]KOBUS T,WRIGHT AJ,WEILAND E,et al.Metabolite ratios in h mr spectroscopic imaging of the prostate[J].Magn Reson Med,2014Jan 31.doi:10.1002/mrm.25122.[Epub ahead of print]PMID:24488656[PubMed]
[10]BARENTSZ JO,RICHENBERG J,CLEMENTS R,et al.Esur prostate mr guidelines 2012[J].Eur Radiol,2012,22(4):746-757.
[11]VILLEIRS GM,OOSTERLINCK W,VANHERREWEGHE E,et al.A qualitative approach to combined magnetic resonance imaging and spectroscopy in the diagnosis of prostate cancer[J].Eur J Radiol,2010,73(2):352-356.
[12]张帆,黄毅.磁共振波谱成像(MRSI)应用于前列腺癌的评估[J].国际泌尿系统杂志,2010,30(2):176-179.