幽门螺杆菌多靶点疫苗工程菌BIB发酵及纯化工艺研究*
潘 兴,王保宁,杨 靖,李健春,祝 捷,周永君,王红仁,李明远,李婉宜△
1.四川大学华西基础医学与法医学院 微生物教研室(成都 610041);2.四川万可泰生物技术有限责任公司(成都 610041);3.湖北医药学院 微生物教研室(十堰 442000)
幽门螺杆菌(Helicobacterpylori,H.pylori)作为一种定植于胃和十二指肠黏膜的螺旋形革兰阴性菌,与慢性胃炎、消化性溃疡和胃癌的发生关系密切,1994年被世界卫生组织列为一类致癌因子[1,2]。H.pylori在全球范围内的感染率已超过50%,在我国的感染率为42%~90%[3]。目前临床治疗H.pylori感染多采用抗生素联合质子泵抑制剂,短期内具有较好的根除疗效,但近年来研究发现,推荐用于根除治疗的几种抗生素药物中,甲硝唑耐药率达60%~70%,克拉霉素耐药率达20%~38%,左氧氟沙星耐药率达30%~38%。此外,抗生素疗法还存在治疗后易复发、肠道菌群微生态失衡等不足,大大限制了其使用[3,4]。因此,接种有效的H.pylori疫苗是防治H.pylori感染的重要策略。
本课题前期构建了含分子内佐剂的重组幽门螺杆菌多靶点疫苗工程菌(BIB),并通过大量的体内外实验证实了BIB工程菌表达的重组蛋白(rBIB)具有良好的免疫原性与免疫保护性[5-8]。本研究以摇瓶发酵结果为基础,对影响BIB收率的因素如发酵培养基、工作种子液接种量、诱导剂浓度、诱导起始时间、诱导持续时间及诱导剂添加方式等进行优化,再放大工艺至50L发酵罐中进行综合条件验证,初步建立起BIB工程菌的高密度发酵工艺;再利用rBIB蛋白的高等电点特性(pI=9.05),在pH为7.0~7.5的磷酸盐缓冲液中目的蛋白带正电荷,并建立rBIB蛋白的阳离子交换层析纯化工艺,为深入研究rBIB蛋白性质及其规模化生产奠定基础,现报道如下。
1 材料和方法
1.1 材料
1.1.1 菌种BIB工程菌由四川万可泰生物技术有限责任公司构建并保存,菌种经中国食品药品检定研究院检定为合格。
1.1.2 仪器与主要实验试剂 BIOTECH-50JS型发酵罐购自上海保兴生物设备工程有限公司,AKTA purifier 100蛋白纯化仪、HiTrap SP Sepharose FF、 HiTrap CM-FF、 HiTrap SP Sepharose XL层析柱均购自GE公司,蛋白胨、酵母抽提物购自OXOID公司,其他试剂为进口或国产分析纯。
1.2 方法
1.2.1 工作菌种活化与发酵种子液制备 取-80℃保存的工作菌种1支,用500μL LB液体培养基复苏后,划线接种至LB固体平板中(卡那霉素,50 μg/mL),37℃培养12h。挑取单菌落至含有3mL LB试管中,37℃、240rpm培养12h,再以1%(v/v)比例接种到3mL试管中,相同条件培养3h,此为发酵一级种子;取发酵一级种子按1%(v/v)比例接种到100mL摇瓶中,相同条件培养3h,此为发酵二级种子;取发酵二级种子按10%(v/v)比例接种到2 000mL摇瓶中,相同条件培养3h,此为发酵三级种子,即为高密度发酵工作种子。
1.2.2 培养基的筛选 从LB、TB、SOC等5种培养基中筛选发酵最适宜的培养基。发酵工作种子按1%接种至上述培养基中,37℃生长4h后,5.0mM乳糖诱导表达7h,分别测定菌体湿重和蛋白表达量。
1.2.3 工程菌最佳接种量的确定 将发酵工作种子分别按 0.1%、0.5%、1.0%、1.5%、2.0%、4.0%、8.0%、10.0%体积比接种至培养基中,37 ℃生长4h后,加入终浓度为5.0mM的乳糖诱导表达7 h,0.5mM的IPTG诱导表达7h作诱导阳性对照。分别测定菌体湿重和蛋白表达量。
1.2.4 最佳诱导起始时间的确定 将发酵工作种子按1%体积比接种至培养基中,37℃分别培养1、2、3、4、5、6h后,加入终浓度为5.0mM 的乳糖,分别诱导表达7h;0.5mM的IPTG诱导表达7h作诱导阳性对照。分别测定菌体湿重和蛋白表达量。
1.2.5 最佳诱导时间的确定 将发酵工作种子按1%体积比接种至培养基中,37℃生长4h后,加入终浓度为5.0mM 的乳糖,分别诱导2、4、5、6、7、8、9h;0.5mM的IPTG诱导表达7h作诱导阳性对照。分别测定菌体湿重和蛋白表达量。
1.2.6 诱导剂添加方式的确定 将发酵工作种子按1%体积比接种至培养基中,37℃生长4h后,1次性加入终浓度为5.0mM的乳糖诱导表达7h;分2次添加的浓度为2.5mM/次,分别在第0h、3h添加,共诱导7h;分4次添加的浓度为1.25mM/次,分别在第0、1、2、3h添加,共诱导7h;0.5mM的IPTG诱导表达7h作诱导阳性对照。分别测定菌体湿重和蛋白表达量。
1.2.7 最佳诱导剂浓度的确定 将发酵工作种子按1%体积比接种至培养基中,37℃生长4h后,分别加入终浓度为0、0.5、1.0、2.0、3.0、4.0、8.0mM 的乳糖诱导表达7h;0.5mM的IPTG诱导表达7h作诱导阳性对照。分别测定菌体湿重和蛋白表达量。
1.2.8 发酵罐中高密度发酵条件的研究 根据摇瓶探索的条件和相关文献资料[9-11],再对培养基进一步优化。BIB工程菌发酵工作种子以4%的体积比接种至20LTB培养基中;生长至8h时,添加终浓度至5mM的乳糖作为诱导剂,继续培养10~11 h。在BIB工程菌对数生长期过程中(2~8h),以80mL/h的葡萄糖补充碳源;平台期时(8~16h)以40mL/h的甘油为流加碳源。全程滴加氨水控制pH在7.0左右,调整转速以控制溶解氧在30%左右,并每2h取样1次。分别测定发酵液吸光度OD578值、菌体湿重和蛋白表达量。
1.2.9BIB阳离子交换层析纯化工艺研究 利用rBIB高等电点特性(pI=9.05),在pH 为7.0~7.5的磷酸盐缓冲液中目的蛋白带正电荷,选择阳离子交换层析进行纯化,再根据阳离子交换层析填料的结合力选择不同层析柱。每次上样20mL、样品蛋白浓度2.5mg/mL、上样流速1mL/min(见表1)。

表1 不同阳离子交换层析柱纯化rBIB pH条件筛选
1.2.10 分析方法 将发酵液用培养基稀释20倍后,取200μL于酶标分析仪中在578nm处测其吸光度值;并取菌液100mL,4℃、10 000g离心10 min,弃上清后称菌体湿重;蛋白样品经SDS-PAGE电泳后用凝胶扫描分析仪扫描,Quantity-One软件分析目的蛋白表达量。
1.3 统计学方法
采用SPSS 19.0统计软件对数据进行统计分析,计量资料用均数±标准差(±s)表示,各组之间数据比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 高密度发酵培养基的筛选
LB培养基中蛋白表达量最高(42.3%),但菌体湿重收率最低(7.3g/L);而TB培养基中菌体湿重最高(12.4g/L),且蛋白表达量也较高(39.2%),故选择TB培养基用作高密度发酵用培养基(见图1)。
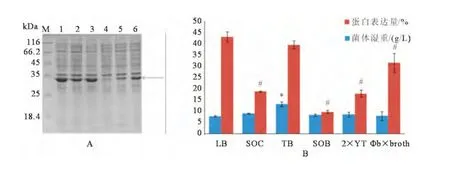
图1 不同培养基中BIB工程菌菌体湿重及重组蛋白rBIB的表达水平
2.2 工程菌最佳接种量的确定
当工程菌的接种量在1.0%~10.0%时菌体湿重收率与IPTG对照组比较,差异有统计学意义(P<0.05),且rBIB蛋白表达量与对照组比较,差异无统计学意义(P>0.05),但当接种量超过4.0%时蛋白表达量却随接种量的增加出现下降趋势,故选择1.0%~4.0%的接种量(见图2)。
2.3 乳糖最佳诱导浓度的确定
当乳糖浓度为5~8mM时菌体湿重收率与IPTG对照组比较,差异有统计学意义(P<0.05),且rBIB蛋白表达量与对照组比较,差异无统计学意义(P>0.05),故选择5~8mM 的乳糖浓度(见图3)。
2.4 工程菌最佳诱导起始时间的确定
当诱导初始时间在2~8h时,此时工程菌正处于生长对数期(见图7A)。4h时菌体湿重(7.88g/L)和蛋白表达量(43.6%)均达到最高,故选择转种后4h开始添加诱导剂(见图4)。
2.5 工程菌最佳诱导时间的确定
当诱导时间在7~8h时,菌体湿重收率、蛋白表达量与IPTG对照组比较,差异有统计学意义(P<0.05),故选择诱导时间为7~8h(见图5)。

图2 不同接种量条件下工程菌菌体湿重及重组蛋白表达量

图3 不同诱导剂浓度条件下工程菌菌体湿重及重组蛋白表达量

图4 不同初始诱导时间条件下工程菌菌体湿重及重组蛋白表达量

图5 不同诱导时间条件下工程菌菌体湿重及重组蛋白表达量
2.6 乳糖添加方式的确定
当乳糖一次性添加时,菌体湿重收率与IPTG对照组比较,差异有统计学意义(P<0.05),且rBIB蛋白表达量与对照组比较,差异无统计学意义(P>0.05),故乳糖应一次性添加(见图6)。

图6 不同乳糖添加方式对重组蛋白表达量的影响
2.7 发酵罐高密度发酵条件的研究
由BIB工程菌在发酵罐中的菌落数(CFU)及菌液吸光度OD578值随发酵时间的变化可得,其生长对数期在2~8h和8~16h为平台期,16h后进入衰亡期(见图7A)。对数末期8h添加诱导剂乳糖,继续培养10~11h,收集菌体,最终菌体湿重收率为70g/L,重组蛋白表达量约为32%(见图7B)。发酵罐高密度发酵与摇瓶发酵相比,高密度发酵显著提高了BIB工程菌菌体收率(P<0.05),且重组蛋白的表达量二者之间比较差异无统计学意义(P>0.05;见图7B)。
2.8 BIB阳离子交换层析纯化工艺研究
当纯化缓冲液pH 为7.5时,HiTrap SP Sepharose XL、HiTrap SP Sepharose FF、HiTrap CM-FF三者纯化后的rBIB纯度分别为:75.3%、61.9%、49.9%;当纯化缓冲液pH 为7.0时,三者纯化后的rBIB纯度分别为:91.8%、67.7%、52.3%(见图8)。由此可见,rBIB纯化结合缓冲液及洗脱缓冲液的pH为7.0时效果较好,且选择HiTrap SP Sepharose XL层析柱效果最好,纯化后的样品纯度可达到91.8%。

图7 高密度发酵条件下rBIB的表达水平检测

图8 SDS-PAGE检测阳离子交换层析后的rBIB纯度
3 讨论
利用普通的发酵工艺生产大肠杆菌或其基因工程菌的表达产物时,大肠杆菌的生物量、蛋白表达量、代谢产物在菌体内和发酵液中的浓度都比较低,难以实现规模化生产。而高细胞密度发酵(high cell density cultivation,HCDC)在一定条件和培养体系下,能获得最多的工程菌细胞量,由此可以更高效地获得目的产物。HCDC即利用一定的培养技术和装置提高菌体的发酵密度,使菌体密度较普通培养有显著提高,最终提高产物的生产率。此外,大肠杆菌结构简单、遗传学背景清晰、生长周期短、生长条件清楚,已成为最为常用的宿主菌[12]。
乳糖操纵子(lac)是目前研究最为详尽、应用较为广泛的一种可诱导负调控型操纵子[13]。诱导剂IPTG是一种高效的乳糖启动子诱导剂,可以直接进入大肠杆菌细胞内发挥诱导作用,是一种非代谢性的诱导物,但其具有潜在的毒性,对菌体生长有一定抑制作用,一些国家已明文规定在生产人用重组蛋白质的生产工艺中不得使用[14,15]。乳糖是一种天然的lac启动子的诱导物,相比IPTG而言,具有无毒、价廉,可以作为碳源、氮源被利用等优点,且成本不足IPTG的1%,宜于大规模生产[16]。然而由于乳糖的转运和转化比IPTG复杂,且可以被菌体代谢利用,对于菌体的生理及代谢也有一定程度的影响,因此乳糖作为诱导剂时需要对其进行条件摸索。
由于重组大肠杆菌进行高密度发酵可获得较高的生物量而对发酵条件有非常高的要求,影响高密度发酵的因素又较多,且采用乳糖作为诱导剂时,有必要对菌体生长及诱导条件进行更为精细的研究和优化。本实验首先在摇瓶中针对各个单因素如发酵培养基、工作种子液接种量、诱导剂浓度、诱导起始时间、持续诱导时间和诱导剂添加方式等进行优化,得出各个最佳条件,再进一步经过50L发酵罐发酵验证,最终得出了工程菌高密度发酵的最佳条件。本研究表明,高密度发酵工艺较摇瓶发酵对工程菌的菌体湿重提高了约7倍,且目标蛋白表达量相似。
本研究还利用rBIB蛋白的高等电点特性(pI=9.05),在pH 为7.0~7.5的磷酸盐缓冲液中目的蛋白带正电荷,进而初步探索了其阳离子交换层析纯化条件,对纯化缓冲液pH及阳离子交换层析填料进行了筛选。结果显示当纯化缓冲液pH从7.5降至7.0后,rBIB蛋白在 HiTrap SP Sepharose XL、HiTrap SP Sepharose FF及 HiTrap CM-FF 3种纯化柱上纯化效果均出现了升高,这是由于纯化缓冲液pH下降使得rBIB蛋白偏离等电点更远,与相应的阳离子填料结合更为紧密。SP Sepharose XL为超高载量强离子交换层析填料,功能基团为磺丙基(SP);SP Sepharose FF为高流速强离子交换层析填料,功能基团为磺丙基(SP);而CM-FF为弱离子交换层析填料,功能基团为羧甲基(CM)。结果显示,当选择HiTrap SP Sepharose XL层析柱以及缓冲体系pH为7.0时,纯化效果最佳,rBIB蛋白纯度达到了91.8%。
综上所述,BIB工程菌高密度发酵及纯化工艺较为先进,为rBIB蛋白的深入研究及其工业化生产奠定了坚实基础。
[1]Strugatsky D,McNulty R,Munson K,etal.Structure of the proton-gated urea channel from the gastric pathogen Helicobacter pylori[J].Nature,2013,493(7431):255-258.
[2]Wang C,Yuan Y,Hunt RH.The association between Helicobacter pylori infection and early gastric cancer:a metaanalysis[J].The American Journal of Gastroenterology,2007,102(8):1789-1798.
[3]胡伏莲.幽门螺杆菌感染治疗现状与展望[J].胃肠病学和肝病学杂志,2012,21(8):687-690.
[4]Malfertheiner P,Megraud F,O'Morain CA,etal.Management of Helicobacter pylori infection-the Maastricht IV/Florence consensus report[J].Gut,2012,61(5):646-664.
[5]潘兴,肖继红,杨靖,等.幽门螺杆菌BIB原核表达工程菌的构建及微生物学特性分析[J].西部医学,2013,25(10):1451-1454.
[6]杨靖,潘兴,欧琴,等.幽门螺杆菌双基因多表位重组原核表达工程菌的构建及其表达特性的研究[J].成都医学院学报,2013,8(4):410-414.
[7]丁娜娜,杨靖,潘兴,等.幽门螺杆菌多表位重组原核表达工程菌的构建及表达特性研究[J].四川大学学报:医学版,2014,45(3):367-370.
[8]王保宁,喻堃,李明远,等.一种多靶点重组基因及其蛋白在防治幽门螺杆菌感染中的应用[P].中国专利:201010274782.X,2012-07-04.
[9]Krause M,Ukkonen K,Haataja T,etal.A novel fed-batch based cultivation method provides high cell-density and improves yield of soluble recombinant proteins in shaken cultures[J].Microbial Cell Factories,2010,9(1):11.
[10]Bordeaux M,de Girval D,Rullaud R,etal.High-cell-density cultivation of recombinant Escherichia coli,purification and characterization of a self-sufficient biosynthetic octane ωhydroxylase[J].Appl Microbiol Biotechnol,2014,98(14):6275-6283.
[11]Grunzel P,Pilarek M,Steinbrück D,etal.Mini-scale cultivation method enables expeditious plasmid production in Escherichia coli[J].Biotechnol J,2014,9(1):128-136.
[12]Tripathi NK.High yield production of heterologous proteins with Escherichia coli[J].Defence Science Journal,2009,59(2):137-146.
[13]Wang Y,Yu H,Song W,etal.Overexpression of synthesized cephalosporin C acylase containing mutations in the substrate transport tunnel[J].J Biosci Bioeng,2012,113(1):36-41.
[14]Semsey S,Jauffred L,Csiszovszki Z,etal.The effect of LacI autoregulation on the performance of the lactose utilization system in Escherichia coli[J].Nucleic Acids Res,2013,41(13):6381-6390.
[15]Tan JS,Ramanan RN,Ling TC,etal.The role of lac operon and lac repressor in the induction using lactose for the expression of periplasmic human interferon-α2bby Escherichia coli[J].Annals of Microbiology,2012,62(4):1427-1435.
[16]Xu J,Banerjee A,Pan SH,etal.Galactose can be an inducer for production of therapeutic proteins by auto-induction using E.coli BL21strains[J].Protein Expr Purif,2012,83(1):30-36.

