行为性体温调节生理意义及其影响因素的研究进展
杨永录,卜舒,李博萍
(成都医学院体温与炎症四川省高校重点实验室,成都 610500)
行为性体温调节是人与动物(包括恒温和变温动物)在不同环境中采取的姿势和发生的行为活动,特别是人为了能够维持体温恒定,可根据气候变化而增减衣服或人工改变环境温度等方法来减少机体能量的消耗和降低机体代谢,这种通过行为活动来减少环境温度变化对人体体温的影响称为行为性体温调节(behavioral thermoregualation)。行为性体温调节是有意识的调节机体热平衡的活动过程。人在寒冷环境中如果衣着不暖,除了骨骼肌发生战栗产热外,同时会有意识地采取拱肩缩背和踏步运动或跑步等御寒行为。这种行为性体温调节能有效降低自主性体温调节活动,从而降低体温调节反应过程中引起的能量消耗[1,2],特别是在极端环境温度中,人与恒温动物主要依赖行为性体温调节维持体温恒定,因为自主性体温调节防止体温过高或过低的功能是有限的[1-3]。由此可见行为性体温调节在维持体内温度恒定,保证机体正常功能活动过程中有非常重要的作用。为此,本文首先讨论行为性体温调节的方式及其对体温恒定的意义,然后简要讨论影响行为性体温调节的因素。
1 优选最适环境温度
人与动物经常寻找最适的环境温度,使外界环境温度与机体舒适温度基本一致[2,4]。机体在最适环境温度中,体核温度维持在正常范围内代谢活动稳定。若体核温度快速升高或降低,超出生理极限温度时,就会严重威胁生命。在冷环境中选择最适温度是为了寻找机体与环境之间最小温度差的行为活动,以减少机体与环境之间的温度梯度,有利于机体减少散热和保存热量;而在热环境中选择最适温度是为了增加机体与环境之间的温度梯度,有利于机体提高散热和防止体温过高[2]。这种行为活动能使机体在维持正常体温过程中消耗能量最少[5]。图1显示,动物选择最适环境温度区与最低耗能量出现重合现象,即最低能量消耗与热中性温度区和温度舒适区重合在一起。当环境温度变化超过上临界环境温度或低于下临界环境温度时,机体的能量消耗明显增加(见图1U曲线),同时引起机体过冷或过热的反应,并出现行为性体温调节活动,以避免体温过低或过高。
通常将实验动物置于温度梯度仪中,就能够进行测定和评估动物优选最适温度。在温度梯度设备内的不同环境温度中,允许动物自由进行优先选择最适环境温度。用这种设备对金仓鼠、沙鼠、地松鼠、大鼠、小鼠、树鼩、蝙蝠、袋鼠、兔、裸鼹鼠和鼠狐猴等动物观察发现,不同种系的动物对能量需求不同,因而优选最适环境温度不同[2]。Gordon等发现,小鼠优选最适环境温度的平均值为30.9℃,豚鼠为30.6℃,金仓鼠为28.2℃,而Fischer大鼠为23.4℃[6]。此外,动物选择最适环境温度的昼夜变化与体温昼夜节律变化有关,出现这种现象是由于机体昼夜产热变化的需要。人和灵长类动物证实,这些结果与行为性体温调节能限制体核温度变化的假说是一致的[2,7]。大鼠在夜间活动期选择24℃环境温度,在白天休息期则选择27℃环境温度[8]。
2 避免出现低温的行为活动
当人和动物暴露在低温环境中,除了出现皮肤血管收缩使散热减少和产热增加外,机体还通过行为性体温调节保持能量摄取与储存的平衡,以维持体温恒定。在哺乳类动物中一种十分常见的行为是躯体蜷缩或互相碰撞拥抱来产生更多的热量,而人类似乎羞于如此。另外,动物的巢穴共享和晒太阳等行为都是保存和获得热量的行为活动。
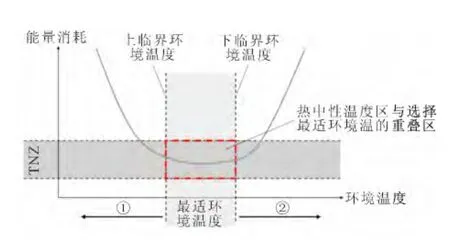
图1 环境温度变化对能量消耗的影响与行为性体温调节关系示意图
2.1 维持机体热量的行为
从人与啮齿类动物中观察到,躯体姿势变化是减少热量散失的一种有效行为性体温调节。如躯体缩成团和利用日光辐射热量或提高环境温度等均能有效降低自主性体温调节过程中能量的消耗,有利于维持体温稳定[1,2]。下列主要介绍哺乳类动物维持机体热量的行为性活动。
2.1.1 改变躯体姿势和晒太阳 哺乳类动物躯体以球状姿势(Ball-like posture)来减少热量散失而起到保存能量的作用。这种躯体姿势降低了体表面积与体积比率,减少了体表与空气的接触面积,从而减少了热量的散失。在哺乳动物中通常几乎都是采用球状躯体姿势保存热量。在寒冷季节或低温环境中,也能够观察到人会缩颈弓背,猴类和啮齿类动物也常常出现躯体球状姿势和弓背姿势,狒狒还能够根据风向和阳光的方向改变躯体的位置和姿势[12]。
晒太阳是人和动物(如袋鼠、大象鼩、蝙蝠、岩蹄兔、岩鼠及灵长类动物)的一种降低体内能量消耗的行为活动。晒太阳是将太阳的热辐射转化为热量后温暖躯体。这种被动获得的热量是通过面向太阳光的皮肤(特别是黑色的皮肤)或者通过栖息在较高环境温度中来实现的。动物增加晒太阳的时间会降低体内能量的利用率,这反映出了这类行为调节与能量消耗的关系[2]。
变温类动物从冬眠中觉醒需要消耗大量的能量,而被动加热是机体复温过程中减少体内能量消耗的一种非常有效的方法。如狭足袋鼩从洞穴中出来,其体温与土壤的温度基本一致,约为15℃,在太阳光下,体温从15℃可升高到33℃左右。有趣的是云层能降低太阳光引起的升温作用。进一步观察证明,晒太阳能够降低狭足袋鼩能量代谢50%以上[9]。冬眠动物机体复温过程,还需要自主性体温调节功能的参与,例如战栗产热和非战栗产热。
2.1.2 巢穴居住 巢穴居住不仅可以提供稳定的休息环境,而且能够躲避食肉动物的袭击和抵御寒冷,这种方式非常有利于小哺乳动物的生存。巢穴居住也能保存机体散发出来的热量,有助于提高巢穴内的温度,同时动物躯体蒸发的水分能增加巢穴内的湿度,从而减少动物休息时体内水分的丢失,这一特性对处于寒冷和干燥环境中的动物非常重要。选择具有良好保温性能的巢穴材料对小哺乳动物的生存也很重要。事实上动物在绝热性能较差的树洞中睡眠时,机体能量的消耗明显大于在穴壁较厚保温性能好的树洞内的动物。由于巢穴有保温作用,睡眠在巢穴内的动物有利于减少机体能量的消耗[2]。
2.1.3 聚集行为 聚集行为可分两类,一类是在开放环境中许多动物的聚群行为,也叫做结群行为;另一类是在巢穴内的聚群行为,称为巢穴共享。这两种聚集行为多见于群居动物。动物聚集在一起能减少体表面积与躯体体积比率,因而可减少机体散热量,能起到保存体内热量的作用。在实验中已经观察到大鼠、小鼠、兔、仓鼠、猪、蝙蝠、旱獭、狐猴、海豹以及猴类等动物都有聚群行为,最典型的例子是企鹅在冰天雪地里拥挤在一起的行为活动。
动物巢穴共享有利于降低机体散热和产热,这样可以降低体内能量的消耗,这种行为多见于袋鼠、白脚鼠和鼠狐猴等动物,巢共享行为也能提高灵长类动物的免疫功能[10]。另外,多项遗传学研究证明动物个体间的相互聚集与遗传有关[11]。巢穴共享和集群行为与生态环境制约、生理需要以及防御捕食者入侵等因素有关。
2.2 提高机体产热的行为活动
人和动物在寒冷环境中需要通过提高活动增加产热量,因为肌肉活动对产热量影响最显著,机体轻微的活动就会提高产热量。劳动或运动时,肌肉的产热量可占机体总产热量的90%。在低于热中性温度区中观察到灵长类动物的自由活动增加的特别明显。虽然肌肉活动是机体产热的重要来源,但肌肉活动能耗也很高,并且需要不断摄入能量进行补充。所以,寒冷环境下增加能量摄入是维持能量平衡的重要因素。人和动物在安静状态下,进食也能促进机体产热,食物能使机体产生额外热量的现象被称为食物的特殊动力效应。不同的食物产生的效应不同,蛋白质食物特殊动力效应最显著,额外增加的热量可达30%;糖或脂肪类食物增加的热量约为4%~6%,混合食物为10%左右。目前认为,进食后的额外热量可能来源于肝脏处理蛋白质分解产物,如进行脱氨基反应时额外消耗的能量。
3 避免体温过高的行为活动
体温升高有两种情况,一种是发热,机体的体温调节功能没有障碍,而是体温调节中枢的调定点上移引起的体温升高,属于主动性体温升高。另一种是过热,主要不是机体自身调节机制的原因,而是由散热不良所引起,如在热环境中(温度超过舒适温度的环境称为热环境或高温环境,通常认为29℃以上属于高温),气温、气湿、气流和热辐射等物理因素综合作用阻碍了机体散热,而引起机体过热或体温过高,属于被动性体温升高。环境过热引起的热应激反应不仅会严重影响新陈代谢和体内水分的丢失,而且能导致中枢神经系统功能障碍。
在炎热的季节,几乎所有哺乳动物都通过寻找阴凉的环境进行躲避酷热,如进入洞穴或浸入水中等行为活动有利于体内热量的散失[2,11]。这些行为活动与脑内的多巴胺系统有关[13],小鼠脑内多巴胺系统失活时,则失去了从热环境中逃逸的行为活动[14]。夜间活动和觅食的小动物,尤其是栖息在干旱或半干旱地区的动物,白天几乎都躲藏在有防热作用的地下洞穴或树洞内,以降低能量和水分的消耗,如松鼠在洞穴里通常能使体温降低1~2℃[15,16]。昼行和觅食的动物,在酷热季节会减少其白天的活动[16]。
哺乳动物也能通过改变体位姿势促进散热。在炎热的季节有些动物会选择俯卧在凉爽的地面或寻找有风的环境。改变体位姿势的行为能增加躯体表面与温度较低物体接触的面积或增加躯体表面与空气接触的面积,有利于传导散热和对流散热。这种散热形式与动物体表皮肤上毛的密度有密切关系,皮肤上毛的密度<1 000根/cm2时,38m/s的风速就能穿透到体表毛的深部;而皮肤上毛的密度>1 000根/cm2以上时,88m/s的风速都不易穿透到体表毛的深部[15]。由此可见,皮肤上毛的密度越大,皮肤散热就越少。另外,体内有部分热是通过鼻、耳、足部和尾部蒸发散失[17],如大象的耳朵不仅大而薄,而且血管分布丰富,因而在机体散热中发挥着非常重要的作用。血液流经耳部很容易将热量散失,特别是大象将耳朵扇动起来,更容易将耳部的温度快速散失,能让耳部血温降低5℃,耳部冷却了的血液经过体循环有助于降低全身温度[17]。
在面临体温过高的风险时,动物也通过减少能量摄入使产热下降,以防止体温过高,因为能量摄取是热量生成的来源,意味着动物在高温环境中适度减少能量的摄入对机体是有益的。动物在热环境中减少活动也是防止体温升高的重要行为反应。
4 影响行为性体温调节的因素
体温调节在维持机体内环境稳定中有非常重要的作用,这种调节功能除了受体温调节中枢、能量代谢以及内分泌系统的调节外,气候、性别和衰老等因素也会影响行为性体温调节。
4.1 季节变化对体温调节功能的影响
体温调节功能受季节变化与季节变化引起的内分泌激素水平变化有关[18]。例如,金仓鼠在进入冬眠状态前优选8℃环境温度,而在冬眠结束后则优选24℃以上的环境温度[2]。鼠狐猴的行为性体温调节在选择环境温度和巢穴共享中也表现出季节性差异[7]。
4.2 性别对行为性体温调节的影响
众所周知,体温有性别差异,其原因是由于雄性与雌性的产热机制和基础体温不同。在啮齿类动物和灵长类动物中发现,性别对行为性体温调节也有影响[20-23]。雌性啮齿类动物在寒冷环境中的产热量大于雄性[21],这种性别差异也可能与寒冷引起的血管收缩不同有关[22]。雌性动物维持体核温度的稳定性大于雄性,可能是由于雌性动物有较强的行为性体温调节能力,能使机体耗能水平维持在较低状态[23]。
4.3 衰老对行为性体温调节的影响
临床和动物研究均证明,当机体在热中性温度区以下和热应激条件下,维持体温恒定几乎涉及全身所有系统[24-26]。但随着年龄的增加机体各系统的功能会自然衰退,包括体温调节功能[24,27]。当骨骼肌衰老时,不仅会出现肌肉的力量和功能减退,而且也会出现战栗产热减少,同时棕色脂肪质量和/或解偶联蛋白-1(UCP1)的降低使非战栗性产热能力也减弱,可导致体温降低[24,25]。外周动脉硬化不仅危害心脑功能,同时由于其收缩力降低可引起体内的热量散发过多而致体温降低[24-26]。另外,老年人全身出汗减少和皮肤血管反射性舒张功能减弱,而暴露于热环境中散热功能也出现降低现象[28,29]。
关于老年人行为性温度调节研究的比较少。但通常认为老年人行为性体温调节能力较青年成人降低,主要是老年人温度敏感性的降低,延缓了对环境温度变化的感知,因而延迟了行为性调节活动[24]。另外,中枢神经系统的调节功能减弱也可能是老年人行为性体温调节能力降低的原因之一[29]。动物实验发现,老年鼠狐猴在白天和夜间选择的环境温度均高于年轻动物,说明老年动物喜欢选择温度较高的环境[19]。老年动物通过行为性体温调节选择较高的环境温度,有助于减少在冷环境中机体能量的消耗[30,31]。这种行为性体温调节与代谢之间的关系在啮齿类动物中也得到了证实[2]。
鉴于衰老对自主性体温调节能力的影响,特别在极端环境温度条件下,自主体温调节则不能维持体温的恒定,而主要依赖于行为性体温调节。行为体温调节反应通常出现在自主性调节之前,只要皮肤温度感受器感受到环境温度的变化或眼睛看到以及耳朵听到温度变化的信息,就会增减衣服以及打开取暖或降温装置。目前人们认为,由于老年人自主性体温调节功能降低,所以行为性体温调节功能在维持体温恒定中有非常重要的作用。
5 结论
体温调节在维持内环境恒定中有非常重要的作用,而且体温调节与体内能量平衡有密切的关系。当环境温度发生变化时,自主性体温调节功能增强,将会提高机体能量的消耗率。但行为性体温调节能有效地降低自主性体温调节活动,从而降低自主性体温调节过程中能量的消耗。所以,通常人和动物会持续寻找最适环境温度,以减少在维持正常体温过程中能量的消耗。这样不仅可以避免寒冷环境引起的散热增加和产热减少而导致低温反应;并且也能避免热环境影响机体散热反应,以防止出现体温过高和脱水。
总之,行为性体温调节是在环境和机体之间建立最佳热交换条件的一种协调行为,并且根据不同情况进行散热与储热平衡的调节[1]。虽然通常认为行为性体温调节是一种原始的体温调节反应,但所有动物都有这种高效的体温调节能力。因为自主性体温调节功能有限,而行为性体温调节的功能是无限的。特别是人不仅有体温调节的行为能力,而且还能够提供主观反馈信息有助于揭示行为性体温调节的机制。
[1]Schlader ZJ, Stannard SR, Mündel T. Human thermoregulatory behavior during rest and exercise—A prospective review[J].Physiol Behav,2010,99(3):269-275.
[2]Terrien J,Perret M,Aujard F.Behavioral thermoregulation in mammals:a review[J].Front Biosci,2011,16:1428-1444.
[3]Morrison SF,Nakamura K.Central neural pathways for thermoregulation[J].Front Biosci,2011,16:74-104.
[4]Flouris AD. Functional architecture of behavioural thermoregulation[J].Eur J Appl Physiol,2011,111(1):1-8.
[5]Romanovsky AA,Ivanov AI,Shimansky YP.Selected contribution:ambient temperature for experiments in rats:a new method for determining the zone of thermal neutrality[J].J Appl Physiol,2002,92(6):2667-2679.
[6]Gordon CJ.Principles of temperature regulation.In:Temperature and toxicology[M].CRC Press,New York,2005:13-106.
[7]Aujard F,Seguy M,Terrien J,etal.Behavioral thermoregulation in a non human primate:effects of age and photoperiod on temperature selection[J].Exp Gerontol,2006,41(8):784-792.
[8]Ray B,Mallick HN,Kumar VM.Changes in thermal preference, sleep-wakefulness, body temperature and locomotor activity of rats during continuous recording for 24 hours[J].Behav Brain Res,2004,154(2):519-526.
[9]Warnecke L,Geiser F.The energetics of basking behaviour and torpor in a small marsupial exposed to simulated natural conditions[J].J Comp Physiol B,2010,180(3):437-445.
[10]Aujard F,Perret M.Health status and nesting pattern in male gray mouse lemurs(Microcebus murinus)[J].Revue D Ecologie-La Terre Et La Vie,2009,64(3):197-205.
[11]Radespiel U,Sarikaya Z,Zimmermann E,etal.Sociogenetic structure in a free-living nocturnal primate population:sexspecific differences in the grey mouse lemur(Microcebus murinus)[J].Behav Ecol Sociobiol,2001,50(6):493-502.
[12]Jackson CR,Setsaas TH,Robertson MP,etal.Insights into torpor and behavioural thermoregulation of the endangered Juliana's golden mole[J].J Zool,2009,278(4):299-307.
[13]Almeida MC,Steiner AA,Branco LG,etal.Cold-seeking behavior as a thermoregulatory strategy in systemic inflammation[J].Eur J Neurosci,2006,23(12),3359-3367.
[14]Harikai N,Sugawara T,Tomogane K,etal.Dopamine 2 antagonists suppress the jumping escape behavior of mice exposed to heat[J].J Therm Biol,2008,33(6):369-373.
[15]Kotze J,Bennett NC,Scantlebury M.The energetics of huddling in two species of mole-rat(Rodentia:Bathyergidae)[J].Physiol Behav,2008,93(1-2):215-221.
[16]Haim A, AlmaA, Neuman A. Body mass is a thermoregulatory adaptation of diurnal rodents to the desert environment[J].J Therm Biol,2006,31(1-2):168-171.
[17]Sumbera R,Zelova J,Kunc P,etal.Patterns of surface temperatures in two mole-rats(Bathyergidae)with different social systems as revealed by IR-thermography[J].Physiol Behav,2007,92(3):526-532.
[18]Lovegrove BG.Seasonal thermoregulatory responses in mammals[J].J Comp Physiol B,2005,175(4):231-247.
[19]Lahann P.Habitat utilization of three sympatric cheirogaleid lemur species in a littoral rain forest of southeastern Madagascar[J].Int J Primatol,2008,29(1):117-134.
[20]Valle A,Garcia-Palmer FJ,Oliver J,etal.Sex differences in brown adipose tissue thermogenic features during caloric restriction[J].Cell Physiol Biochem,2007,19(1-4):195-204.
[21]McDonald RB,Day C,Carlson K,etal.Effect of age and gender on thermoregulation[J].Am J Physiol Regul Integr Comp Physiol,1989,257(4):R700-R704.
[22]Schmid J,Ganzhorn JU.Optional strategies forreduced metabolism in gray mouse lemurs[J].Naturwissenschaften,2009,96(6):737-741.
[23]Blatteis CM.Age-Dependent Changes in Temperature Regulation—A Mini Review[J].Gerontol,2012,58(4):289-295.
[24]Van Someren EJ.Thermoregulation and aging[J].Am J Physiol Regul Integr Comp Physiol,2007,292(1):R99-R102.
[25]Terrien J,Ambid L,Nibbelink M,etal.Non-shivering thermogenesis activation and maintenance in the aging gray mouse lemur(Microcebus murinus)[J].Exp Gerontol,2010,45(6):442-448.
[26]López-Otín C,Blasco MA,Partridge L,etal.The hallmarks of aging[J].Cell,2013,153(6):1194-217.
[27]Silva EJ.Physiological importance and control of nonshivering facultative thermogenesis[J].Front Biosci,2011,3:352-371.
[28]Ueno N,Oh-ishi S,Segawa M,etal.Effect of age on brown adipose tissue activity in the obese(ob/ob)mouse[J].Mech Ageing Dev,1998,100(1):67-76.
[29]Charkoudian N.Mechanisms and modifiers of reflex induced cutaneous vasodilation and vasoconstriction in humans[J].J Appl Physiol,2010,109(4):1221-1228.
[30]Terrien J,Zahariev A,Blanc S,etal.Impaired Control of Body Cooling during Heterothermia Represents the Major Energetic Constraint in an Aging Non-Human Primate Exposed to Cold[J].PLoS One,2009,4(10):e7587.
[31]Terrien J,Zizzari P,Bluet-Pajot MT,etal.Effects of age on thermoregulatory responses during cold exposure in a nonhuman primate,Microcebus murinus[J].Am J Physiol Regul Integr Comp Physiol,2008,295(2):R696-703.

