CDR3δ2基因修饰γδT细胞的构建及其功能鉴定
胡愉,赵慧,王准,何维*
(1.中国医学科学院 基础医学研究所 北京协和医学院 基础学院 免疫学系 医学分子生物学国家重点实验室,北京 100005;2.中国食品药品检定研究院 病毒三室,北京100050)
#对本文有相同贡献
研究论文
CDR3δ2基因修饰γδT细胞的构建及其功能鉴定
胡 愉1#,赵 慧1,2#,王 准1,何 维1*
(1.中国医学科学院 基础医学研究所 北京协和医学院 基础学院 免疫学系 医学分子生物学国家重点实验室,北京 100005;2.中国食品药品检定研究院 病毒三室,北京100050)
目的将全长γ9链mRNA和肿瘤反应性CDR3移植的δ2链mRNA共转染到抗CD3抗体刺激的PBMC,制备CDR3δ2基因修饰型γδ T淋巴细胞,研究其抗肿瘤作用。方法通过PCR扩增含有肿瘤反应性特异CDR3δ2序列(OT3和OT10)的TCR δ2链及γ9链,构建重组质粒pGEM4Z/δ2(OT3)/A64、pGEM4Z/ δ2(OT10)/ A64和pGEM4Z/γ9/A64;以线性化的重组质粒作为模板,体外合成δ2(OT3)、δ2(OT10)和γ9 mRNA;将δ2(OT3) mRNA和δ2(OT10) mRNA分别与γ9 mRNA共电转染入抗CD3抗体刺激的正常人PBMC;经流式细胞术检测和分选γ9δ2(OT3) T细胞和γ9δ2(T10)T细胞。ELISA及MTT法分别检测上述转染细胞的抗肿瘤作用。结果CDR3δ2基因修饰的TCRγδ细胞γ9δ2(OT3)T细胞和γ9δ2(T10) T细胞能够分泌较高的IFN-γ及TNF-α(Plt;0.05),对多种肿瘤细胞具有显著的细胞毒作用(Plt;0.05)。结论基因修饰型γ9δ2 T细胞能够明显增强对肿瘤的杀伤活性,为肿瘤过继免疫细胞的制备提供了新的策略。
T细胞;CDR3δ2;γδTCR;过继免疫治疗;OT3;OT10
肿瘤的免疫治疗被人们寄予厚望,尤其是肿瘤特异性T淋巴细胞介导的过继性免疫治疗被认为是有巨大发展潜力的治疗策略。然而,目前实验性或临床试验并没有出现令人满意的疗效[1- 3]。作为T细胞群体的一类,γδ T细胞独特的抗原识别模式及其广谱的肿瘤杀伤活性,使γδ T细胞作为候选免疫过继细胞已受到人们的关注。但由于γδ T细胞仅占外周血CD3+T细胞的较少比例(lt;10%),尤其是中晚期肿瘤患者或化疗后患者体内免疫抑制,导致种子细胞数量减少和免疫活性下降,致使体外扩增细胞数量受限,难以达到治疗所需量的细胞制剂。因此,获取充足数量、安全且有良好生物学功能的γδ T细胞是开展γδ T细胞过继免疫治疗的瓶颈问题。
前期在γδ T细胞抗原识别机制的研究过程中,筛选到了一些特异识别肿瘤细胞的TCRγδ CDR3δ优势序列如OT3和OT10等,并通过合成的OT3或OT10肽及OT3-或OT10-移植抗体[4- 5]证明其对肿瘤细胞的识别和杀伤作用。本研究拟利用已建立的转染mRNA的技术平台,将全长 9链及肿瘤反应性CDR3移植的和 2链mRNA共转染到抗CD3抗体刺激的PBMC中,建立基于γδ TCR抗原识别机制的新型基因工程γδ TCR表达细胞,进而检测其抗肿瘤作用。为γδT细胞过继免疫治疗肿瘤提供新的方法和策略。
1 材料与方法
1.1 细胞系及菌株
SKOV3,人类卵巢浆液性乳头状囊腺癌细胞系(中国医学科学院基础医学研究所细胞中心),以含10%胎牛血清(FCS)的McCoy 5A培养基进行贴壁培养;HO8910,人卵巢浆液性囊腺癌细胞系(本研究室自存),以含10% FCS 的RPMI-1640培养基进行贴壁培养;HeLa,人宫颈癌肿瘤细胞系(本研究室自存),以含10% FCS的DMEM高糖培养基进行贴壁培养。大肠杆菌DH5α为本室保存,基因型为supE44lacU169(80lacZM15)hsdR17recA1end1gyr96thi-1relA1, 用于质粒的扩增与转化。
1.2 其他材料与试剂
pcDNA3.1-δ2(OT3)和pcDNA3.1-δ2(OT10)分别插入CDR3区为OT3和OT10序列替代全长δ2链的重组质粒;pcDNA3.1-γ9为含全长γ9链基因的重组质粒(中国医学科学院基础医学研究所郗雪燕博士构建,现本研究室保存);pGEM4Z/EGFP/A64用于体外转录RNA(布鲁塞尔自由大学Joeri L.Aerts教授惠赠);DNA片段纯化试剂盒(Axygen公司);The mMESSAGE mMACHINE High Yield Capped RNA Transcription Kit(Ambion公司);MinElute Reaction Cleanup 回收试剂盒和RNasey Mini Kit试剂盒(Qiagen公司);人TNF-α和IFN-γ ELISA检测试剂盒(BD公司);扩增用TCRγδ抗体、CD3抗体和FITC标记的抗γδ抗体(Immunotech公司);APC标记的抗CD3 抗体及同型对照抗体(Biolegend公司);封闭用抗TCRγδ的抗体(B1.1)(eBioscience公司);HRP酶标羊抗鼠二抗(中山公司);Pfu DNA聚合酶和T4DNA连接酶(Fermentas公司); Oligo(dT)15Primer、RNA酶抑制剂和dNTP(Promega公司);DNA分子量标准DL2000(大连宝生物工程有限公司);KpnⅠ和XhoⅠ等限制性内切酶(NEB公司);MTT和DMSO(盈信阳光生物科技有限公司);琼脂糖(Promega公司);胰蛋白胨、酵母提取物、琼脂粉和氨苄青霉素等(国产优级纯或分析纯试剂);IPTG、X-gal、G418和Hygromycin(Merck公司);细胞裂解液、淋巴细胞分离液(TBD公司);RPMI-1640、OPTI-MEM 和DMEM高糖培养基(Gibco公司)。
1.3 引物
用于扩增γδTCR 的全长γ链和δ链基因的引物由北京擎科公司合成(表1)。

表1 用于扩增γδTCR的全长γ链和δ链基因的引物
1.4TCR的γ9链和移植CDR3-δ2链全长基因的扩增和纯化
分别以pcDNA3.1-γ9、pcDNA3.1-δ2(OT3)、pcDNA3.1-δ2(OT10)质粒为模板,PCR扩增TCRγ链、TCRδ2(OT3)链和TCRδ2(OT10)链全长基因。
反应体系如下:质粒模板1 μL,引物(γ-up和γ-down或CDR3δ2-up和CDR3δ2-down)各1 μL,10×缓冲液5 μL,dNTP(2.5 mmol/L)4 μL,pfu酶(1×106U/L)1 μL,去离子水补足至50 μL;PCR参数:95 ℃变性5 min后,再以94 ℃ 30 s,61 ℃ 45 s,72 ℃ 70 s,共30个循环,最后72 ℃延伸10 min。反应结束后取5 μL反应产物进行1%琼脂糖凝胶电泳分析。
PCR产物按照Axygen公司DNA纯化试剂盒的说明进行层析柱离心纯化。简言之,将含有目的DNA片段的琼脂糖凝胶放置在1.5 mL离心管中,加3倍体积的缓冲液DE-A, 涡旋混匀,75 ℃水浴加热直至凝胶完全溶解,加1.5倍体积的DE-B缓冲液;混合后加入柱子上,12 000×g离心1 min,弃离出液;分别用500 μL缓冲液W1和700 μL缓冲液W2洗柱子1次和2次,每次12 000×g离心1 min,弃离出液;最后将柱子转移到一个新的1.5 mL离心管上,加入25 μL去离子水静置1 min,12 000×g离心1 min,收集离出液,于-20 ℃保存。
1.5重组质粒pGEM4Z/γ9/A64、pGEM4Z/δ2(OT3)/A64和pGEM4Z/δ2(OT10)/A64的构建及鉴定
KpnⅠ和XbaⅠ双酶切PCR扩增TCRγ9链、TCR/δ2(OT3)链和TCR/δ2(OT10)链全长基因及pGEM4Z/EGFP/A64。取3 μL 10×酶切反应缓冲液,20 μL PCR产物或1 μg质粒,0.8 μLKpnⅠ酶,0.4 μLXhoⅠ酶,0.3 μL 100×BSA补ddH2O至总体积为30 μL。37 ℃酶切2 h或3 h,用回收PCR产物的方法回收酶切片段。1 μL 10×连接反应缓冲液,7 μL酶切后PCR产物,1 μL酶切后的载体,1 μL T4DNA连接酶,总反应体积为10 μL。充分混匀并离心使其沉于管底,4 ℃连接过夜,分别构建成重组质粒pGEM4Z/γ9/A64、pGEM4Z/δ2(OT3)/A64和pGEM4Z/ δ2(OT10) /A64。
将上述重组质粒按常规方法转化DH5α感受态菌,于含有氨卞青霉素的LB固体培养基上37 ℃培养过夜,此时菌落直径约为1~2 mm。阳性重组质粒DNA经KpnⅠ和XhoⅠ双酶切及1%琼脂糖凝胶电泳鉴定含有重组DNA插入片段者,由诺塞生物技术公司行序列测定。用DNAMAN软件分析测序结果。
1.6 γ9δ2(OT3)T和γ9δ2(OT10)T细胞的构建
1.6.1 全长TCRγ9、TCRδ2(OT3)及TCRδ2(OT10)mRNA的体外合成及其纯化:严格按照Ambion公司mRNA的体外合成及纯化试剂盒(mMESSAGE mMACHINE High Yield Capped RNA Transcription Kit)操作说明进行。每个反应取线性化重组质粒1 μg,在20 μL体系中进行RNA合成。用RNeasy Mini柱子进行纯化。根据260 nm的吸光度值(A260),按照公式A260×稀释倍数×40(μg/mL)计算RNA的量。分装,-80 ℃保存备用。
1.6.2 TCRγ9分别和TCRδ2(OT1)、TCRδ2(OT3)及TCRδ2(OT10)mRNA的共转染:从正常人(已取得知情同意)外周血中密度梯度离心分离PBMC,收集经抗CD3抗体刺激培养4 d的正常人外周血单个核细胞(PBMC),用OPTI-MEM洗细胞1次。用OPTI-MEM重悬细胞至终浓度2.5×107/mL。冰上放置5 min。将TCRγ9 RNA 5 μg分别与TCRδ2(OT3)或TCRδ2(OT10) 5 μg混合,然后同200 μL细胞一起移入电转杯,并置入电转仪中,进行电转。根据前期优化的电转条件,电转参数为500 V,500 μs。电转完毕后,立即移入含RPMI-1640完全培养基的6孔板中继续培养。
1.7 转染细胞的筛选与功能鉴定
1.7.1 流式细胞术检测转染细胞γδTCR的表达:收集待测共转染细胞,配制成1×106/mL的细胞悬液。PBS洗涤3次,吸尽上清后,加入FITC标记的抗TCRγδ单克隆抗体5 μL,4 ℃孵育30 min。离心并用PBS(含1%牛血清白蛋白)洗涤3次,吸尽上清后加入500 μL的1%多聚甲醛固定液,用流式细胞仪进行分析。同型对照采用FITC标记的同型对照抗体。阳性转染T细胞分别称为γ9δ2(OT3)T或γ9δ2(OT10)T细胞。
1.7.2 ELISA检测细胞因子:用80 μg/每孔自制SKOV3细胞总蛋白包被24孔板中,37 ℃孵育2 h,然后加入1×106个γ9δ2(OT3)T或γ9δ2(OT10)T细胞,以转染EGFPmRNA的细胞为对照;37 ℃孵育24 h后,收集上清,按照说明书,用人TNF-α和IFN-γ ELISA检测试剂盒,检测各组细胞TNF-α及IFN-γ的表达。
1.7.3 转染细胞对肿瘤细胞的杀伤实验:分别以SKOV3、HeLa和HO8910等肿瘤细胞系作为靶细胞,用相应的培养液洗涤2次后,调整细胞浓度为1×105/mL,以100 μL/孔加入96孔板中,置于37 ℃、5% CO2培养,待细胞贴壁后即可用于杀伤实验。
以转染并表达γ9δ2(OT1)TCR、γ9δ2(OT3)TCR和γ9δ2(OT10)TCR的细胞为效应细胞,调整细胞浓度,使效靶比分别为1∶1、5∶1和10∶1, 将各组效应细胞分别加入各靶细胞孔内,每组3个平行孔。此外,设立只加靶细胞或效应细胞或只加入培养液的对照孔。
MTT法检测杀伤活性。将混合后的反应体系置于37 ℃、5% CO2培养12 h后,每孔吸去100 μL上清,加入10 μL MTT,继续孵育。8 h后,每孔加入100 μL DMSO,孵育4 h,于测定波长570 nm,参考波长630 nm处测定吸光度(A),并按下列公式计算杀伤活性:
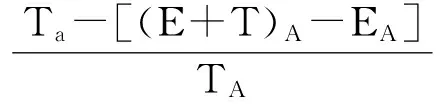
其中,TA指的是单加靶细胞的A值;EA为单加效应细胞的A值;(E+T)A代表效应细胞和靶细胞混合孔的A值。
1.8 统计学分析
2 结果
2.1卵巢癌反应性γδTCRpGEM4Z/γ9/A64质粒及pGEM4Z/δ2(OT3)/A64重组质粒的构建与酶切鉴定
以pcDNA3.1-9和pcDNA3.1-δ2(OT3)质粒为模板,PCR扩增出含KpnⅠ和XbaⅠ酶切位点的TCRγ9和TCRδ2 (OT3)全长基因,电泳鉴定如图1A,扩增产物长度与预测长度一致;重组pGEM4Z/γ9/A64质粒和pGEM4Z/δ2(OT3)/A64酶切后电泳鉴定结果如图1B,阳性克隆测序结果与预期序列一致。
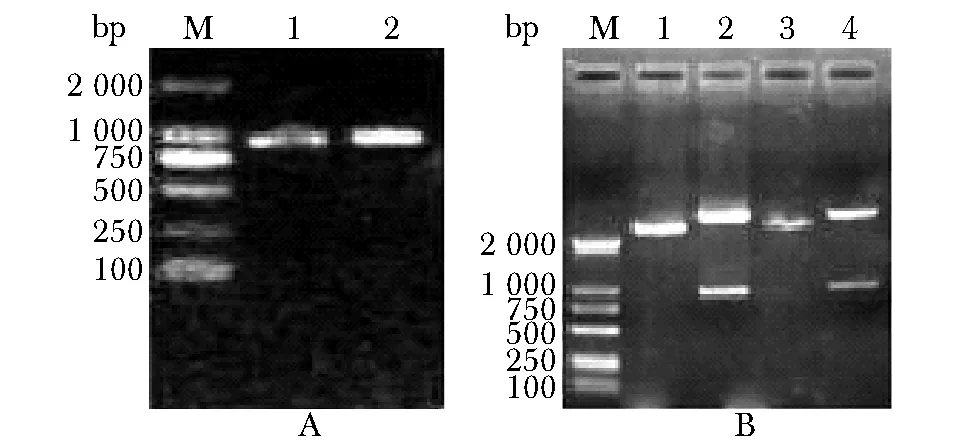
A:M.marker, 1.the PCR production of TCRγ9, 2.TCRδ2(OT3); B:M.marker; 1.pGEM4Z/γ9/A64 plasmid, 2.pGEM4Z/γ9/A64 plasmid digested by XbaⅠand KpnⅠ, 3.pGEM4Z/δ2(OT3)/A64 plasmid, 4.pGEM4Z/δ2(OT3)/A64 plasmid digested by Xba Ⅰ and KpnⅠ图1 重组质粒pGEM4Z/γ9/A64和pGEM4Z/δ2(OT3)/A64的酶切鉴定Fig 1 The identification of the recombinant plasmid of pGEM4Z/γ9/A64 and pGEM4Z/δ2(OT3)/A64 digested by Xba Ⅰ and Kpn Ⅰ
2.2卵巢癌反应性pGEM4Z/δ2(OT10)/A64重组质粒的酶切鉴定
以pcDNA3.1-δ2(OT10)质粒为模板,PCR扩增出含KpnⅠ和XbaⅠ酶切位点的含有OT10序列的TCRδ2全长基因,电泳鉴定结果如图2A;连接同样酶切的pGEM4Z/A64载体,构成重组质粒pGEM4Z/δ2 (OT10)/A64,酶切产物经电泳鉴定(图2B),阳性克隆测序结果与预期序列一致。

A:M.DNA marker; 1.the PCR production of OT10-grafted TCRδ2 chain;B:M.DNA marker; 1.pGEM4Z/δ2(OT10)/A64 digested by XbaⅠand KpnⅠ图2 移植OT10结构域序列的TCRδ2链的克隆鉴定Fig 2 The idenfication of TCRδ2 chain containing OT10 sequence in CDR3 region
2.3体外合成全长TCRγ9、TCRδ2(OT3)及TCRδ2(OT10)mRNA
每个体外合成mRNA反应的产量不尽相同,在12 μg/反应~15 μg/反应之间。上述3个基因各进行3次合成反应,分别得到40 μg TCRγ9 mRNA、38 μg TCRδ2(OT3)及36 μg TCRδ2(OT10)的mRNA。
2.4 流式细胞术检测转染细胞TCRγδ的表达
通过流式细胞术分别检测TCRδ2(OT3)及TCRδ2(OT10)mRNA电转细胞[分别命名为γ9δ2(OT3) T细胞和γ9δ2(OT10)T细胞]表面γδTCR的表达均在20%左右。其中20.6%~22.8%的γ9δ2(OT3)T细胞表面表达γδTCR,19.7%~21.6%的γ9δ2(OT10)T细胞表面表达γδTCR。图3显示一份PBMC所得结果。
2.5SKOV3总蛋白与γ9δ2(OT3)T或γ9δ2(OT10)T细胞共孵育后TNF-α的表达
ELISA检测SKOV3总蛋白刺激后,γ9δ2(OT3)T或γ9δ2(OT10)T细胞及对照细胞分泌TNF-α情况见图4,γ9δ2(OT3)T(A)或γ9δ2(OT10)T(B)细胞上清中的TNF-α分泌水平虽高于对照细胞与SKOV3蛋白孵育后的细胞上清,但是只有来自第3个志愿者的PBMC与转染所得γ9δ2(OT3)T和γ9δ2(OT10)T细胞明显高于对照细胞(Plt;0.05)。
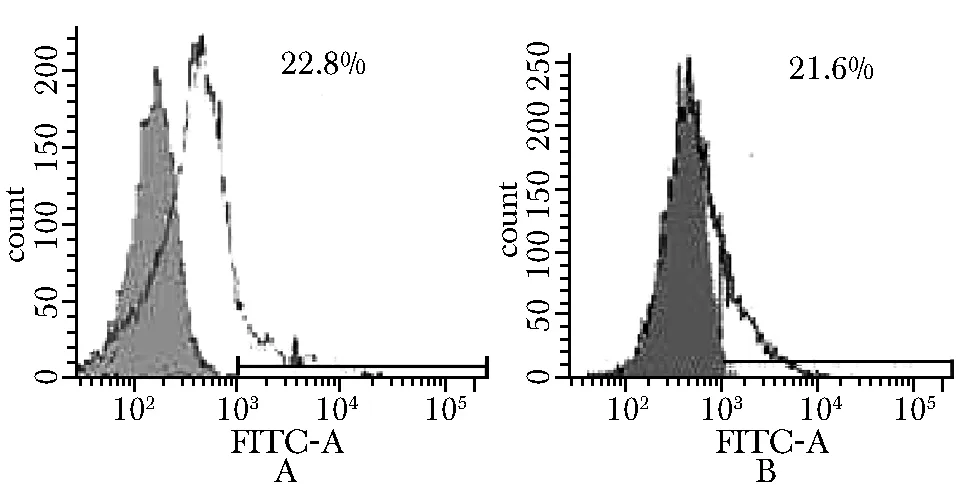
A.TCR expression of γ9δ2(OT3)T cells; B.TCR expression of γ9δ2(OT10)T cells图3 转染细胞TCRγδ的表达Fig 3 TCRγδ expression on transfectant T cells
2.6SKOV3总蛋白与γ9δ2(OT3)T或γ9δ2(OT10)T细胞共孵育后IFN-γ的表达
ELISA检测SKOV3总蛋白刺激后,γ9δ2(OT3)T或γ9δ2(OT10)T细胞及对照细胞分泌IFN-γ。如图5,3个志愿者的PBMC转染所得γ9δ2(OT3)T(A)或γ9δ2(OT10)T(B)细胞上清中的IFN-γ分泌水平均明显高于对照细胞与SKOV3蛋白孵育后的细胞上清(Plt;0.05)。
2.7γ9δ2(OT3)T或γ9δ2(OT10)T细胞对多种肿瘤细胞具有杀伤活性
相对于转染了EGFPmRNA的细胞,γ9δ2(OT3)T(图6A)或γ9δ2(OT10)T(图6B)细胞对多种肿瘤细胞的杀伤活性明显增高(Plt;0.05)。而且,随着效靶比的增高,γ9δ2(OT3)T或γ9δ2(OT10)T细胞对肿瘤细胞的杀伤能力也增强,呈一定的量效关系。
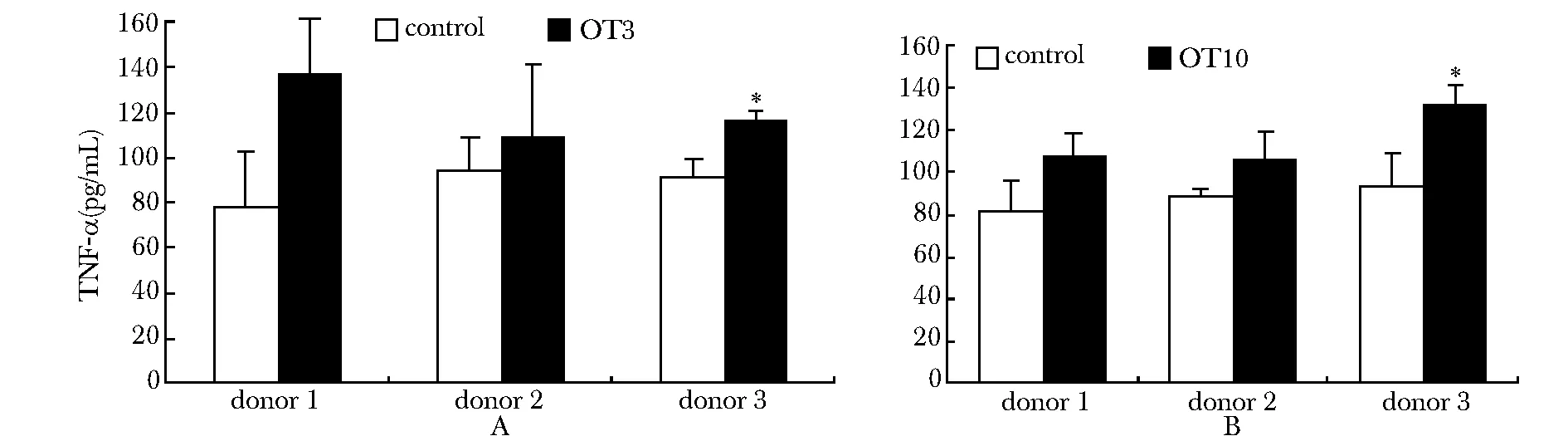
*Plt;0.05 compared with control group图4 ELISA分析γ9δ2(OT3)T细胞(A)或γ9δ2(OT10)T细胞(B)在SKOV3细胞总蛋白刺激后TNF-α的表达
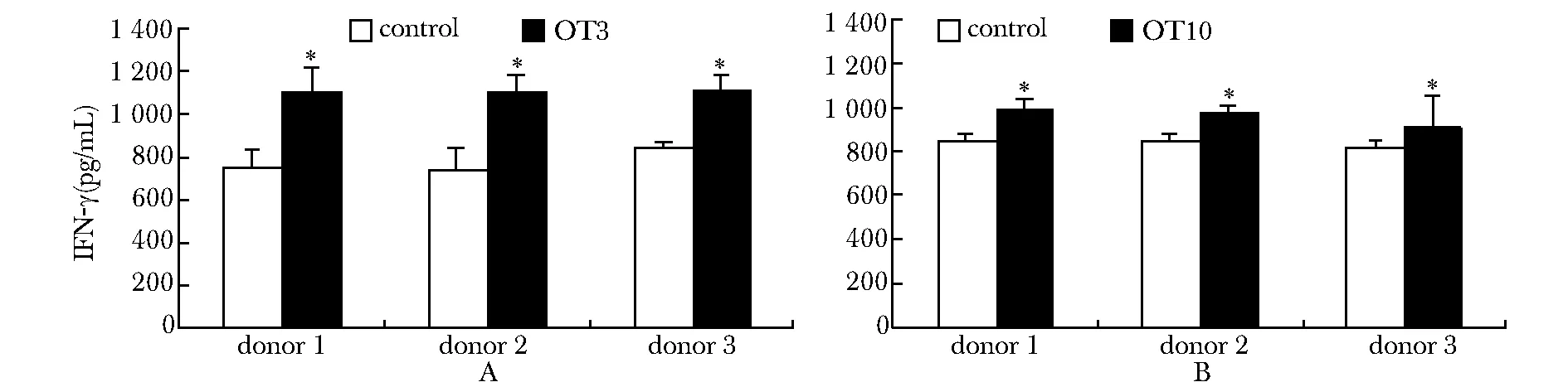
*Plt;0.05 compared with control group图5 ELISA分析γ9δ2(OT3)T细胞(A)或γ9δ2(OT10)T细胞(B)在SKOV3细胞总蛋白刺激后IFN-γ的表达
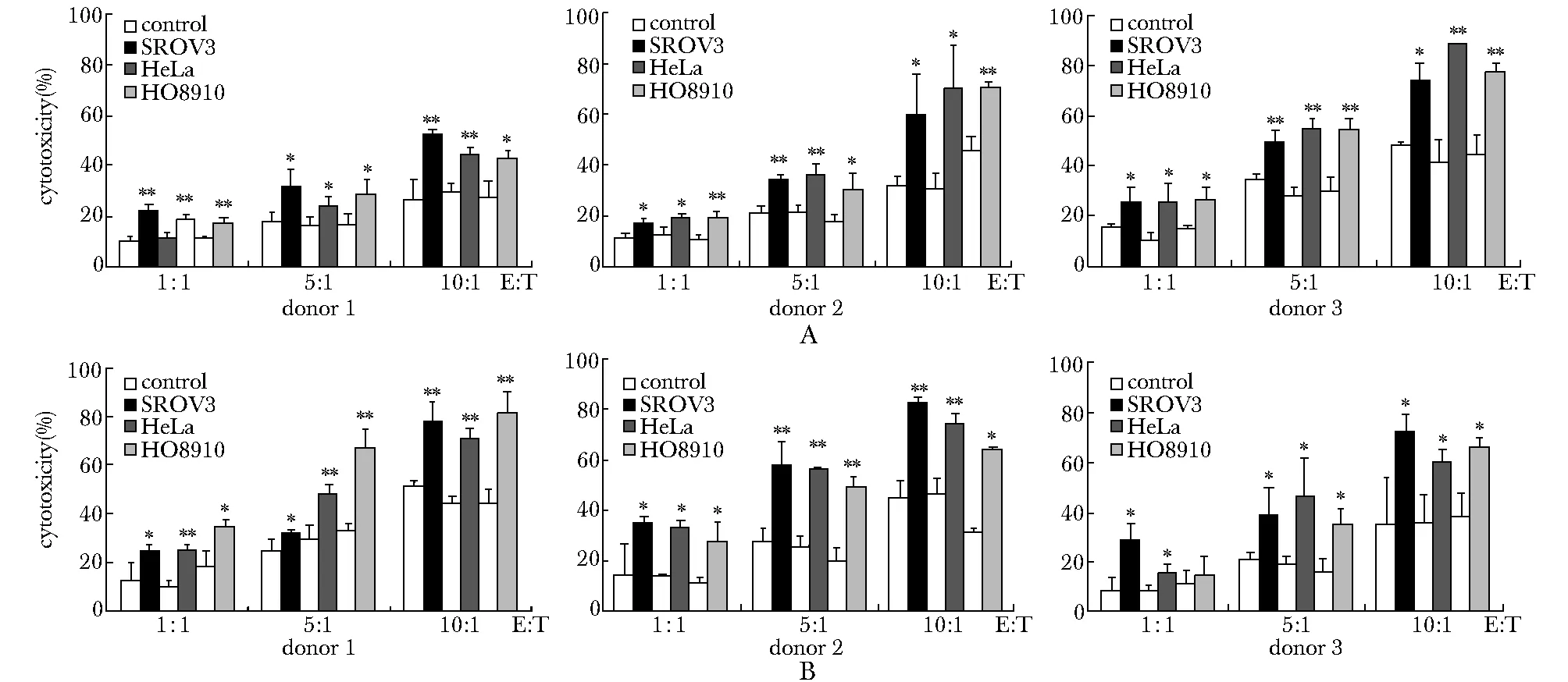
A.γ9δ2(OT3)T cells; B.γ9δ2(OT10)T cells; *Plt;0.05, **Plt;0.01 compared with control图6 γ9δ2(OT3)T和γ9δ2(OT10)T细胞对不同肿瘤细胞的杀伤效应Fig 6 The cytotoxicity of the γ9δ2(OT3)T cells or γ9δ2(OT10)T cells to various tumor cell lines
3 讨论
γδT细胞独特的抗原识别模式及其广谱的肿瘤杀伤活性,使γδT细胞作为候选免疫过继细胞已受到人们的关注和重视。由于γδT细胞仅占外周血CD3+T细胞的较少比例(lt;10%),尤其是中晚期肿瘤患者或化疗后患者体内免疫抑制,导致种子细胞数量减少和免疫活性下降,致使体外扩增γδT细胞数量受限已成为开展γδT细胞过继免疫治疗的瓶颈问题。建立一种新的细胞制备技术势在必行。
应用基因修饰方法构建表达针对肿瘤抗原的基因修饰的T淋巴细用于治疗肿瘤的研究早已见报道[6- 7]。在γδT细胞抗原识别机制的研究过程中,通过基因扫描和序列测定,筛选到了一些特异识别肿瘤细胞的TCRγδ CDR3δ优势序列如OT3和OT10等,并通过合成的OT3或OT10肽及OT3-或OT10-移植抗体[8]证明其对肿瘤细胞的识别和杀伤作用。本研究利用前期已经建立的体外转录及电转mRNA的基因工程技术,成功地将肿瘤反应性CDR3(OT3或OT10)移植γδTCR 的mRNA转染至抗CD3抗体刺激的PBMC,重塑细胞,制备了表达外源TCRγ9δ2(OT3)或TCRγ9δ2(T10)T细胞。阳性率均在20%左右。分选后所获的基因修饰TCRγ9δ2 T细胞,分泌杀伤肿瘤的效应性细胞因子TNF-α和IFN-γ的能力提高,在体外对多种肿瘤细胞的杀伤作用显著增强。提示电转mRNA基因重塑细胞有可能为肿瘤细胞过继治疗制剂的制备提供新的技术方法。但实验结果显示,电转染所获γ9δ2(OT3)T和γ9δ2(OT10)T细胞的百分率还不是很高(20%左右),这可能与γ9与δ2(OT3)或γ9与δ2(OT10)是两条mRNA共转染的转染率及其转染后的表达率不尽相同,导致细胞表面表达TCRγδ受限有关, 对于多基因的电转技术还有待进一步优化。
[1] Rosenberg SA, Yannelli JR, Yang JC,etal. Treatment of patients with metastatic melanoma with autologous tumor-infiltrating lymphocytes and interleukin 2 [J]. J Natl Cancer Inst, 1994, 86: 1159- 1166.
[2] Figlin RA, Thompson JA, Bukowski RM,etal. Multicenter, randomized, phase III trial of CD8+tumor-infiltrating lymphocytes in combination with recombinant interleukin-2 in metastatic renal cell carcinoma[J]. J Clin Oncol, 1999, 17: 2521- 2529.
[3] Dreno B, Nguyen JM, Khammari A,etal. Randomized trial of adoptive transfer of melanoma tumor-infiltrating lymphocytes as adjuvant therapy for stage III melanoma [J]. Cancer Immunol Immunother, 2002, 51: 539- 546.
[4] Xu C, Zhang H, Hu H,etal. γδ T cells recognize tumor cells via CDR3δ region [J]. Mol Immunol, 2007, 44: 302- 310.
[5] Wang Z, Zhang T, He W,etal. Targeting solid tumors via T cell receptor complementarity-determining region 3δ in an engineered antibody [J]. Cancer Letters, 2008, 272: 242- 252.
[6] Dudley ME, Wunderlich JR, Hughes MS,etal.Cancer regression in patients after transfer of genetically engineered lymphocytes [J].Science, 2006, 314:126- 129.
[7] van der Veken LT, Hagedoorn RS, van Loenen MM,etal. αβ T-cell receptor engineered γδ T cells mediate effective antileukemic reactivity[J]. Cancer Res, 2006, 66: 3331- 3337.
[8] Zheng J, Guo Y, Ji X,etal. A novel antibody-like TCRγδ-Ig fusion protein exhibits antitumor activity against human ovarian carcinoma [J]. Cancer Letters, 2013, 341: 150- 158.
The establishment of genetically CDR3δ2-modified γδ T lymphocytes and its functional characterization
HU Yu1#, ZHAO Hui1,2#, WANG Zhun1,HE Wei1*
(1.Dept. of Immunology, Institute of Basic Medical Sciences, CAMS amp; School of Basic Medicine, PUMC;State Key Laboratory ofMedical Molecular Biology, Beijing 100005; 2.National Institutes for Food and Drug Control, Beijing 100050,China)
ObjectiveTo explore the anti-tumor effect of genetically CDR3δ2-modified γδ T lymphocytes which were generated by co-transfection of the full-length γ9 mRNA and δ2 mRNA with tumor-reactive CDR3δ into anti-CD3 antibody stimulated human peripheral blood mononuclear cells (PBMC).MethodsBy PCR, specific δ2 sequences containing tumor-reactive CDR3δ2 (OT3 and OT10) and γ9 chain were amplified to make recombinant plasmids pGEM4Z/δ2 (OT3)/A64, pGEM4Z/δ2 (OT10)/A64 and pGEM4Z/γ9/A64. Linearized plasmids were used as templates for the synthesis of δ2(OT3), δ2(OT10) and γ9 mRNAsinvitro. Synthesized δ2(OT3) mRNA and δ2(OT10) mRNA were co-transfected with γ9mRNA respectively into anti-CD3 antibody stimulated human PBMC. Flow cytometry and sorting were performed to isolate γ9δ2(OT3) T cells and γ9δ2 (T10) T cells. MTT assay and ELISA were applied to detect the anti-tumor effect of these CDR3δ2 genetically modified γδ T lymphocytes.ResultsCDR3δ2 genetically modified γ9δ (OT3) T cells and γ9δ2(T10) T cells secreted high levels of IFN-γ and TNF-α and displayed significant cytotoxicity to a variety of tumor cells(Plt;0.05).ConclusionsThe generation of genetically modified tumor-reactive γ9δ2 T cells is an efficient approach to enhance the anti-tumor activity of lymphocytes, which provides a novel strategy for adoptive immunity against tumors.
T cell;CDR3δ2; γδTCR; adoptive immune therapy; OT3; OT10
2014- 03- 08
2014- 04- 12
国家高技术研究发展计划(863计划)(2012AA020901)
*通信作者(correspondingauthor):mianyi333@163.com
1001-6325(2014)06-0746-07
R392.12
A

