侵袭性乳腺癌GATA5基因启动子甲基化的临床意义
王 达,刘秋均,张雪梅,李宏江,李昌龙*
(四川大学 1.华西基础医学与法医学院 生物化学与分子生物学教研室; 2.华西医院 甲状腺乳腺外科, 四川 成都 610041)
研究论文
侵袭性乳腺癌GATA5基因启动子甲基化的临床意义
王 达1,刘秋均1,张雪梅1,李宏江2*,李昌龙1*
(四川大学 1.华西基础医学与法医学院 生物化学与分子生物学教研室; 2.华西医院 甲状腺乳腺外科, 四川 成都 610041)
目的探讨侵袭性乳腺癌(IBC)组织中GATA结合蛋白5(GATA5)基因启动子甲基化与mRNA表达的关系及其意义。方法用甲基化特异性PCR(MSP)技术检测62名患者的IBC及配对的癌旁正常组织(MNT)中GATA5基因启动子的甲基化状态。在其中48名患者的侵袭性乳腺癌(IBC)及配对的癌旁正常组织(MNT)中,用反转录实时荧光定量PCR(qRT-PCR)检测GATA5 mRNA的表达。结果GATA5基因在IBC中的甲基化率为48.4%(30/62) (Plt;0.001),MNT中为非甲基化。IBC中GATA5 mRNA表达水平显著低于MNT (Plt;0.001)。相比于MNT,甲基化的IBC中GATA5基因具有显著降低的mRNA表达(Plt;0.001)。同时GATA5基因在甲基化的IBC组中比在非甲基化的IBC组中具有显著降低的表达倍数变化值(Plt;0.05)。结论GATA5基因启动子甲基化很可能引起其转录失活,与IBC的发生、发展密切相关。
侵袭性乳腺癌; 甲基化; mRNA表达;GATA5
乳腺癌是我国女性最常见的恶性肿瘤,其发病率和死亡率分别约为43.19/100 000和9.31/100 000,且均呈逐年上升趋势[1]。乳腺癌的发病机制尚未完全阐明,但表观遗传修饰的改变被广泛认为是其发生的一种早期事件和重要标志之一[2]。启动子区域CpG岛的高甲基化能够引起与癌症相关的抑癌基因、DNA修复基因、细胞周期调控基因及转录因子基因失活[2],很可能促进癌症的发生和发展, 已成为当今研究肿瘤发病分子机制的热点[3]。最近研究表明GATA5基因可能是潜在的抑癌基因,同时其启动子甲基化与多种癌症发生密切相关,其中包括导管乳腺癌[4]。据此, 探测在侵袭性乳腺癌(invasive breast cancers, IBC)及配对的癌旁正常组织(matched normal tissues, MNT)中GATA5基因启动子的甲基化状态及mRNA的表达水平,分析两者关系及意义,为GATA5基因在侵袭性乳腺癌中发挥作用的分子机制提供新的依据。
1 材料与方法
1.1 试剂(盒)及来源
基因组DNA提取试剂盒(天根公司),RNA提取试剂盒Trizol、琼脂糖试剂(Invitrogen公司),EZ DNA甲基化试剂盒-Gold(Zymo Research公司),CpG甲基转移酶试剂盒(NEB公司),PCR试剂盒、反转录试剂盒、qRT-PCR试剂盒(TaKaRa公司)。
1.2 标本来源
收集2011年至2012年期间在四川大学华西医院手术切除的未进行化疗或放疗等治疗的62名女性患者的IBC及MNT标本,存于液态氮中。记录患者的临床病理特征,包括年龄、肿瘤大小、组织类型、淋巴结转移、ER 状态、PR状态、Ki-67状态、临床分期及CK5/6状态。本研究获得医院伦理委员会批准,并取得患者知情同意。
1.3 DNA和RNA提取
用基因组DNA提取试剂盒提取所有标本的基因组DNA。用Trizol提取48名患者组织中总RNA。凝胶电泳检测DNA和RNA的完整性,紫外分光光度仪检测它们的含量和纯度,在-80 ℃存储。
1.4 DNA甲基化修饰和MSP
用EZ DNA甲基化试剂盒-Gold对500 ng基因组DNA 进行亚硫酸氢钠处理和纯化, 洗脱的DNA放于-20 ℃冰箱保存备用。利用UCSC [UCSC assembly: Feb.2009(GRCh37/hg19)] 数据库,选取GATA5基因启动子的上游450个碱基(bases)和5′ 非翻译外显子区域(5′ UTR exons region)作为模板,对其设计2对引物(图1)。用MethPrimer设计MSP引物[5]。引物序列、退火温度及产物大小见表1。用PCR试剂盒进行甲基化(非甲基化)的MSP 扩增反应。PCR 反应条件: 95 ℃ 预变性1 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 45 s,35 个循环; 72 ℃延伸4 min。分别以CpG甲基转移酶处理的和未处理的健康人基因组DNA作甲基化阳性对照和非甲基化阳性对照,以ddH2O作阴性对照。MSP产物用3% 琼脂糖凝胶 (含0.1 g/L溴化乙锭) 电泳检测。
1.5 cDNA合成和qRT-PCR
用PrimeScript® RT reagent Kit With gDNA Eraser将1 μg总RNA进行反转录合成cDNA。GATA5基因和GAPDH基因的qRT-PCR引物序列、退火温度及产物大小见表1。反应体系为:2 μL稀释的cDNA, 5 μL SYBR® Premix Ex TaqTMⅡ (TliRNaseH Plus),上、下游引物(10 μmol/L)各0.4 μL, 去离子水补足至10 μL。反应条件: 95 ℃预变性30 s,95 ℃变性10 s, 60.6 ℃ 或 61.4 ℃复性10 s(表1),72 ℃延伸30 s,共40个循环反应,最后分析熔解曲线。用GAPDH为参照基因进行相对定量。
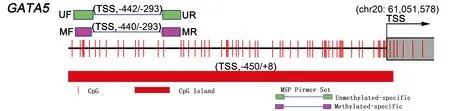
CpG sites and islands around the transcription start site (TSS) predicted by MethPrimer were shown, and the location of the primers for the methylated and the unmethylated condition was given in the picture

图1 MSP分析的GATA5基因启动子区域Fig 1 Promoter region of GATA5 analyzed by MSP
M.methylation; U.unmethylation; F.forward; R.reverse
1.6 统计学分析
计数资料参数之间的联系采用χ2检验或Fisher exact test,计量资料采用中位值和全距表示,组间比较采用非参数检验,运用SPSS19.0软件进行处理。
2 结果
2.1 GATA5基因甲基化状态
在IBC和MNT中GATA5基因启动子甲基化率分别为48.4%(30/62)和0%(0/62),IBC中甲基化率显著增高(Plt;0.001)。在IBC和MNT中GATA5基因启动子甲基化的代表性样本见图2。
2.2 甲基化与临床病理特征的相关性
GATA5基因启动子甲基化与年龄、肿瘤大小、组织类型、淋巴结转移和ER 状态等因素无关。
2.3 GATA5 mRNA的表达
MNT中GATA5 mRNA表达的平均值为651.8,中位值是33.3(全距:0到8477.0)。相对于MNT,在IBC中GATA5 mRNA表达的平均值为68.2,中位值是4.6(全距: 0 到 732.2)。同时,发现64.6%(31/48)IBC和77.1%(37/48)MNT表达GATA5,即在少部分IBC和/或MNT不表达GATA5。
用Wilcoxon符号秩和检验发现在IBC中GATA5 mRNA表达量显著低于MNT(Plt;0.001)(图3)。
根据报道[6],以2倍差异为阈值判断基因是否显著性差异表达。表达倍数变化(fold change)为-2或更小(将倍数变化值≤1的值用其倒数的负数表示)的标本定义为低表达,同时将表达倍数变化为2或更大的标本定义为高表达。GATA5基因在35.4%(17/48)IBC中低表达。
2.4 甲基化与mRNA表达之间的相关性
相比于MNT,甲基化的IBC组中GATA5基因在IBC中显著低表达(Plt;0.001),而非甲基化的IBC组中无统计学意义。同时GATA5基因在甲基化的IBC组中比在非甲基化的IBC组中具有较低的表达倍数变化值(Plt;0.05)。
2.5 mRNA表达与临床病理特征的相关性
相比于年龄≤49岁患者的IBC组,GATA5 mRNA表达倍数变化值(fold change)在年龄gt;49岁患者的IBC组中较小(Plt;0.01)。GATA5 mRNA表达倍数变化值(fold change)在CK5/6阴性的IBC 标本中较小 (Plt;0.05)。

U represents unmethylation and M represents methylation; positive controls are referred as Pos.C; H2O represents water control; L(DNA ladder) represents marker
图2代表性的5例IBC及MNT中GATA5基因启动子甲基化结果
Fig2RepresentativesamplesformethylationforGATA5in5pairsoftumor(T)andmatchednormal(N)tissues
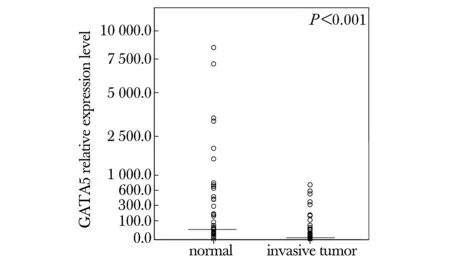
Expression of GATA5 was measured relative to the expression of GAPDH; we scaled the normalized expression for each gene by dividing the expression level of each sample by the lowest level of expression in all the samples; the software set the lowest level of expression to a value of 1, and rescaled all the sample expression levels; black horizontal bars represent median value for each group图3 在IBC和MNT中GATA5 mRNA的表达差异Fig 3 Difference in relative expression level of GATA5 in paired normal tissue versus invasive tumor
3 讨论
随着表观遗传学的进展,发现抑癌基因启动子区域的异常甲基化可以导致抑癌基因失活,是肿瘤形成和发展的一个促进因素,被认为是抑癌基因失活的一种重要机制[2,7]。
GATA5是转录因子GATA家族的成员(GATA1-6)之一,其在胚胎发育和成体发展中扮演各种各样的重要角色。GATA5基因启动子甲基化已经在多种癌症(包括导管乳腺癌)中被发现[4]。在肺癌、胃肠道癌和卵巢癌中发现启动子甲基化是导致GATA5基因失活的一种重要机制[8]。本研究结果显示,GATA5基因在IBC中的甲基化率显著高于MNT,说明在IBC中其启动子区域异常甲基化。qRT-PCR结果显示在IBC中GATA5 mRNA表达量显著降低。相比于MNT,甲基化的IBC组中GATA5基因在IBC中显示显著低表达。GATA5基因甲基化的IBC组比非甲基化的IBC组具有较低的表达倍数变化值。上述结果均表明在IBC中GATA5基因启动子甲基化可以导致其转录失活。GATA5基因启动子区域甲基化能够显著减少上游刺激因素1 (upstream stimulatory factor 1,USF1)的结合, 因而导致GATA5在癌症中表达减少[8]。GATA5基因mRNA表达倍数变化值在年龄gt;49岁患者的IBC组中较小,此结果表明年龄可能是影响GATA5 mRNA表达的一个重要的因素。
总之,本研究结果表明在IBC中GATA5基因启动子被异常高甲基化。实验数据首次表明GATA5基因启动子甲基化很可能是导致其转录失活的主要原因之一, 与IBC的发生、发展密切相关。
[1] Chen WQ, Zeng HM, Zheng RS,etal. Cancer incidence and mortality in China, 2007[J]. Chin J Cancer Res, 2012, 24: 1- 8.
[2] Jones PA, Baylin SB. The epigenomics of cancer[J]. Cell, 2007, 128: 683- 692.
[3] 赵蕊,严启滔,马文丽,等. 5-氮杂胞苷对结肠癌细胞CHD5基因表达及细胞增殖活性的影响[J]. 基础医学与临床,2013,8:976-980.
[4] Moelans CB, Verschuur-Maes AHJ, van Diest PJ. Frequent promoter hypermethylation of BRCA2, CDH13, MSH6, PAX5, PAX6 and WT1 in ductal carcinoma in situ and invasive breast cancer[J]. J Pathol, 2011, 225: 222- 231.
[5] Li LC, Dahiya R. MethPrimer: designing primers for methylation PCRs[J]. Bioinformatics, 2002, 18: 1427- 1431.
[6] Charafe-Jauffret E, Ginestier C, Monville F,etal. How to best classify breast cancer: conventional and novel classifications (review) [J]. Int J Oncol, 2005, 27: 1307- 1313.
[7] 李士谔. DNA甲基化、基因表达与肿瘤[J]. 基础医学与临床,1996, 16:321- 340.
[8] Chen BH, Hsu RN, Li ZP,etal. Upstream stimulatory factor 1 activates GATA5 expression through an E-box motif[J]. Biochem J, 2012, 446: 89- 98.
Promoter hypermethylation of GATA5 andits impact on clinical outcome of invasive breast cancer
WANG Da1, LIU Qiu-jun1, ZHANG Xue-mei1, LI Hong-jiang2*, LI Chang-long1*
(1.Dept. of Biochemistry and Molecular Biology, School of Preclinical and Forensic Medicine;2.Dept. of Thyroid and Breast Surgery, West China Hospital, Sichuan University, Chengdu 610041, China)
ObjectiveTo detect promoter methylation status and mRNA expression level ofGATA5 and to explore the relationship between methylation and mRNA expression by invasive breast cancers (IBC).MethodsPromoter methylation analysis ofGATA5 was performed by methylation-specific PCR (MSP) in IBC and matched normal tissues (MNT) from 62 patients. We examined expression profile ofGATA5 using quantitative real-time PCR analysis in 48 of 62 patients.ResultsMethylation ofGATA5 was only present in IBC[48.4% (30 of 62)] (Plt;0.001). mRNA expression ofGATA5 in IBC showed the lower level than that in MNT (Plt;0.001). ForGATA5, methylated IBC only showed significantly lower expression values compared to MNT (Plt;0.001). Tumors with methylatedGATA5 showed significantly less fold change ofGATA5 than tumors without methylation (Plt;0.05).ConclusionsMethylation ofGATA5 maybe is one important mechanism of the gene transcriptional inactivation, and is associated with the formation and development of IBC.
invasive breast cancers; methylation; mRNA expression;GATA5
2014- 02- 18
2014- 04- 12
国家自然科学基金 (81070452)
*通信作者(correspondingauthor):changlongli@scu.edu.cn
1001-6325(2014)06-0753-04
R 730.261
A

