AZD8055抑制肝癌huh7细胞增殖和促细胞凋亡
李 鹏,王亚红,杨拉维,杨 腾,何香红,黄海丽
(广东医学院 附属医院 临床医学研究中心, 广东 湛江 524001)
研究论文
AZD8055抑制肝癌huh7细胞增殖和促细胞凋亡
李 鹏,王亚红,杨拉维,杨 腾,何香红,黄海丽*
(广东医学院 附属医院 临床医学研究中心, 广东 湛江 524001)
目的探讨AZD8055对肝癌细胞增殖和克隆形成能力的影响及其分子机制。方法肝癌细胞系huh7随机分为对照组(DMSO)和加药组(AZD8055),MTT法检测huh7细胞增殖,平板克隆实验检测肝癌细胞克隆形成能力,AnexinV/FITC双染法检测细胞凋亡率,免疫印迹法检测AMPK蛋白表达和磷酸化水平。结果AZD8055抑制肝癌细胞的增殖呈浓度和时间依赖性(Plt;0.05)。AZD8055处理导致肝癌细胞克隆数目减少以及诱导细胞发生凋亡(Plt;0.05)。AZD8055处理引起AMPK蛋白磷酸化水平上升,但对总蛋白表达水平影响不大。AMPK蛋白抑制剂Dorsomorphin通过抑制AMPK蛋白磷酸化水平而降低AZD8055对肝癌细胞的抑制作用。结论AZD8055可以抑制肝癌细胞的增殖和克隆形成能力,并且主要通过调节AMPK蛋白的磷酸化水平实现其对增殖的抑制作用。
AZD8055;肝癌;AMPK;增殖
AZD8055 是一种特异有效的雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)激酶抑制剂,它可以有效抑制mTORC1和mTORC2的活性[1- 2]。AZD8055与丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)胞外信号调节激酶(又称AZD6224)协同作用,通过抑制MAPK和AKT/mTOR信号通路,从而提高非小细胞肺癌以及结肠直肠癌肿瘤细胞的凋亡率和生长抑制率[3]。AZD8055可以抑制乳腺癌细胞MCF7、骨肉瘤细胞U2OS、人恶性胶质母细胞瘤细胞U87MG的增殖。它主要通过抑制mTORC1和mTORC2的活性以及其下游的通路关键蛋白的活化实现对这些肿瘤细胞的抑制作用[4]。另外,还有研究表明,AZD8055对宫颈癌、急性淋巴白血病等肿瘤细胞均有抑制作用[2,5]。这些研究均显示了AZD8055作为化疗药物治疗肿瘤的潜力[6- 7]。
单磷酸腺苷活化蛋白激酶(AMP-activated protein kinase, AMPK)是一个细胞能量状态的生物感应器,已被证明对于肿瘤细胞的生长、代谢、凋亡和自噬具有调节作用[8]。AMPK对于肿瘤细胞具有双重调节作用。AMPK通过间接调节NADPH促进癌细胞的生存[9- 10]。AMPK还可以调控癌细胞代谢,并限制癌细胞生长[11]。另外,AMPK在已知的肿瘤抑制基因的上游和下游发挥作用[8,12]。由于AMPK信号通路在肿瘤生长代谢等方面具有重要作用,本研究在探讨AZD8055对肝癌细胞增殖抑制作用的分子机制时,将重点放在AMPK信号通路。
1 材料与方法
1.1 材料
1.1.1 细胞系:huh7细胞为本实验保存。
1.1.2 主要试剂:AZD8055(Selleck Chemicals公司),AMPK抑制剂(dorsomorphin)、噻唑盐MTT和二甲基亚砜(DMSO)(Sigma公司),兔抗人p-AMPK和兔抗人AMPK抗体(Cell Signaling Technology公司),兔抗人Actin(Santa Cruze Biotechnology公司),辣根过氧化物酶标记的羊抗兔IgG(武汉博士德生物),PVDF膜(Millipore公司),Annexin V-FITC/PI检测试剂盒(BD公司),RPMI-1640培养基,胎牛血清(Life technology公司),BCA蛋白定量试剂盒(碧云天生物公司)。
1.2 方法
1.2.1 细胞培养:将huh7细胞培养于含10% 胎牛血清1640 培养基内,37 ℃、5% CO2及饱和湿度条件下培养。
1.2.2 MTT实验:取对数增殖期细胞接种于96 孔板, 每孔200 μL浓度为1×107cells/L, 过夜培养等细胞贴壁后加入不同剂量梯度(5、10、20、50和100 nmol/L)和不同作用时间(12、24、36、48和72 h)的AZD8055试剂,对照组加入等体积的DMSO试剂,分别处理huh7细胞,每组设6个平行孔。实验终止前4 h,每孔加入20 μL MTT溶液(5 g/L),培养结束后小心吸弃孔内培养上清液,加入DMSO 150 μL,完全显色后,在酶联免疫检测仪上选择490 nm波长测定各孔光吸收值。按公式计算AZD8055对huh7细胞的生长抑制率(%)=(1-实验组A490值/对照组A490值)×100%
1.2.3 平板克隆形成实验:取对数生长期的huh7细胞,经0.25%胰蛋白酶消化后吹打成单个悬浮细胞,血球计数板计数后以每孔150个/mL细胞接种于6孔板中,每孔加入2 mL细胞悬液,每个平行设2个复孔,待细胞贴壁后,按照100 nmol/L AZD8055进行实验处理(DMSO组作为阴性对照组),置37 ℃、5% CO2及饱和湿度环境下,静置培养2周,当培养皿中出现肉眼可见的克隆时,终止培养,弃去上清液,用PBS小心漂洗2次,甲醇固定,然后进行结晶紫活细胞染色30 min,用流水缓慢漂洗去除染色液,自然风干。观察细胞克隆形成。此实验重复3次。
1.2.4 Annexin V-FITC/PI检测细胞凋亡:取对数生长期细胞接种于6孔板, 每孔2 mL浓度为2×108cells/L, 过夜培养等细胞贴壁后加入100 nmol/L的AZD8055,对照组加入等体积DMSO,分组处理huh7细胞24 h,收集细胞样品,PBS洗涤。按 Annexin V-FITC/PI试剂盒说明书处理细胞样品,上机检测。
1.2.5 Western blot检测p-AMPK、AMPK蛋白表达量的变化:取对数生长期huh7细胞接种于培养板,待细胞贴壁后,换含2%胎牛血清的1640培养基培养10~12 h,加入100 nmol/L AZD8055作用不同时间梯度(0、6、12和24 h),或预先加入AMPK抑制剂2 mmol/L dorsomorphin处理2 h再加入100 nmol/L AZD8055作用12 h,对照组加入等体积的二甲基亚砜(DMSO)。收集细胞,用预冷PBS洗涤1次,蛋白裂解液(RIPA)裂解细胞,离心收集上清液即为总蛋白溶液。BCA法测定蛋白含量,取等量蛋白进行SDS-PAGE电泳,电泳后将胶转移到聚偏二氟乙烯膜(PVDF)上,再将膜置于5%脱脂奶粉的TBST封闭液中封闭1 h,一抗孵育4 ℃过夜,TBST洗膜,用相应的辣根过氧化物酶标记的二抗常温孵育1 h,TBST 洗膜后,ECL显色发光检测相应条带。β-actin 作为内参照。所有实验至少重复3 次。
1.2.6 台盼蓝染色检测细胞活力:按照预定的实验分组进行实验处理,细胞消化成单细胞悬液,采用0.4%台盼蓝染色并细胞计数,死细胞为蓝紫色,活细胞为透明色,重复3次,取平均值,计算细胞活力抑制率。活细胞率(%)= 活细胞总数/(活细胞总数+死细胞总数)×100%
2 结果
2.1 AZD8055对huh7细胞增殖的抑制作用
AZD8055抑制huh7细胞的增殖并呈现明显的剂量和时间依赖性(图1)。
2.2AZD8055对huh7细胞克隆形成能力的影响
AZD8055抑制huh7细胞克隆形成能力(图2)。
2.3 AZD8055对huh7细胞凋亡的影响
和对照组相比,AZD8055(100 nmol/L)处理huh7细胞24和48 h后,凋亡率有明显上升,其中早期凋亡率分别达到13.0%和19.0%,晚期凋亡率分别达到15.6%和22.5%(Plt;0.05)(图3)。
2.4AZD8055抑制huh7细胞增殖通过激活AMPK活性
100 nmol/L AZD8055引起了AMPK蛋白磷酸化水平的升高并在24 h时达到最高水平(图4A),而预先加入AMPK抑制剂dorsomorphin处理 2 h再加入100 nmol/L AZD8055处理,减弱了AMPK蛋白磷酸化水平的升高(图4B)。台盼蓝染色检测细胞活力实验同样证实加入AMPK抑制剂dorsomorphin减弱了AZD8055对huh7细胞凋亡的影响(图4C)。

*Plt;0.05,**Plt;0.01 compared with control 图1 AZD8055对huh7细胞增殖的抑制作用Fig 1 The proliferation inhibition by AZD8055 on huh7 cells

*Plt;0.01 compared with control图2 AZD8055抑制huh7细胞克隆形成Fig 2 AZD8055 suppresses colony formation of huh7 cells
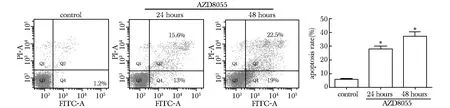
*Plt;0.05 compared with control 图3 流式细胞术检测细胞凋亡Fig 3 Apoptosis analyzed by flow cytometry

A.AZD8055 increased p-AMPK expression without changing AMPK expression; B.AMPK inhibitor dorsomorphin compromised AZD8055-induced up-regulation of p-AMPK; C.death rate of huh7 following different treatment; *Plt;0.05, **Plt;0.01 compared with control; #Plt;0.05 compared with or without dorsomorphin图4 AZD8055抑制huh7细胞增殖通过激活AMPK活性Fig 4 Role of AMPK activation in AZD8055-induced huh7 cells death
3 讨论
肝癌是中国死亡率最高的癌症之一。目前中国肝癌的治疗手段以手术为主,而不能手术的患者则以化疗为主。目前常用的化疗药物存在着易产生耐药性、肿瘤杀伤效率不高等局限,因此迫切需要开发新的有效药物治疗肝癌。
AZD8055是一种特异有效的mTOR抑制剂[1,4]。细胞和动物实验结果表明,它对于肺癌、乳腺癌、大肠癌和黑色素瘤等多种肿瘤细胞的增殖能力均有抑制作用[2- 3]。本实验主要研究其对肝癌细胞增殖、克隆形成能力的影响以及相关分子机制。本结果显示AZD8055可以抑制肝癌细胞的增殖能力,并且这种抑制作用具有时间和浓度依赖性。另外,AZD8055还可以抑制肝癌细胞的克隆形成能力,诱导肝癌细胞发生凋亡。因此推测AZD8055通过诱导肝癌细胞凋亡从而抑制其增殖。
单磷酸腺苷活化蛋白激酶(AMP-activated potein kinase,AMPK)具有细胞能量调节器的功能,当细胞经历代谢应激反应时(例如化疗药物的刺激),伴随着细胞内AMP水平或AMP与ATP的比例升高,AMPK被AMP激活,其活化的结果导致脂肪酸氧化的增加以产生更多ATP;同时抑制ATP消耗,帮助细胞度过急性损伤,暂时保障细胞的存活[9,13]。前人研究表明,AMPK通路对于化疗后肿瘤细胞的生存具有关键作用,它可以调节肿瘤细胞的代谢以及生长速度[14]。本研究发现AZD8055处理引起肝癌细胞激活AMPK信号通路,AMPK蛋白磷酸化水平升高。而抑制AMPK信号通路的激活则可部分扭转AZD8055对肝癌细胞的增殖抑制作用。这些结果表明AZD8055通过激活AMPK通路从而调节肝癌细胞的增殖。
综上所述,AZD8055可以抑制肝癌细胞的增殖和克隆形成能力,其对肝癌细胞的抑制作用主要是通过调节AMPK信号通路的活化来实现的。这为应用AZD8055治疗肝癌提供了理论依据。
[1] Pike KG, Malagu K, Hummersone MG,etal. Optimization of potent and selective dual mTORC1 and mTORC2 inhibitors: the discovery of AZD8055 and AZD2014[J]. Bioorg Med Chem Lett, 2013, 23: 1212- 1216.
[2] Willems L, Chapuis N, Puissant A,etal. The dual mTORC1 and mTORC2 inhibitor AZD8055 has anti-tumor activity in acute myeloid leukemia[J]. Leukemia, 2012, 26: 1195- 1202.
[3] Holt SV, Logie A, Davies BR,etal. Enhanced apoptosis and tumor growth suppression elicited by combination of MEK (selumetinib) and mTOR kinase inhibitors (AZD8055)[J]. Cancer Res, 2012, 72: 1804- 1813.
[4] Chresta CM, Davies BR, Hickson I,etal. AZD8055 is a potent, selective, and orally bioavailable ATP-competitive mammalian target of rapamycin kinase inhibitor withinvitroandinvivoantitumor activity[J]. Cancer Res, 2010, 70: 288- 298.
[5] Li S, Li Y, Hu R,etal. The mTOR inhibitor AZD8055 inhibits proliferation and glycolysis in cervical cancer cells[J]. Oncol Lett, 2013, 5: 717- 721.
[6] Asahina H, Nokihara H, Yamamoto N,etal. Safety and tolerability of AZD8055 in Japanese patients with advanced solid tumors; a dose-finding phase I study[J]. Invest New Drugs, 2013, 31: 677- 684.
[7] Houghton PJ, Gorlick R, Kolb EA,etal. Initial testing (stage 1) of the mTOR kinase inhibitor AZD8055 by the pediatric preclinical testing program[J]. Pediatr Blood Cancer, 2012, 58: 191- 199.
[8] Fruman DA, Edinger AL. Cancer therapy: staying current with AMPK[J]. Biochem J, 2008, 412: 3- 5.
[9] Jeon SM, Chandel NS, Hay N. AMPK regulates NADPH homeostasis to promote tumour cell survival during energy stress[J]. Nature, 2012, 485: 661- 665.
[10] She C, Zhu LQ, Zhen YF,etal. Activation of AMPK protects against hydrogen peroxide-induced osteoblast apoptosis through autophagy induction and NADPH maintenance: new implications for osteonecrosis treatment?[J]. Cell Signal, 2014, 26: 1- 8.
[11] Faubert B, Boily G, Izreig S,etal. AMPK is a negative regulator of the Warburg effect and suppresses tumor growthinvivo[J]. Cell Metab, 2013, 17: 113- 124.
[12] Han D, Li SJ, Zhu YT,etal. LKB1/AMPK/mTOR signaling pathway in non-small-cell lung cancer[J]. Asian Pac J Cancer Prev, 2013, 14: 4033- 4039.
[13] Chen L, Han F, Qu H,etal. Combination therapy with 5-amino-4-imidazolecarboxamide riboside and arsenic trioxide in acute myeloid leukemia cells involving AMPK/TSC2/mTOR pathway[J]. Pharmazie, 2013, 68: 117- 123.
[14] Storozhuk Y, Hopmans SN, Sanli T,etal. Metformin inhibits growth and enhances radiation response of non-small cell lung cancer (NSCLC) through ATM and AMPK[J]. Br J Cancer, 2013, 108: 2021- 2032.
AZD8055 inhibits proliferation andinduces apoptosis of hepatocellular carcinoma huh7 cells
LI Peng, WANG Ya-hong, YANG La-wei, YANG Teng, HE Xiang-hong, HUANG Hai-li*
(Clinical Research Center, Affiliated Hospital of Guangdong Medical College, Zhanjiang 524001, China)
ObjectiveTo investigate effects of AZD8055 on proliferation and colony formation of hepatocellular carcinoma cells.MethodsThe huh7 cells were divided into two groups: control group (DMSO) and AZD8055 group. MTT assay and colony formation assay were performed to detect effects of AZD8055 on proliferation and colony formation of hepatocellular carcinoma cells respectively. Apoptosis rate was assessed by performing AnexinV/FITC double staining. Western blot was performed to detect AMPK and p-AMPK expression.ResultsAZD8055 inhibited proliferation of huh7 cells in a time- and concentration-dependent manner (Plt;0.05). AZD8055 treatment reduced colony numbers of huh7 cells and induced apoptosis compared to those untreated cells (Plt;0.05). AZD8055 treatment increased p-AMPK expression but didn’t change AMPK expression. Blocking AMPK activation by using AMPK inhibitor Dorsomorphin partially reversed proliferation inhibition induced by AZD8055.ConclusionsAZD8055 inhibits proliferation and colony formation of huh7 cells through AMPK signaling pathway.
AZD8055; hepatocellular carcinoma; AMPK; proliferation
2013- 12- 24
2014- 03- 24
广东省自然科学基金博士启动项目(S2012040006537);广东医学院附属医院博士科研基金(BK201202);广东医学院博士启动项目(XB1224)
*通信作者(correspondingauthor):huanghaili2013@126.com
1001-6325(2014)06-0771-05
R73-36+2
A

