高表达Klotho基因对糖尿病大鼠肾脏保护作用的机制
张晓暄 杨晓春 远 航 程海涛 王 晶 宝 玲 (一汽总医院肾内科,吉林 长春 300)
糖尿病肾病(DN)是糖尿病微血管病变,一旦发展到终末期肾衰,往往比其他肾脏疾病治疗更加棘手〔1〕。Klotho基因是1997年发现的与衰老发生密切相关的功能性基因〔2〕,在人和大鼠的肾脏高表达,并主要定位于肾小管上皮细胞,在维持正常的肾脏生理功能方面发挥着重要作用。本课题组在前期研究中发现注射Klotho基因的糖尿病肾病模型大鼠,其肾脏病理改变有所好转,尿微量白蛋白减少,肾功能指标改善,表明Klotho基因对DN具有保护作用,但其机制尚不清楚。本研究拟探讨Klotho基因对DN肾脏保护作用的机制。
1 材料与方法
1.1 主要试剂 组织RNA提取试剂盒、反转录试剂盒、DNA marker,宝生物工程(大连)有限公司;免疫组化试剂盒、β-actin抗体,Abgent,美国;Klotho抗体、PAI-1抗体,北京博奥森生物技术有限公司;DMEM,Invitrogen,胎牛血清,Hyclon,美国;含Klotho基因的腺病毒,本课题组制备。
1.2 实验动物与分组 SPF级健康Wistar雄性大鼠72只,购自吉林大学动物中心,体重200~220 g。实验室适应性喂养1 w后,取18只大鼠为正常对照组(Con组),其余54只大鼠禁食 12 h,按照 55 mg/kg体重腹腔注射 STZ〔3〕,72 h 后血糖值≥16.67 mmol/L为糖尿病,2 w后检测大鼠尿微量白蛋白增高证明DN大鼠模型建立成功。Con组腹腔注射等体积的柠檬酸缓冲液。将54只DN大鼠随机分为DN组(腹腔注射STZ+静脉注射等体积生理盐水)、Ad组(腹腔注射STZ+静脉注射不含Klotho基因的腺病毒)、Klotho组(腹腔注射STZ+静脉注射含有Klotho基因的腺病毒),Con组静脉注射等体积生理盐水。从糖尿病模型建立成功后第2周开始,Klotho组尾静脉注射3×108PFU腺病毒,Ad组尾静脉注射3×108PFU不含Klotho基因的腺病毒,每2 w注射1次〔4〕,DN组和Con组尾静脉注射等体积生理盐水。四组均于第4、8、16周处死大鼠。
1.3 免疫组化检测Klotho、纤溶酶原激活物抑制剂(PAI)-1蛋白在糖尿病大鼠肾脏的表达 取糖尿病大鼠肾脏,经4%多聚甲醛固定、切片,2%BSA封闭后,滴加1∶500稀释的抗大鼠Klotho、PAI-1抗体,DAB显色。镜下观察 Klotho、PAI-1蛋白在肾小球、肾小管及肾间质的表达。以β-actin蛋白作为对照。
1.4 RT-PCR检测基因mRNA在肾组织的表达情况 取大鼠肾,应用RNA提取试剂盒提取肾脏RNA,RT-PCR扩增Klotho、转化生长因子(TGF)-β1、p15、p21、p27、PAI-1、β-actin 基因,引物:Klotho 正义:5'-TGGCTGAACCAAAAAAACAA-3',反义:5'-GAGCGGTCACTAAGCGAATA-3',扩增片段 434 bp;TGFβ1 正义:5'-ATGGTGGACCGCAACAAC-3', 反 义:5'-GAGCACTGAAGCGAAAGC-3',扩 增 片 段 328 bp;p15 正 义:5'-ATCCCAACGCCGTCAACC-3',反义:5'-TGGCCCTGCTCTTCAGCT-3',扩增片段 259 bp;p21 正义:5'-TACGTCTGGGAGCGTGTTC-3',反义:5'-AAATCTGTTAGGCTGGTCTGC-3,扩增片段 266 bp;p27正义:5'-AGCTTGCCCGAGTTCTACTA-3',反义:5'-CAGGTCGCTTCCTCATCC-3',扩增片段 220 bp;PAI-1 正义:5'-TACGACATCCTGGAACTGC-3',反义:5'-CACCTCGATCTTGACCTTTT-3',扩增片段 324 bp;β-actin 正义:5'-GGCCACCAACTTCGGAGTAA-3',反义:5'-TGTTCCATGACCCCATGAGC-3',扩增片段 210 bp。
PCR 反应条件94℃ 30 s,55℃ ~62℃ 30 s,72℃ 20 s,35 个循环,72℃ 7 min。PCR产物经琼脂糖凝胶电泳检测,凝胶成像系统照相,Quantity one图像分析软件进行灰度分析,以β-actin基因作为对照。
1.5 统计学分析 采用SPSS14.0统计软件,结果以s表示,两样本均数比较用t检验。
2 结果
2.1 免疫组化检测Klotho、PAI-1蛋白在糖尿病大鼠肾脏的表达与分布 与Con组相比,4、8、16 w时,DN组和Ad组大鼠肾小球、肾小管及肾间质内Klotho蛋白表达量减少,而Klotho组大鼠肾脏Klotho蛋白表达量变化不明显,与Con组接近(图1);与 Con组相比,DN组和 Ad组 PAI-1蛋白表达量增加,Klotho组的PAI-1蛋白表达量变化不明显,接近Con组(图2)。β-actin蛋白在不同时间各组的表达未见明显改变(图3)。
2.2 RT-PCR检测mRNA在肾组织的表达 琼脂糖凝胶电泳显示,Klotho、TGF-β1、p15、p21、p27、PAI-1 基因 PCR 产物与预期扩增产物大小一致。与Con组对比,在4、8、16 w时DN组和Ad组的Klotho mRNA表达量明显减少,Klotho组Klotho mRNA表达量变化不明显,但高于DN组和Ad组。DN组和Ad组TGF-β1、p15、p21、p27、PAI-1 mRNA 表达量明显高于 Con 组,Klotho组变化不明显,接近Con组,但低于DN组和Ad组。见图 4,图 5。
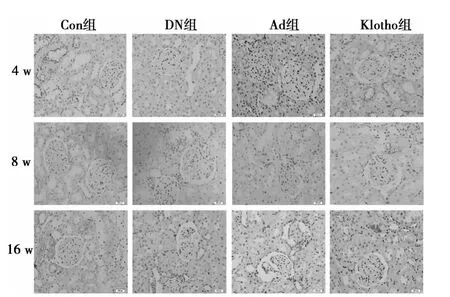
图1 糖尿病大鼠肾脏Klotho蛋白的表达与分布(×200)
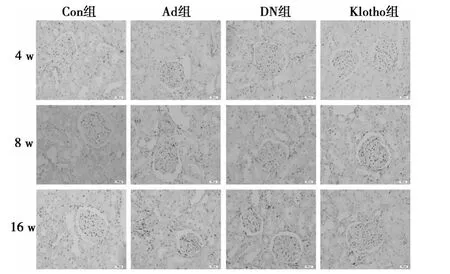
图2 糖尿病大鼠肾脏PAI-1蛋白的表达与分布(×200)
图3 糖尿病大鼠肾脏β-actin的表达与分布(×200)

图4 琼脂糖凝胶电泳显示各扩增产物条带
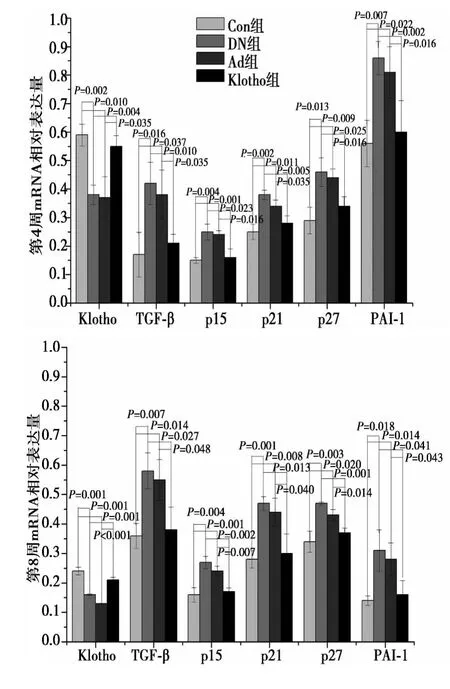
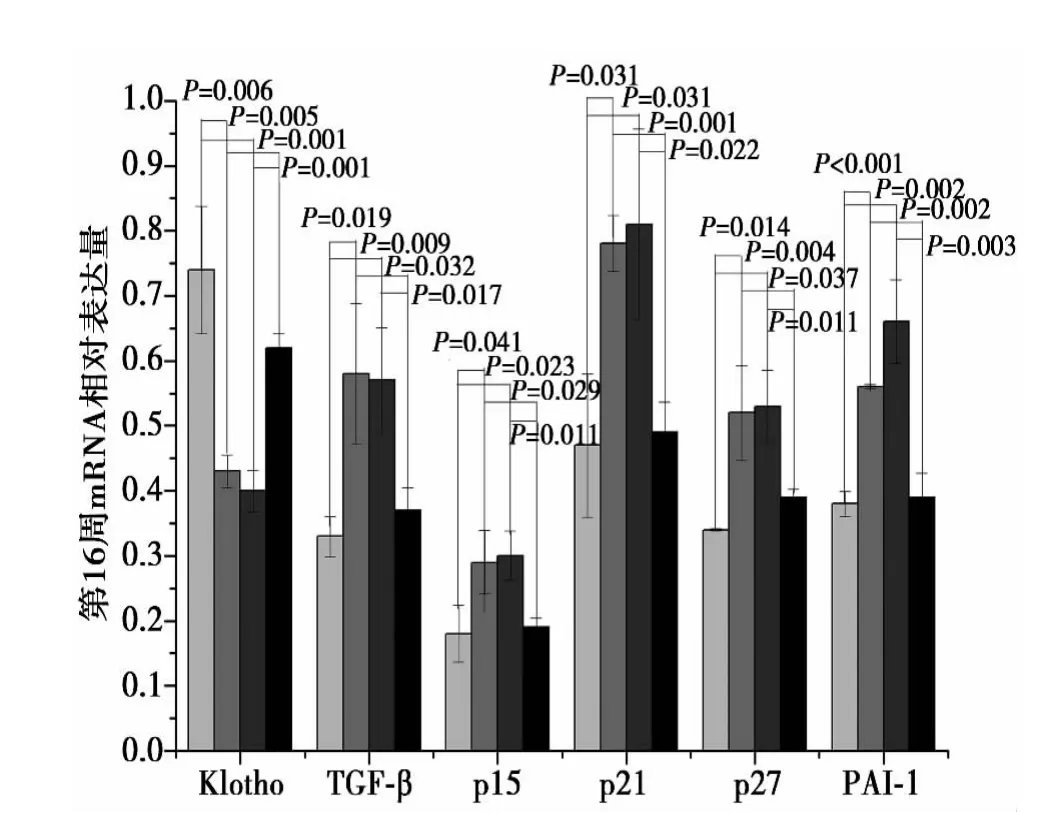
图5 第 4、8、16 周糖尿病大鼠肾脏 Klotho、TGF-β1、p15、p21、p27、PAI-1基因mRNA的表达
3 讨论
ECM进行性积聚是DN的主要病理表现,也是DN进行性发展的重要因素,TGF-β1是DN发生、发展的重要中介,PAI-1是其引起ECM积聚的环节之一。TGF-β1可显著上调大鼠系膜细胞PAI-1 mRNA和蛋白质的表达并抑制纤溶酶活性〔5〕。DN肾脏PAI-1表达明显上升,PAI-1通过与组织型纤溶酶原激活物形成复合体而抑制其活性,抑制ECM的降解,对促进DN时ECM 积聚有至关重要的作用〔6~8〕。TGF-β1 既可以直接刺激ECM的合成,又可以通过促进PAI-1等蛋白酶抑制物的表达,促进 ECM 的积聚〔9〕。
Klotho基因是新近发现的独立的抗衰老基因,通过抑制TGFβ1的信号传导,可以抑制肾脏纤维化〔10〕。Takeshita等〔11〕研究表明Klotho基因表达下调可能通过上调PAI-1 mRNA的表达参与肾脏纤维化的发生。
肾素-血管紧张素系统(RAS)参与了DN发展的全过程,糖尿病时肾脏局部血管紧张素Ⅱ(AngⅡ)水平增加导致血管收缩、肾小球内压力增高、肾小球系膜细胞及内皮细胞增生。活性增高的AngⅡ受体通过直接或间接诱导TGF-β1表达,刺激肾脏局部PAI-1的表达,促进肾小管间质成纤维细胞的增殖、分化。与本研究相似,有研究同样利用腺相关病毒作为载体,将转染Klotho基因到小鼠体内改善AngⅡ导致的肾脏损伤,转染组的肾功能改善、蛋白尿减少,肾小管、肾间质病理学改变减轻〔12〕。新近研究发现,在STZ诱导糖尿病小鼠动物模型中,抗衰老Klotho基因的缺失通过加强TGFβ1和mTOR信号表达,加速了早期DN的进展〔13〕。
本研究结果显示在DN大鼠模型的肾脏中,Klotho基因表达降低,TGF-β1、PAI-1的表达增高,经Klotho治疗后DN肾脏组织的Klotho基因表达增加,同时TGF-β1、PAI-1的表达显著下降,而无论DN未治疗组还是单纯腺病毒对照组均未见此种变化,提示Klotho基因可以下调TGF-β1的表达而减少 PAI-1的表达,缓解ECM积聚,延缓DN进展,从而保护DN大鼠肾脏功能。
DN早期肾脏肥大是其进展的始动因素之一,细胞周期调控蛋白是控制细胞生长的关键,与DN早期肾脏肥大密切相关〔14〕。p15、p21、p27是细胞周期素依赖性蛋白激酶抑制因子(CDKIs)家族的重要成员,是细胞周期的负调控因子,其中p15阻止细胞由G1期进入S期,从而抑制细胞的分裂增殖,p21基因可使细胞增殖所需的蛋白质磷酸化受阻,在细胞分化和凋亡中p21蛋白的表达增高,p27可阻止细胞通过G1/S期转化的限制点抑制细胞分裂增殖,使细胞周期停滞在G1期和S期的转换,使细胞有机会修复损坏的DNA或修复DNA复制过程中产生的错误〔15〕。
本研究表明Klotho基因通过下调细胞周期负调控蛋白p15、p21、p27的表达来保护DN大鼠肾脏功能。
综上所述,Klotho基因能够下调糖尿病大鼠肾脏TGF-β1、PAI-1、p15、p21、p27基因的表达,对糖尿病大鼠的肾脏具有保护作用,为临床上治疗糖尿病肾病提供新的干预治疗靶点和理论依据。
1 王 燕,赵 霞,范 斌,等.2型糖尿病血压控制与未来出现肾病终点的观察性研究〔J〕.首都医科大学学报,2012;33(4):472-6.
2 Wang Y,Sun Z.Current understanding of klotho〔J〕.Aging Res Rev,2009;8(1):43-51.
3 钟 媛,刘素筠.辛伐他汀与氯沙坦对1型糖尿病大鼠心肌组织Toll样受体4和核因子-κB表达的影响〔J〕.中国药物与临床,2012;12(8):1023-6.
4 王艳娇,马厚勋,李宝善,等.腺相关病毒介导的Klotho基因表达对去势大鼠骨Runx2及MMP-13表达的影响〔J〕.基础医学与临床,2012;32(5):487-92.
5 姜宗培,余学清,陈雄辉,等.转化生长因子β1对系膜细胞纤溶酶原激活物抑制物1表达的影响〔J〕.中华肾脏病杂志,2004;20(4):260-3.
6 Mariasegaram M,Tesch GH,Verhardt S,et al.Lefty antagonises TGF-β1 induced epithelial-mesenchymal transition in tubular epithelial cells〔J〕.Biochem Biophys Res Commun,2010;393(4):855-9.
7 Hinz B.Tissue stiffness,latent TGF-β1 activation,and mechanical signal transduction:implication for the pathogenesis and treatment of fibrosis〔J〕.Curr Rheumatol Rep,2009;11(2):120-6.
8 Wägsäter D,Zhu C,Björck HM,et al.Effects of PDGF-C and PGDF-D on monocyte migration and MMP-2 and MMP-9 expression〔J〕.Atherosclerosis,2009;202(2):415-23.
9 刘亚军,严钟德.TGF-β1、PAI-1与糖尿病肾病〔J〕.国外医学·泌尿系统分册,2000;20(3):107-8.
10 Doi S,Zou Y,Togao O,et al.Klotho inhibits transforming growth factorbeta1(TGF-beta1)signaling and suppresses renal fibrosis and cancer metastasis in mice〔J〕.J Biol Chem,2011;286(10):8655-65.
11 Takeshita K,Yamamoto K,Ito M,et al.Increased expression of plasminogen activator inhibitor-1 with fibrin deposition in a murine model of aging“klotho”mouse〔J〕. SeminThrombHemost,2002;28(6):545-54.
12 Mitani H,Ishizaka N,Aizawa T,et al.In vivo klotho genetransfer ameliorates angiotensinⅡ-induced renal damage〔J〕.Hypertension,2002;39(4):838-43.
13 Lin Y,Kuro-o M,Sun Z.Genetic deficiency of anti-aging gene klotho exacerbates early nephropathy in STZ-induced diabetes in male mice〔J〕.Endocrinology,2013;154(10):3855-63.
14 Wolf G.Cell cycle regulation in diabetic nephropathy〔J〕.Kidney Int(Suppl),2000;77:S59-66.
15 Hess CJ,Errami A,Berkhof J,et al.Concurrent methylation of promoters from tumor associated genes predicts outcome in acute meyloid leukemia〔J〕.Leuk Lymphoma,2008;49(6):1132-41.

