老年乙型肝炎患者血清可溶性肿瘤坏死因子相关凋亡诱导配体、可溶性血管细胞黏附分子-1、白细胞介素-18和-23的表达
杜梅英 姚 敏 魏小斌 巫翠云 (海口市人民医院检验科,海南 海口 570208)
乙型肝炎发病过程中,机体的免疫功能发挥重要作用,此时机体产生多种细胞因子,不仅促进疾病进展,还对机体内环境有重要影响〔1〕。可溶性肿瘤坏死因子相关凋亡诱导配体(sTRAIL)蛋白含有281个氨基酸残基,辅助因子为锌离子,在形成三聚体时生物活性最强,近年认为细胞坏死后可以产生较多的 sTRAIL〔2,3〕。可溶性血管细胞黏附分子(sVCAM)-1分布在体内血管内皮细胞、单核细胞、中性粒细胞表面,通过与相应配体结合,参与白细胞与血管内皮黏附,并参与向血管外渗透迁移的过程〔4,5〕。白细胞介素(IL)-18、-23是重要的炎性介质,近来关于IL家族与乙型肝炎的关系尤其受关注〔6,7〕。本实验分析乙型肝炎老年患者血清sTRAIL、sVCAM-1、IL-18和-23表达特征及其临床意义。
1 资料和方法
1.1 一般资料 我院确诊为乙型肝炎的老年患者165例为观察组,男90例,女75例。年龄60~81岁,平均69.7岁。排除标准:①有恶性肿瘤病史;②有风湿免疫性疾病;③近3个月有感染史。体检证实为健康的老年人90例为对照组,男45例,女45例,年龄60~70岁,平均64.3岁。两组一般临床资料无统计学差异(P>0.05)。
1.2 sTRAIL、sVCAM-1、IL-18和-23检测 观察组均在确诊后次日清晨抽取静脉血5 ml,对照组常规抽取静脉血5 ml,离心后置于-20℃冰箱中待检。sTRAIL、sVCAM-1、IL-18和-23试剂均购自安迪生物科技有限公司,样本均于4 w内检测,应用ELISA法,均严格按说明书操作,并由同一技师完成,严格质量控制,减少人为误差。
1.3 统计学分析 采用SAS6.12软件进行t检验、方差分析和线性相关分析。
2 结果
2.1 两组sTRAIL、sVCAM-1、IL-18和-23表达的比较 观察组sTRAIL、sVCAM-1、IL-18和-23表达明显高于对照组(P均<0.05)。见表 1。
表1 两组sTRAIL、sVCAM-1、IL-18和-23表达比较(s)

表1 两组sTRAIL、sVCAM-1、IL-18和-23表达比较(s)
组别 n sTRAIL(ng/L)sVCAM-1(μg/L)IL-18(ng/L)IL-23(ng/L)
2.2 观察组不同病变程度患者血清sTRAIL、sVCAM-1、IL-18和-23表达比较 观察组sTRAIL、sVCAM-1、IL-18和-23的表达与疾病严重程度密切相关(P<0.05)。见表2。
2.3 观察组血清sTRAIL、sVCAM-1、IL-18和-23表达相关性
观察组 sTRAIL 和 sVCAM-1(r=0.47,P=0.029 8)、IL-18 和-23(r=0.46,P=0.034 5)表达均正相关。
表2 观察组不同病变程度分组患者血清sTRAIL、sVCAM-1、IL-18和-23表达比较(s)
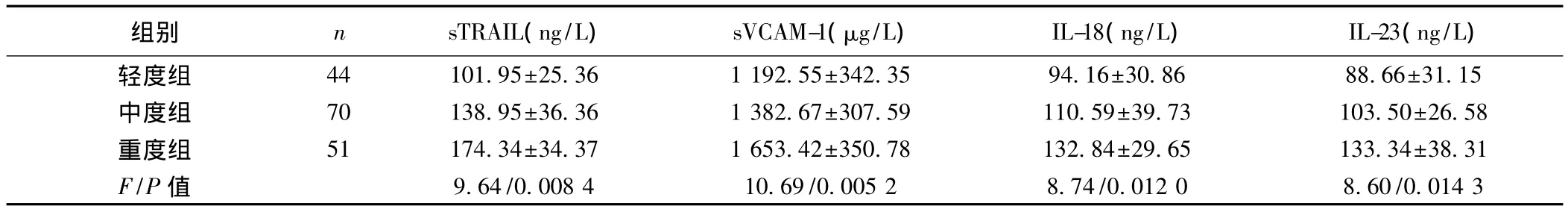
表2 观察组不同病变程度分组患者血清sTRAIL、sVCAM-1、IL-18和-23表达比较(s)
组别 n sTRAIL(ng/L)sVCAM-1(μg/L)IL-18(ng/L)IL-23(ng/L)轻度组 44 101.95±25.36 1 192.55±342.35 94.16±30.86 88.66±31.15中度组 70 138.95±36.36 1 382.67±307.59 110.59±39.73 103.50±26.58重度组 51 174.34±34.37 1 653.42±350.78 132.84±29.65 133.34±38.31 F/P 值 9.64/0.008 4 10.69/0.005 2 8.74/0.012 0 8.60/0.014 3
3 讨论
肝炎的病因尚未明确,研究认为这是一种与细胞因子相关的疾病,且与遗传、机体发育、免疫因素及环境因素有关〔8〕。sTRAIL作为机体的多功能蛋白,可以调节免疫系统并参与感染、炎症、自身免疫性疾病和细胞凋亡的过程。其机制有:①细胞坏死后sTRAIL和受体均表达,引起细胞凋亡〔9〕;②病损区及外周血细胞表达的TRAIL可以水解生成sTRAIL,引起sTRAIL在血清检测浓度升高〔10〕。VCAM-1是与缺血损伤关系密切的黏附分子,在体内分布较广,常表达在血管内皮细胞中。sVCAM-1在肝细胞内含量较多,也可以由激活的巨噬细胞分泌生成。正常情况下体内含量较少,当细胞损伤后,胞浆内的sVCAM-1蛋白释放到肝窦中,进而进入血液循环,引起血清含量增加。相关学者认为sVCAM-1可以调控复杂的细胞相互作用,其高表达时可以诱导肝细胞死亡〔11,12〕。研究显示VCAM-1在胞质突起介导的淋巴细胞募集中发挥重要作用,同时可以促进T细胞的跨内皮迁移的运动〔13〕。IL-18、-23是体内细胞因子中的重要成员,也是重要的免疫调节因子〔14,15〕,其主要来源于激活的单核细胞、自然杀伤(NK)细胞和B细胞等,激活机体的相关级联反应〔16〕,此作用过程包括刺激免疫细胞采用细胞攻击的方式在局部或远隔部位发挥作用〔17,18〕。
本研究结果提示sTRAIL、sVCAM-1和IL-18、-23,在病变中表达升高,可以促进乙型肝炎的发生。由于老年人常伴有退行性改变,且常具有多年肝病史,因此其表达作用是对病变持续作用的结果。四者参与病变的进展,即随着病变程度的增加,表达升高。sTRAIL和sVCAM-1具有协同作用。当细胞因子出现异常时,载体调节的细胞因子可以出现主动转运,此时损伤的肝细胞能通过细胞因子的级联反应,形成多元性瀑布效应,加速病变进展〔19~21〕。Gong等〔22〕检测32 例乙型肝炎患者血清sVCAM-1表达明显升高,并认为这是对乙型肝炎病毒的反应性改变,同时检测sVCAM-1的表达对判断疾病进展有重要作用。IL-18和-23的表达具有正相关性,由于二者均为炎性相关介质,其协同作用机制可能与肝细胞功能衰退和炎性环境有关〔23〕。
1 Huang Z,van Velkinburgh JC,Ni B,et al.Pivotal roles of the interleukin-23/T helper 17 cell axis in hepatitis B〔J〕.Liver Int,2012;32(6):894-901.
2 岳凤娥,宋修光,杜文军,等.sTRAIL在肝炎肝硬化和原发性肝癌患者血清中的表达及与肝损伤指标关系的临床研究〔J〕.肿瘤防治杂志,2005;12(4):255-7.
3 魏 屏,张景辉,刘 薇,等.sTRAIL在重型肝炎患者PBMC和血清中的表达及血浆置换治疗前后的变化〔J〕.世界华人消化杂志,2011;19(19):2063-7.
4 咸香淑,吴龙仁,朴红心,等.乙型肝炎患者血清sICAM-1、sVCAM-1含量的检测及其意义〔J〕.中国免疫学杂志,2006;22(12):1158-60.
5 王德荣,丁 浩,张伯新,等.肝炎后肝硬化患者血清sVCAM-1和TNF-α检测的临床意义〔J〕.世界华人消化杂志,2000;8(1):118-9.
6 Xia P,Zhou M,Dong DS,et al.Association of polymorphisms in interleukin-18 and interleukin-28B genes with outcomes of hepatitis B virus infections:a meta-analysis〔J〕.Tumour Biol,2014;35(2):1129-37.
7 Li N,Gao YF,Zhang TC,et al.Relationship between interleukin 18 polymorphisms and susceptibility to chronic hepatitis B virus infection〔J〕.World J Hepatol,2012;27(3):105-9.
8 Wu JF,Wu TC,Chen CH,et al.Serum levels of interleukin-10 and interleukin-12 predict early,spontaneous hepatitis B virus E antigen seroconversion〔J〕.Gastroenterology,2010;138(1):165-72.
9 毛丽萍,王惠民,张子玉,等.外周血单个核细胞TRAIL mRNA和血清sTRAIL水平与HBV感染肝损伤的相关性〔J〕.世界华人消化杂志,2007;15(6):641-5.
10 董明国,石应元,叶青跃,等.慢性乙型重型肝炎患者血清sTRAIL的临床价值分析〔J〕.临床和实验医学杂志,2010;9(23):1797-8.
11 刘文兰,车念聪.慢性乙型肝炎患者血清sVCAM-1与年龄、舌色关系研究〔J〕.辽宁中医药大学学报,2013;15(5):75-7.
12 何志兵,甘华田,陈友琴,等.肝炎后肝硬化患者细胞因子和细胞粘附分子的检测及意义〔J〕.华西医学,2003;18(1):49-50.
13 方彩云,方孝梅,赵亚娟.妊娠肝内胆汁淤积症患者血清中sVCAM-1及IL-6临床检测意义〔J〕.中国计划生育学杂志,2008;48(2):106-8.
14 Li Y,Shi Y,Chen J,et al.Association of polymorphisms in interleukin-18 and interleukin-28B with hepatitis B recurrence after liver transplantation in Chinese Han population〔J〕.Int J Immunogenet,2012;39(4):346-52.
15 Wang Q,Zhou J,Zhang B,et al.Hepatitis B virus induces IL-23 production in antigen presenting cells and causes liver damage via the IL-23/IL-17 axis〔J〕.PLoS Pathog,2013;9(6):e1003410.
16 Grzegorzewska AE,Wobszal P,Jagodzinski PP.Interleukin-18 promoter polymorphism and development of antibodies to surface antigen of hepatitis B virus in hemodialysis patients〔J〕.Kidney Blood Press Res,2012;35(1):1-8.
17 Zhang Y,Li Y,Ma Y,et al.Dual effects of interleukin-18:inhibiting hepatitis B virus replication in HepG2.2.15 cells and promoting hepatoma cells metastasis〔J〕.Am J Physiol Gastrointest Liver Physiol,2011;301(3):G565-73.
18 Wang Q,Zheng Y,Huang Z,et al.Activated IL-23/IL-17 pathway closely correlates with increased Foxp3 expression in livers of chronic hepatitis B patients〔J〕.BMC Immunol,2011;14(12):25.
19 Sylvan SP,Hellstrom UB.Modulation of serum interleukin-18 concentrations and hepatitis B virus DNA levels during interferon therapy in patients with hepatitis B e-antigen-positive chronic hepatitis B〔J〕.J Interferon Cytokine Res,2010;30(12):901-8.
20 Migita K,Sawakami-Kobayashi K,Maeda Y,et al.Interleukin-18 promoter polymorphisms and the disease progression of Hepatitis B virus-related liver disease〔J〕.Transl Res,2009;153(2):91-6.
21 Wang JM,Ma CJ,Li GY,et al.Tim-3 alters the balance of IL-12/IL-23 and drives TH17 cells:role in hepatitis B vaccine failure during hepatitis C infection〔J〕.Vaccine,2013;31(18):2238-45.
22 Gong X,Qin B,Ma Q.Relationship between adhesion molecules and virological response to pegylated interferon-alpha-2a treatment in patients with chronic hepatitis B:a pilotstudy〔J〕.HepatolRes,2013;32(3):3.
23 Xia L,Tian D,Huang W,et al.Upregulation of IL-23 expression in patients with chronic hepatitis B is mediated by the HBx/ERK/NF-κB pathway〔J〕.J Immunol,2012;188(2):753-64.

