老年肺结核患者细胞和体液免疫状况及免疫干预治疗对其的影响
赵 晖 (上海市松江区中心医院肺科,上海 201600)
老年肺结核包括初发肺结核以及疾病迁延未愈至60岁以后的复治肺结核患者〔1〕。老年人肺结核患病率是普通人群的3倍以上;痰结核菌阳性率高,是肺结核病的重要传染源之一;治疗过程中复治率和耐药率高,且易发生多种并发症,影响生命质量;患者死亡率高,且治疗费用高、疗程长,给患者及其家庭造成沉重的经济负担和精神压力。结核病的发生、发展和转归与患者的免疫功能状况密切相关〔2〕。有研究〔3〕发现,母牛分枝杆菌菌苗为一种免疫调节剂,能够提高患者免疫功能,改善患者免疫状态,从而提升结核病治疗的有效性。本研究初步探讨老年肺结核患者的免疫状况及免疫干预治疗对患者免疫状态的影响。
1 资料与方法
1.1 一般资料 选取2011年1月至2013年9月于本院感染科住院治疗的老年肺结核患者80例(A组),男43例,女37例,年龄60~79岁,平均(69.5±8.6)岁;选取同时间段体检的80名健康老年人(B组),男41例,女39例,年龄61~80岁,平均(68.8±9.1)岁。肺结核诊断按照中华医学会结核病分科学会制定的结核病临床诊疗指南诊断标准〔4〕。入选标准:年龄60~80岁;老年肺结核患者均为痰菌阳性患者,且此次治疗前3个月内未使用过其他影响机体免疫功能的药物;健康老年人为无肺结核及肺外结核疾病史且肺部影像学检查未见肺结核影像学表现,且近1年内未接种卡介苗;近1个月内未发生病毒感染性疾病者。排除严重心、肺、肝、脾、肾脏疾病患者以及患有精神疾病、糖尿病、甲亢、肿瘤、自身免疫性疾病、艾滋病者。两组人员性别、年龄及体质量指数无统计学差异(P>0.05),具有可比性。
1.2 方法 分别检测A、B组细胞及体液免疫功能指标,细胞免疫检测项目为外周血 T淋巴细胞亚群CD3+、CD4+、CD8+、CD4+/CD8+比值及NK细胞,体液免疫检测项目为外周血免疫球蛋白(Ig)A、G及M。将A组80例患者根据随机数字表法随机分为治疗组和对照组,每组40例。两组患者均于第一次采血完成后采用2HRZE/4HR化疗方案治疗,治疗组于化疗第2周末开始联合使用母牛分枝杆菌菌苗治疗〔5〕(深部肌肉注射22.5 μg/次,每周1次,疗程为8 w),对照组不予以其他治疗。两组患者于治疗第10周末再次采血并检测细胞免疫功能指标。血液样本采集方法:无菌采集受试者空腹状态下静脉血样本2 ml,且标本在采集后30 min内送检。
2 结果
2.1 老年肺结核组与老年健康组细胞免疫状况比较 老年肺结核患者外周血CD3+、CD4+T淋巴细胞百分比及CD4+/CD8+比值较老年健康组显著减低(P<0.001);CD8+T淋巴细胞百分比显著高于老年健康组(P<0.05);老年肺结核组NK细胞百分比与老年健康组相比无统计学差异(P>0.05)。见表1。
2.2 老年肺结核组与老年健康组体液免疫状况比较 老年肺结核组外周血IgA、IgG及IgM水平,差异无统计学意义(P>0.05)。见表1。
2.3 老年肺结核组内治疗组和对照组患者治疗前后外周血T淋巴细胞比较 治疗前两组患者外周血T淋巴细胞水平差异无统计学意义(P>0.05)。治疗后治疗组患者CD3+、CD4+T淋巴细胞百分比、CD4+/CD8+比值高于对照组患者(P<0.05),CD8+T淋巴细胞百分比较对照组低(P<0.05),见表2。
表1 老年肺结核组与老年健康组外周血淋巴细胞及检测结果(s,n=80)

表1 老年肺结核组与老年健康组外周血淋巴细胞及检测结果(s,n=80)
组别 CD3+(%)CD4+(%)CD8+(%)CD4+/CD8+ NK(%)IgA(g/L)IgG(g/L)IgM(g/L)A 组 59.86±10.04 30.64±10.93 29.01±11.57 1.06±0.13 17.51±8.9 2.17±0.43 12.93±3.03 1.31±0.52 B 组 67.82±4.68 40.87±4.78 23.72±5.88 1.83±0.05 16.96±8.47 2.34±0.41 13.45±3.25 1.22±0.48 t/P值 -3.667/0.000 -3.983/0.000 2.334/0.029 -3.718/0.000 0.315/0.479 -0.682/1.769 -0.239/2.487 0.454/1.959
表2 治疗组和对照组治疗前后外周血淋巴细胞检测结果(s,n=40,%)
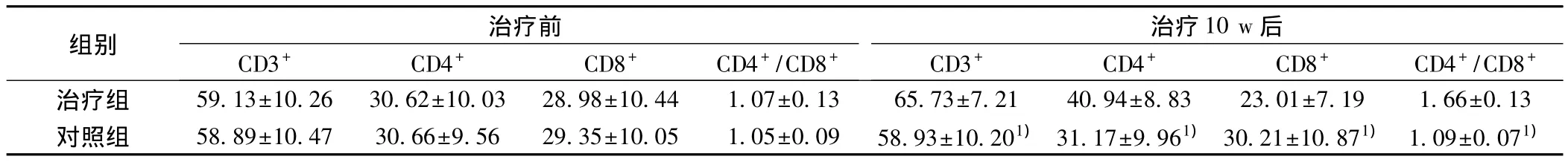
表2 治疗组和对照组治疗前后外周血淋巴细胞检测结果(s,n=40,%)
与治疗组比较:1)P<0.05
组别 治疗前治疗10 w后CD3+ CD4+ CD8+ CD4+/CD8+CD3+ CD4+ CD8+ CD4+/CD8+治疗组 59.13±10.26 30.62±10.03 28.98±10.44 1.07±0.13 65.73±7.21 40.94±8.83 23.01±7.19 1.66±0.13对照组 58.89±10.47 30.66±9.56 29.35±10.05 1.05±0.09 58.93±10.201)31.17±9.961)30.21±10.871) 1.09±0.071)
3 讨论
老年肺结核传染性强,耐药率高,症状不典型且病程长,加之化疗药物易引起多种不良反应,给老年肺结核的防治工作带来了极大的困难〔6〕。近年来,老年肺结核病的发病率呈不断上升趋势〔7〕,老年肺结核已受到越来越多的关注。
本研究结果说明结核分枝杆菌感染引起老年肺结核发生与CD3+和CD4+T淋巴细胞降低有关。有研究〔8〕证实,T淋巴细胞在控制结核分枝杆菌方面发挥主要作用,是人体防御结核感染的主要免疫机制。CD3+、CD4+T淋巴细胞能够分泌多种细胞因子〔9〕,如产生γ-干扰素(IFN),调节细胞免疫和体液免疫,且能够产生细胞毒作用,介导靶细胞的溶解,发挥免疫效应。当感染结核分枝杆菌时,免疫功能低下者外周血T淋巴细胞,尤其是CD3+、CD4+T淋巴细胞减少,无法将病原体有效局限、抵抗和杀灭,从而引起疾病的发生。老年健康者外周血CD3+和CD4+T淋巴细胞正常,因其对结核杆菌产生及时而有效的免疫应答和抵抗作用,从而不会引起肺结核病的发生。由于CD3+、CD4+T淋巴细胞减少,CD8+T淋巴相对增多,CD8+T淋巴细胞发挥的作用相对增强。CD8+T淋巴细胞能够识别已感染结核杆菌的细胞,并产生等某些细胞因子〔10〕,通过调节和介导免疫应答将已吞噬结核菌的巨噬细胞溶解或引起细胞凋亡,而这种免疫应答反应使得已被吞噬的结核分枝杆菌重新暴露、释放和扩散,造成反复排菌后病原菌再次感染新的细胞,从而加剧了疾病的发生和进展,增加治疗周期和难度。因此,外周血CD8+T淋巴细胞水平升高是老年肺结核患者疾病发生和进展原因之一。NK细胞在肺结核的发病机制中不发挥主导作用〔11〕,其含量对机体抵抗结核杆菌的作用无影响。
体液免疫状态与是否发生老年肺结核无关。在已有的对结核分枝杆菌病原微生物学研究〔12〕以及对肺结核疾病发病机制的研究〔13〕中发现,结核分枝杆菌是细胞内病原菌〔14〕,而存在于人体血清中的抗体难以进入细胞内,从而无法识别结核分枝杆菌并发挥免疫效应。因此老年人外周血血清免疫球蛋白在抵抗和杀灭结核分枝杆菌方面无明显作用。免疫干预治疗方法能够提高老年肺结核患者外周血CD3+和CD4+T淋巴细胞水平、CD8+T淋巴细胞百分比,改善患者细胞免疫功能。抗结核药物能够抑制或杀灭结核分枝杆菌,但对机体与抗结核分枝杆菌相关的免疫功能无影响,而免疫干预治疗能够提高患者免疫功能,改善患者细胞免疫状态。应用母牛分枝杆菌菌苗〔15〕免疫干预可刺激T淋巴细胞增殖,尤其是 CD3+和CD4+T淋巴细胞增殖更明显。CD3+和CD4+T淋巴细胞增多一方面可增加IL-2等细胞因子的分泌,使调节免疫应答作用增强,另一方面增强T淋巴细胞介导的细胞毒作用,及时吞噬和杀灭受感染的病变细胞,控制病情的发展。CD8+T淋巴细胞增殖较前两者慢,其在外周血的百分比下降。已有研究〔16〕证实,CD8+T淋巴细胞数量的增高与结核病发病和细菌扩散密切相关。CD8+T淋巴细胞作用减弱,经CD8+T淋巴细胞处理后释放并暴露的结核杆菌减少,因此病原菌在体内的扩散得到有效控制,有助于延缓病情发展、提高药物治疗的有效性。
1 Barber DL,Andrade BB,Sereti I,et al.Immune reconstitution inflammatory syndrome:the trouble with immunity when you had none〔J〕.Nat Rev Microbiol,2012;10(4):150-6.
2 Meintjes G,Skolimowska KH,Wilkinson KA,et al.Corticosteroid-modulated immune activation in the tuberculosis immune reconstitution inflammatory syndrome〔J〕.Respir Crit Care Med,2012;186(1):369-77.
3 Abdool Karim SS,Naidoo K,Grobler A,et al.Integration of antiretroviral therapy with tuberculosis treatment〔J〕.N Engl J Med,2011;365(2):1492-501.
4 中华医学会结核病分科学会.临床诊疗指南·结核病分册〔M〕.北京:人民卫生出版社,2005:35-45.
5 Grotzke JE,Lewinsohn DM.Role of CD8+T Iymphocytes in control of Mycobacterium tuberculosis infection〔J〕.Microbes Infect,2005;7(4):776-88.
6 Kinhikar AG,Verma I,Chandra D,et al.Potential role for ESAT6 in dissemination of M.tuberculosis via human lung epithelial cells〔J〕.Mol Microbiol,2010;75(1):92-106.
7 Harding CV,Boom WH.Regulation of antigen presentation by Mycobacterium tuberculosis:a role for To ll-like receptors〔J〕.Nature Rev Microbiol,2010;8(4):296-307.
8 Wolf AJ,Desvignes L,Linas B,et al.Initiation of the adaptive immune response to Mycobacterium tuberculosis depends on antigen production in the local lymph node,not the lungs〔J〕.J Exp Med,2008;205(1):105-15.
9 Shiloh MU,DiGiuseppe PA.To catch a killer.What can mycobacterial models teach us about Mycobacterium tuberculosispathogenesis〔J〕?Curr Opin Microbiol,2010;13(1):86-92.
10 Cooper AM.Cell-mediated immune responses in tuberculosis〔J〕.Ann Rev Immunol,2009;27(1):393-422.
11 Chan J,Flynn J.The immunological aspects of latency in tuberculosis〔J〕.Clin Immunol,2004;110(1):2-12.
12 Beetz S,Wesch D,Marischen L,et al.Innate immune functions of human γδT cells〔J〕.Immunobiology,2008;213(3-4):173-82.
13 Ahmad S,Mokaddas E.Recent advances in the diagnosis and treatment of multidrug-resistant tuberculosis〔J〕.Resp Med,2009;103(12):1777-90.
14 Vergne I,Chua J,Lee HH,et al.Mechanism of phagolysosome biogenesis block by viable Mycobacterium tuberculosis〔J〕.Proc Natl Acad Sci USA,2005;102(11):4033-8.
15 Baena A,Porcelli SA.Evasion and subversion of antigen presentation by Mycobacterium tuberculosis〔J〕.Tissue Antigens,2009;74(3):189-204.
16 Wiker HG,Mustafa T,Bjune GA,et al.Evidence for waning of latency in a cohort study of Tuberculosis〔J〕.BMC Infec Dis,2010;37(10):1-10.

