HPLC法研究唑尼沙胺分散片在中国健康志愿者的药动学
戴 青,陈勇川,邱学文,向荣凤,熊丽蓉(第三军医大学西南医院药剂科,国家药品临床研究基地,重庆 400038)
唑尼沙胺(zonisamide,ZNS),化学名为1,2-苯并异 唑-3-甲磺酰胺[1-2],是新型广谱抗癫痫药物,1989年在日本首次获准上市。临床上常用于癫痫大发作、小发作、局限性发作、癫痫持续状态及精神运动性发作等治疗[3]。
国内曾有HPLC法[4-6]检测唑尼沙胺血药浓度的报道,其分析过程复杂,以磷酸盐缓冲液[4,6]作为流动相,由于磷酸盐不易清洗,对色谱柱及液相色谱系统均易造成损害。本实验改用乙腈-0.1%三氟乙酸作为流动相,其配制过程简单且易冲洗。在血样的处理上,文献[6]采用液液萃取的方法,实际操作繁琐且耗时,本文选用6%高氯酸沉淀蛋白,所需体积少(只需与血样等体积即可),沉淀蛋白效果明显,无干扰,分析时间短。本实验快捷、简便、灵敏度高,通过对唑尼沙胺药动学的研究,以期为临床用药提供参考。
1 仪器与试药
Waters 2690 Alliance液相色谱仪(含Waters 2487紫外检测器,Millennium32数据采集处理软件,美国Waters公司);高速离心机(美国Abbott公司);Milli-Q plus超纯水器(美国Millipore公司);KQ-400KDE型高功率数控超声清洗器(昆山市超声仪器有限公司);Vortex Genius 3圆周振荡器(德国IKA公司)。
唑尼沙胺分散片(苏州工业园区天龙制药有限公司,规格:100 mg,批号081125);唑尼沙胺标准品(苏州工业园区天龙制药有限公司,含量:99.8%,批号080601);羟苯甲酯标准品(苏州工业园区天龙制药有限公司,批号090915);乙腈为色谱纯(美国迪马公司);高氯酸为分析纯(成都天华科技股份有限公司);三氟乙酸为分析纯(天津市光复精细化工研究所);水为超纯水。
2 方法与结果
2.1 色谱条件
色谱柱:Diamonsil C18(4.6 mm×250 mm,5 μm);柱温:30 ℃;流动相:乙腈-0.1%三氟乙酸(33∶67);流速:1.6 mL·min-1;检测波长:284 nm;进样量:20 μL。
2.2 受试者选择
共入选30名健康志愿者,经常规体检、心电图及生化检验结果均正常,精神状态良好。受试前2周及实验期间未服用其他药物,实验期间忌烟、酒和油腻食物,统一饮食,受试者对实验目的和要求完全知情,实验前志愿签署知情同意书,并经本院伦理委员会的批准。单次给药女性受试者15例,年龄(26.47 ± 6.47)岁,身高(156.87 ± 4.29) cm,体质量(52.47 ± 5.29) kg;单次给药男性受试者15例,年龄(21.60 ± 0.91)岁,身高(171.67 ± 5.81) cm,体质量(61.87 ± 5.52) kg。多次给药女性受试者5例,年龄(22.40 ± 0.55)岁,身高(159.20 ± 3.70) cm,体质量(52.10 ± 2.25) kg;多次给药男性受试者5例,年龄(23.00 ± 1.00)岁,身高(173.20 ± 5.45) cm,体质量(68.00 ± 4.36) kg。其中,多次给药组一名受试者在实验服药阶段自动退出,多次给药组实际完成9例。
2.3 实验方案
单次给药:30名受试者(15名男性,15名女性)随机分配至3个剂量组(200、300、400 mg),每组10人。每位受试者早晨空腹用200 mL温水口服设定剂量的唑尼沙胺分散片,给药后2 h方可饮水,4 h后进统一标准餐。分别于给药前和开始给药后1、2、3、4、5、6、8、12、24、48、72、120、180、240和300 h取静脉血4.0 mL,肝素抗凝,离心5 min(4000 r·min-1),分离血浆,– 65 ℃冷冻保存至测定。
多次给药:文献[7]报道唑尼沙胺达到稳态需要13~ 14 d,10名参加300 mg单次剂量组的受试者于单剂量实验结束后第3天进入多剂量研究,每天一次服用唑尼沙胺分散片300 mg,连续服用14 d。在第12、13、14次给药前和第14次给药后1、2、3、4、5、6、8、12、24、48、72、120、180、240和300 h取静脉血4.0 mL,肝素抗凝,离心5 min(4000 r·min-1),分离血浆,– 65 ℃冷冻保存至测定。
2.4 标准溶液的制备
精密称取唑尼沙胺标准品10.02 mg,置于10 mL棕色容量瓶中,用乙腈溶解并稀释至刻度,混匀,备用。
精密称取羟苯甲酯(内标)标准品10.00 mg,置于10 mL棕色容量瓶中,用乙腈溶解并稀释至刻度,混匀;再从中取2 mL置于10 mL棕色容量瓶中,用乙腈稀释至刻度,混匀,备用。
2.5 血浆样品处理
取待测血浆0.25 mL,加入10 μL内标乙腈液(0.2 mg·mL-1),混匀30 s,再加入6%高氯酸0.25 mL,振荡混匀2 min,离心5 min(13 000 r·min-1),取上清液20 μL进样。
2.6 专属性考察
由图1可见,在本实验条件下,唑尼沙胺与羟苯甲酯(内标)互不干扰且与血浆中内源性杂质分离良好,唑尼沙胺的保留时间约为4.551 min,羟苯甲酯的保留时间约为6.036 min。
2.7 标准曲线的绘制
空白血浆中加入唑尼沙胺标准溶液适量,再依次用空白血浆稀释成0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0、40.0 μg·mL-1系列的浓度,按“2.5”项下方法处理后进行高效液相测定,记录色谱图,将唑尼沙胺与内标的峰面积比值(R)对浓度(C)进行线性回归,得回归方程:R = 1.45C – 6.09 × 103(r = 0.999 5,n = 9),线性范围:0.1 ~ 40.0 μg·mL-1,最低定量限为0.1 μg·mL-1。
2.8 精密度和回收率实验
空白血浆中加入唑尼沙胺标准溶液适量,配制成低、中、高三种不同浓度(0.2、2.0、20.0 μg·mL-1),按“2.5”项下方法处理后进样,各浓度日内重复测定5次,并连续测定5 d,计算日内、日间的精密度和方法回收率,结果见表1。
2.9 稳定性考察
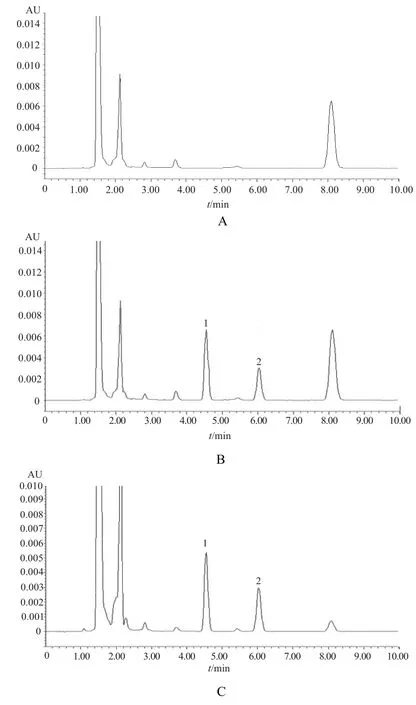
图1 唑尼沙胺HPLC色谱图A – 空白血浆,B – 标准血样(含10 μg·mL-1的唑尼沙胺和8 μg·mL-1的羟苯甲酯),C – 受试者服药后6 h血浆样品;1 – 唑尼沙胺,2 – 羟苯甲酯Fig 1 HPLC chromatograms of zonisamideA – blank plasma, B – standard plasma with zonisamide 10 μg·mL-1 and methylparaben 8 μg·mL-1, C – human plasma samples of the volunteer after oral administration with drugs for 6 h; 1 – zonisamide,2 – methylparaben

表1 精密度和回收率实验测定结果. n = 5Tab 1 Test results of precision and recovery. n = 5
将加入唑尼沙胺的血浆样品分别在– 65 ℃低温冰箱冻存52 d、室温放置3 h、血浆样品反复冻融3次、血浆样品经处理后在10 ℃放置28 h,其含量没有明显变化,详见表2。
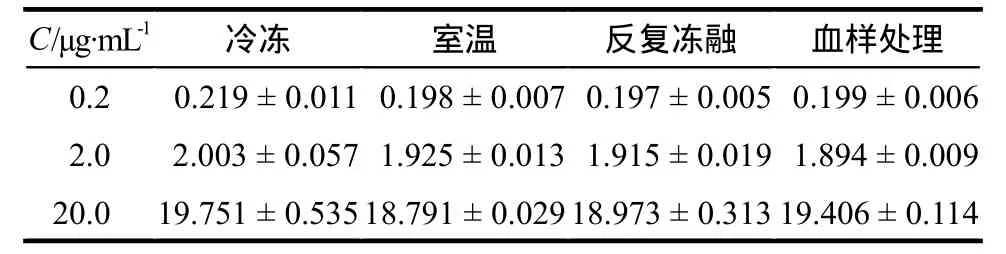
表2 稳定性实验测定结果. μg·mL-1,x ± s,n = 9Tab 2 Test results of stability. μg·mL-1, x ± s, n = 9
2.1 0 数据处理
Cmax和tmax均以实测值表示;AUC0-t以梯形法计算,AUC0-∞按公式计算:AUC0-∞= AUC0-t+ Ct/λz(t为最后一次可实测血药浓度的采样时间;Ct为末次可测样本血药浓度;λz为对数药-时曲线末端直线部分求得的末端消除速率常数);t1/2= 0.693/λz。药动学基本参数的计算与统计学检验分析借助DAS 2.1.1软件完成。
2.1 1 药-时曲线
30名受试者单次口服(低剂量200 mg,中剂量300 mg,高剂量400 mg)唑尼沙胺分散片的血药浓度均值-时间曲线见图2,9名受试者多剂量口服唑尼沙胺(300 mg)后的平均血药浓度-时间曲线见图3。

图2 单次口服唑尼沙胺200、300、400 mg后的平均药-时曲线. n = 10Fig 2 Concentration-time curves after single oral administration of zonisamide with the dose of 200, 300, 400 mg. n = 10

图3 多次口服唑尼沙胺300 mg后的平均药-时曲线. n = 9Fig 3 Concentration-time curve after multiple dose administration of zonisamide 300 mg. n = 9
2.1 2 药动学参数
30名健康受试者单剂量口服200、300、400 mg唑尼沙胺后测得血浆中的主要药动学参数和9名健康受试者多剂量口服300 mg唑尼沙胺后测得血浆中的主要药动学参数见表3。
表3 单剂量及多剂量口服唑尼沙胺后血浆主要药动学参数测定结果. x± sTab 3 Determination results of main pharmacokinetic parameters of zonisamide in plasma after single or multiple oral administration. ±s
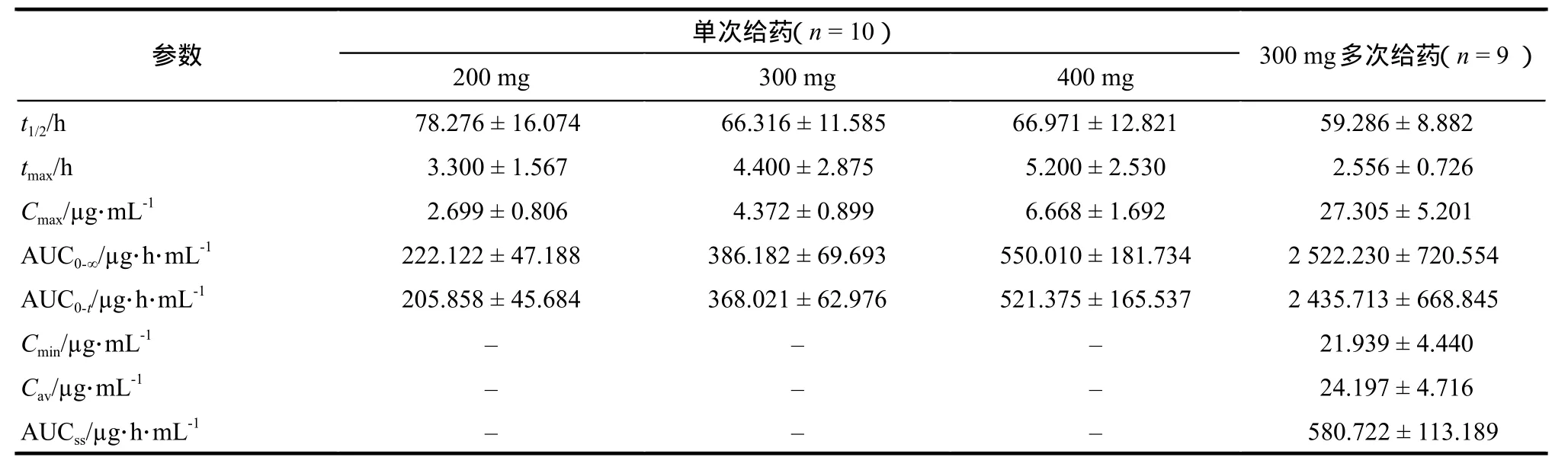
表3 单剂量及多剂量口服唑尼沙胺后血浆主要药动学参数测定结果. x± sTab 3 Determination results of main pharmacokinetic parameters of zonisamide in plasma after single or multiple oral administration. ±s
参数单次给药(n = 10) 300 mg多次给药(n = 9 )200 mg 300 mg 400 mg t1/2/h 78.276 ± 16.074 66.316 ± 11.585 66.971 ± 12.821 59.286 ± 8.882 tmax/h 3.300 ± 1.567 4.400 ± 2.875 5.200 ± 2.530 2.556 ± 0.726 C/μg·mL-1 2.699 ± 0.806 4.372 ± 0.899 6.668 ± 1.692 27.305 ± 5.201 max AUC/μg·h·mL-1 222.122 ± 47.188 386.182 ± 69.693 550.010 ± 181.734 2 522.230 ± 720.554 0-∞AUC/μg·h·mL-1 205.858 ± 45.684 368.021 ± 62.976 521.375 ± 165.537 2 435.713 ± 668.845 0-t C/μg·mL-1– – – 21.939 ± 4.440 min C/μg·mL-1– – – 24.197 ± 4.716 av AUC/μg·h·mL-1 – – – 580.722 ± 113.189 ss
2.1 3 药品不良反应评价
实验过程中共23例受试者出现药品不良反应,具体表现为心慌、心跳加速、气促、头昏、嗜睡、乏力、运动失调、反应迟缓、注意力下降,未给予其他治疗随后自行缓解,属轻度不良反应。
3 讨论
3.1 方法与分析
紫外光谱显示,唑尼沙胺吸收波长约为240 nm及284 nm,240 nm的吸收强度最大,为避免血浆内源性杂质的干扰,本文选择284 nm作为测定波长。实验中曾将甲硝唑、替硝唑、奥硝唑、羟苯乙酯、羟苯甲酯作为内标,因羟苯甲酯在流动相及血样处理所具有的酸性条件下性质稳定,并具有合适的保留时间,与唑尼沙胺及血浆内源性杂质分离良好,无干扰,且价廉易得,故将其作为内标。有文献[6]报道,唑尼沙胺在人体单剂量及多剂量实验中因浓度范围相差较大,采用不同浓度范围的定量标准曲线,考虑到其操作繁复,本实验只需做同一标准曲线即能覆盖绝大多数样本,线性范围为0.1 ~ 40.0 μg·mL-1(r = 0.999 5,n = 9)。方法学研究结果表明,该方法具有良好的精密度、准确度和灵敏度,实验稳定性好,操作快捷、简便,能够满足唑尼沙胺人体药动学研究的需要。
3.2 药动学分析
本实验所得药动学参数与文献[6,8-9]报道类似,受试者服药后2 ~ 6 h达到峰浓度。在200 ~ 400 mg剂量范围内,唑尼沙胺的AUC0-t、AUC0-∞、Cmax均与剂量呈线性关系。单次给药数据显示,3组剂量中男性Cmax均较女性明显偏低,而男性t1/2明显较女性延长。唑尼沙胺属于磺胺衍生物,对红细胞有较高的亲和力,因男性血液中红细胞含量较女性多,推测男性服药后药物与红细胞结合较多,随后药物逐渐释放消除,这可能是男性表现为峰浓度较低、消除较慢的原因。由于药物与红细胞的结合具有饱和性,当多次给药后结合达到饱和状态,性别间红细胞含量的绝对差异被饱和效应所稀释,使得唑尼沙胺300 mg每日1次,连续14 d给药后的Cmax和t1/2性别间差异较单次给药减小。多次给药后平均积蓄因子R为(10.117 ± 1.927),提示该用药方案给药后唑尼沙胺在人体内有明显的蓄积。单次给药和多次给药后Cmax、AUC0-t、AUC0-∞存在显著性差异,唑尼沙胺在连续给药14 d后,可达稳态血药浓度。
整个实验过程由经《药物临床试验管理规范》(GCP)培训的临床医师和护士进行观察,除轻度不良反应外,无严重不良事件发生,表明实验药物在实验剂量下具有较好的安全性[10]。

