肾移植患者吗替麦考酚酯血药浓度监测
彭明丽,赵冠人,申 健(解放军309医院药剂科,北京 100091)
吗替麦考酚酯(mycophenolate mofetil,MMF)是麦考酚酸(mycophenolic acid,MPA)的2-乙基酯类衍生物,MPA通过非竞争性抑制嘌呤合成途径中次黄嘌呤核苷酸脱氢酶的活性,抑制T、B淋巴细胞的增殖反应,发挥免疫抑制作用,具有高效、高选择性、非竞争性、可逆性的药理学特质,临床上主要用于肝、肾、心脏及骨髓移植中排斥反应的预防和治疗[1]。
MPA的免疫抑制效果明显,但药物过量时其药品不良反应(adverse drug reaction,ADR)同样不可忽视。麦考酚酸的蛋白结合率为97% ~ 99%,药动学个体差异大,且药动学与其免疫抑制效果及ADR的发生有密切的关系[2]。MMF的有效治疗窗比原有概念中的治疗窗窄,且急性排斥反应与毒副反应的发生率与血药浓度相关性大[3],因此,开展MMF治疗药物监测(therapeutic drug monitoring,TDM)有一定的临床意义。使用TDM指导MMF临床用药,其目标是通过TDM使器官移植患者在使用MMF时达到最佳治疗效果且ADR发生率降至最低,从而使MMF的临床用药真正做到个体化,为器官移植患者带来更大的益处。
为了进一步探讨对MMF进行TDM的临床意义,我们选取了83例服用MMF的本院肾移植患者,对其血药浓度进行测定,并对数据进行分析。
1 材料
1.1 资料来源
选取2012年10 – 12月在我院住院或门诊定期监测血浆MPA的肾移植患者,共83例。其中,服药前血药浓度(C0)46例,服药后2 h血药浓度(C2)37例。在C0测定的免疫抑制用药方案中,与环孢素(CsA)联用的C0共37例,与他克莫司(FK506)联用的C0共9例。男性52例,女性31例,年龄16 ~ 61岁,平均年龄(42.2±26.2)岁,平均体质量(56.6±12.2) kg。
1.2 仪器与试药
岛津HPLC液相系统,包括LC-10ATvp双泵、SPD-M20A二级管阵列检测器、CTO-10Avp柱温箱、SIL-10ADvp自动进样器、SCL-10Avp系统控制器、DGU-10A脱气装置、LC-Solution色谱工作站(日本岛津公司);5417R台式冷冻离心机(德国Eppendorf公司);XW-80A漩涡混合器(上海医科大学仪器厂)。
MPA对照品(Sigma公司,含量:98%,批号019k4106);萘啶酸对照品(德国Dr. Ehrenstorfer GmbH公司,含量:99.5%,批号00621);乙腈为色谱纯(Dikma公司);三氟乙酸为色谱纯(Dikma公司);水为Millipore制备超纯水,电阻率为18.2 MΩ·cm。
2 方法
2.1 免疫抑制用药方案
对肾移植术后的患者采用CsA+MMF+泼尼松(Pred)或FK506+MMF+Pred三联免疫抑制方案。MMF于手术当日开始口服,起始剂量为1.5 g·d-1;肾移植术后FK506起始剂量为0.15 mg·kg-1·d-1;CsA起始剂量为60.15 mg·kg-1·d-1;手术当日起静注Pred(0.5 g,qd),至术后第3天改为口服Pred,起始剂量为40 mg·d-1,逐渐减量。
2.2 血样采集
采血时间为晨起给药前及给药后2 h,取静脉血2 mL,置EDTA-Na真空抗凝管中,当日测定血浆中MPA浓度。
2.3 血药浓度测定方法
2.3.1 色谱条件 色谱柱:Diamonsil C18(250 mm ×4.6 mm,5 μm);流动相:乙腈-0.1%三氟乙酸溶液(40∶60);检测波长:215 nm;柱温:35 ℃;流速:1.0 mL·min-1;进样体积:20 μL。
2.3.2 MPA标准溶液与内标萘啶酸溶液的配制 精密称取MPA对照品12.49 mg,置于25 mL容量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为499.60 μg·mL-1的MPA标准溶液;精密称取萘啶酸对照品6.01 mg,置于50 mL量瓶中,加入甲醇溶解并稀释至刻度,摇匀,即得浓度为120.20 μg·mL-1的内标萘啶酸溶液,以上溶液置于6 ℃冰箱储存。
2.3.3 血浆样品处理 取血浆样品200 μL于1.5 mL离心管,加入内标20 μL,乙腈600 μL,旋涡混合,14 000 r·min-1离心15 min,取上清液20 μL,进样。
2.3.4 专属性实验 本实验条件下,麦考酚酸及内标萘啶酸有对称的色谱峰和良好的分离度,血浆中杂质峰及合用的其他药品峰不干扰样品的测定,本方法具有较高的专属性,见图1。

图1 麦考酚酸和萘啶酸色谱图A – 对照品,B – 空白血浆,C – 血浆样品,D – 合用环孢素患者血浆样品,E – 合用FK506患者血浆样品;1 – 麦考酚酸,2 – 萘啶酸Fig 1 Chromatograms of MPA and nalidixic acidA – standard, B – blank plasma, C – MPA and nalidixic acid standard added in blank plasma, D – plasma of patient taking CsA, E – plasma of patient taking FK506; 1 – mycophenolic acid, 2 – nalidixic acid
2.3.5 标准曲线与线性范围 取人空白血浆180 μL,分别加入MPA标准溶液适量,精密配制成质量浓度分别为0.20、0.50、1.00、5.00、9.99、19.98、49.96 μg·mL-1的血浆样品,按“2.3.3”项下方法处理,按“2.3.1”项下色谱条件进样测定。以样品与内标峰面积比值(Y)对浓度(C)进行回归计算,结果表明MPA在0.20 ~ 49.96 μg·mL-1范围内线性良好,得回归方程为:Y = 0.665 76C – 0.012 057,r = 0.999 6。在上述条件下测得血浆中MPA最低检测浓度为0.20 μg·mL-1。2.3.6 精密度和准确度实验 分别于180 μL的空白血浆中加入低、中、高3种浓度(0.50、5.00、19.98 μg·mL-1)的麦考酚酸对照品溶液20 μL,混匀,得低、中、高3种不同浓度麦考酚酸的血浆样品,按“2.3.3”项下方法处理,按“2.3.1”项下色谱条件进样,依法测定日内与日间(3 d内)精密度,结果见表1。分析可知,日内RSD均小于10%,日间RSD均小于15%,符合规定。
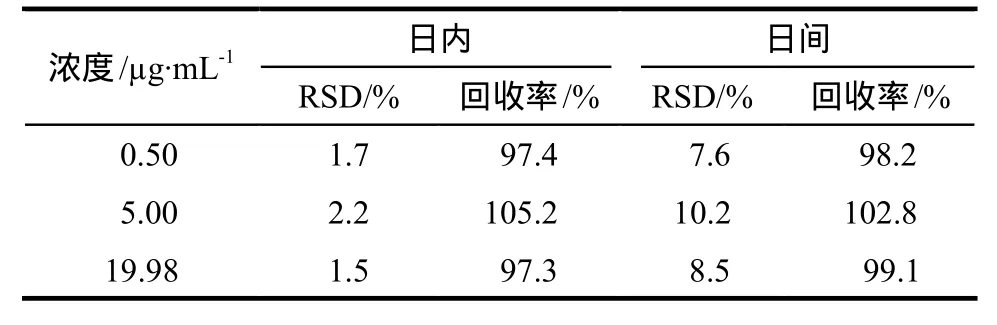
表1 麦考酚酸的相对回收率和精密度Tab 1 Relative recovery and precision of MPA
2.3.7 麦考酚酸稳定性考察 取已知麦考酚酸浓度血浆样品数份,分别置室温条件下存放0、1、2、4、8、16、24 h后,按血浆样品的处理与测定方法操作,测定麦考酚酸浓度,考察样品放置稳定性。结果血浆样品在室温放置24 h稳定,RSD均小于15%,同时考察了样品在– 20 ℃冰箱中存放一个星期的稳定性,测得结果表明样品稳定,RSD均小于15%,符合规定。
2.3.8 回收率实验 分别于180 μL的空白血浆中加入低、中、高3种浓度(0.50、5.00、19.98 μg·mL-1)的麦考酚酸对照品溶液20 μL,混匀,得低、中、高3种不同麦考酚酸浓度的血浆样品,按血浆样品的处理及测定方法操作,结果麦考酚酸平均回收率均大于90%,RSD均小于3%,见表2。
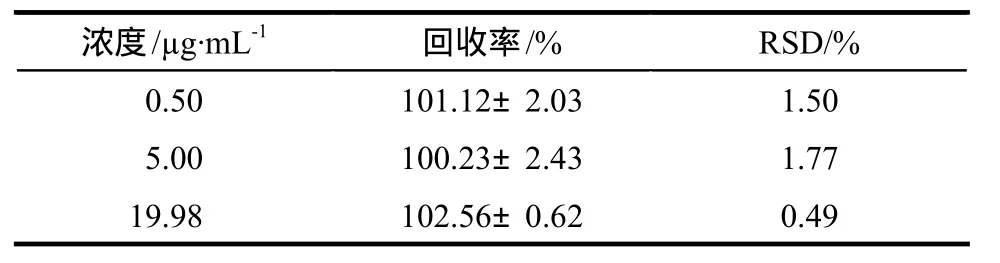
表2 麦考酚酸的提取回收率Tab 2 The extraction recovery of MPA
2.3.9 样品测定 取46名患者给药前血浆(C0)及37名患者给药后2 h血浆(C2),按“2.3.3”项下血浆样品处理方法操作,取上清液20 μL按“2.3.1”项下色谱条件进样测定,另取含麦考酚酸低、中、高浓度(0.50、5.00、19.98 μg·mL-1)的血浆样品各3份,作为质控随行测定,RSD均小于3%。根据内标法加校正因子法计算MPA浓度。
2.4 统计学方法
不同免疫抑制方案MPA谷浓度(C0)数据的比较采用t检验。
3 结果
3.1 MPA谷浓度(C0)测定结果的分布
血浆MPA谷浓度范围为0.34 ~ 3.99 μg·mL-1,测定值的分布情况见表3。谷浓度与抗排斥效果相关较大,由表3可见,按治疗窗1.0 ~ 3.5 μg·mL-1计算[4],有效率为47.83%。

表3 血浆MPA C0测定值的分布Tab 3 Range distribution of C0 about MPA in plasma
3.2 不同免疫抑制方案中MPA谷浓度(C0)的测定结果
与CsA联用方案中,MPA谷浓度范围为0.17 ~3.05 μg·mL-1,谷浓度平均值为(1.26±0.78)μg·mL-1;与FK506联用方案中,MPA谷浓度范围为0.03 ~ 3.99 μg·mL-1,谷浓度平均值为(1.43±1.22)μg·mL-1,二者具有显著性差异(P < 0.05)。
3.3 MPA峰浓度(C2)测定结果的分布
血浆MPA峰浓度范围为0.91 ~ 12.78 μg·mL-1,测定值的分布见表4。MPA峰浓度与不良反应的发生相关性较大,由表4可见,将浓度范围未达到2.00 μg·mL-1计为无效果[4],则无效率为21.62%;将浓度范围高于10.00 μg·mL-1计为中毒[4],则中毒率为8.11%。
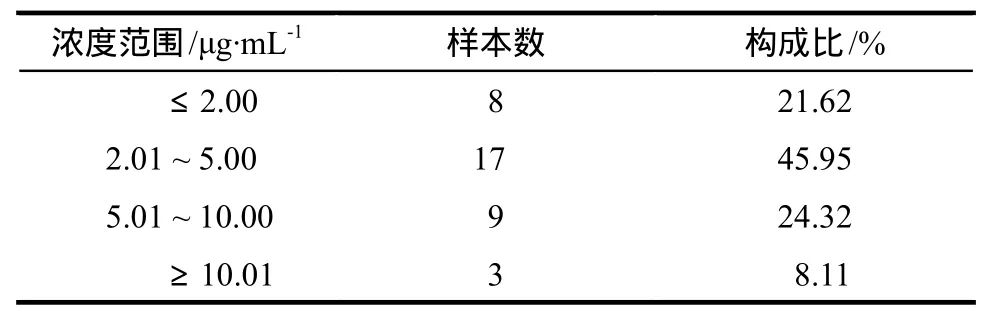
表4 血浆MPA C2测定值的分布Tab 4 Range distribution of C2 about MPA in plasma
4 讨论
MMF是预防和治疗异体肝、肾和心脏移植后器官排斥反应的免疫抑制药物,口服后可迅速经肠道吸收,脱酯化后转化为有活性的MPA从而发挥免疫抑制作用。由于MPA的治疗窗窄,药动学过程个体差异大,因此对其开展TDM有重要的临床意义。MPA药动-药效相关性表明,0 ~ 12 h内曲线下面积(AUC0-12)是预测急性排异相关性最好的指标,但传统的AUC0-12方法采血点多,患者依从性差,检测成本高,临床上难以实施。报道[5]指出,MPA谷浓度C0与急性排斥反应相关性较大,峰浓度与毒副反应相关性较大,因此本文依据此二者作为MMF效应评价指标。
有关血浆中MPA浓度的检测,研究报道有酶联免疫法[6]、液质联用法[7]、高效液相色谱-荧光检测法[8]等,这些方法往往具有特异性不强、成本高、处理方法复杂等特点,难以普及应用。我们建立了一种简便、快速测定移植患者血浆中MPA浓度的高效液相色谱法,可用于常规血药浓度的监测。
本文测定结果显示,与CsA联用时MPA谷浓度范围为 0.17 ~ 3.05 μg·mL-1,谷浓度平均值为(1.26±0.78) μg·mL-1;与FK506联用时MPA谷浓度范围为0.03 ~ 3.99 μg·mL-1,谷浓度平均值为(1.43±1.22) μg·mL-1,比与CsA联用时谷浓度明显升高(P < 0.05),这可能是由于FK506可提高MMF的生物利用度,同时抑制了MPA的葡醛酸化所致。值得注意的是,MMF剂量的增加通常伴随着CsA AUC的升高,且糖皮质类激素的剂量与MMF的生物利用度呈负相关[9]。鉴于相关药物间复杂的相互作用,在免疫抑制联合用药方案中,TDM就显得尤为重要。
另外,MPA谷浓度与峰浓度测定结果的分析表明,按单一剂量服用MMF引起的个体差异较大,有效率较低可能与患者病理状态和药物相互作用有关;出院患者血药浓度个体差异较大,可能与服药依从性差有关,因此对于服用 MMF的患者进行TDM具有更重要的临床意义。

