18F⁃FDGPET/CT在胰腺良恶性病变的诊断及鉴别诊断中的价值
刘一,李亚明,李娜,李雪娜,杜补林
(中国医科大学附属第一医院核医学科,沈阳 110001)
胰腺癌是临床常见的腹部恶性肿瘤,也是目前临床诊治较为困难的肿瘤[1]。由于其特殊的解剖结构,患者出现明显的临床症状较晚,发现时已属中晚期,失去了根治性切除的机会。同时许多胰腺良性病变,因其影像与部分胰腺癌区别较困难,而采取了不必要的外科治疗,给患者带来了一定的负担。18F⁃FDG PET/CT检查作为一种先进的影像检查方法已经在众多肿瘤的诊断方面体现出了重要的价值。本研究通过分析18F⁃FDG PET/CT在胰腺病变的影像表现,对胰腺良恶性病变的诊断及鉴别诊断提供了一定的依据和帮助。
1 材料与方法
1.1 设备及检查方法
使用美国GE Discovery LS型PET/CT检查仪,18F⁃FDG由美国GE公司生产的回旋加速器PET trace及化学合成模块自动合成,放化纯度大于95%。检查过程,患者禁食6 h以上,检查前指尖血化验空腹血糖水平低于11 mmol/L(正常范围3.9~6.1 mmol/L)。经肘静脉注射18F⁃脱氧葡萄糖(FDG),注射后患者于暗室内安静平卧休息约50~60 min后进行显像。显像范围为头顶至股骨上段,扫描的床位数为5或6个,经衰减校正后行迭代法重建,层厚4.25 mm,获得横断面、矢状面、冠状面PET/CT图像。
1.2 临床资料
收集2010年1月至2013年6月,因临床怀疑胰腺病变就诊于我科行PET/CT检查者共112人。检查后经手术切除、穿刺活检、ERCP等手段取得细胞组织病理学结果或经临床综合诊断及临床长期随访(随访时间6个月至24个月),最终临床综合诊断胰腺恶性病变共74例,胰腺良性病变38例。
1.3 图像分析及标准
PET/CT检查结果分别由2位以上有经验的核医学科医师来判断病灶性质,意见一致者即可确立诊断,不一致者集体讨论。PET显像采用感兴趣区(region of interest,ROI)半定量分析法:在放射性浓聚灶显示最清楚的层面上勾画ROI,由计算机自动计算病灶的最大标准摄取值(standardized uptake value,SUV),未检测到病理性浓聚灶的病例,以CT上的病灶作为标准定位,测得SUVmax值,如CT亦未发现明显占位,则以胰腺本底的SUV值进行计算。CT分别观察病灶的形态、大小、密度、胰胆管扩张、远处器官、淋巴结转移等指标进行综合判断。
以胰腺病变早期SUVmax绘制受试者工作特征(receiver operating characteristics,ROC)曲线,通过最大约登指数计算诊断临界值。PET表现以SUVmax大于等于诊断临界值判断为PET阳性,以SUVmax小于诊断临界值判断为PET阴性。CT典型表现为胰腺局限性肿块为略低密度、边界不清,伴或不伴胰腺体尾萎缩、胰腺管或胆管扩张,伴或不伴胰腺周围和腹膜后淋巴结转移或肝、肺等器官转移,如CT表现典型判断为CT阳性,否则判断为CT不典型或CT阴性。根据以上原则排列组合,胰腺病变PET/CT表现分为4种类型:Ⅰ型:PET和CT表现均为典型阳性;Ⅱ型:PET表现为典型阳性,CT表现为不典型或阴性;Ⅲ型:PET表现为阴性,CT表现为典型阳性;Ⅳ型:PET为阴性,CT表现为不典型或阴性。
通过CT测量胰腺病变大小,将胰腺病变肿块大小分成A、B、C 3组,A 组肿块直径≤20 mm;20 mm<B组肿块直径≤40 mm;C组肿块直径>40 mm。
1.4 统计学方法
统计学处理采用SPSS 19.0统计处理软件,定量参数(SUVmax值、肿块直径)采用±s表示。SUVmax值(早期、延迟)两样本比较采用独立样本t检验及配对样本t检验。对早期SUVmax值与胰腺肿块大小进行Spearman相关性检验。胰腺肿块不同大小的组间比较采用单因素方差分析及四格表χ2检验。分别计算PET/CT对胰腺病变诊断的敏感度、特异性、阳性预测值、阴性预测值及准确性。P<0.05认为差异有统计学意义。
2 结果
2.1 胰腺良恶性病变的SUVmax值比较
分析结果显示,胰腺恶性病变74例,SUVmax平均值为8.49±5.47;胰腺良性病变38例,SUVmax平均值为3.78±3.37,见图1。胰腺良恶性病变SUVmax值的差异有统计学意义(P<0.05)。
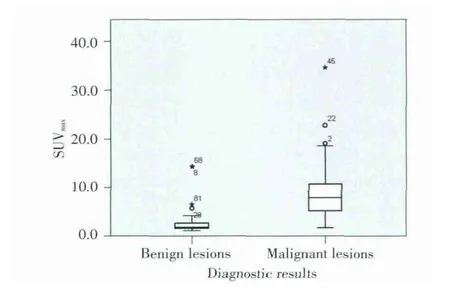
图1 胰腺良恶性病变的SUVmax值比较Fig.1 Comparison of SUVmaxvalues in benign and malignant lesionsof the pancreas
2.2 受试者工作特征曲线(ROC曲线)
以病理诊断为金标准,结合手术发现、临床影像学诊断、临床随访等综合分析,根据所有112例胰腺良恶性病变早期SUVmax值,绘制受试者工作特征曲线(ROC曲线)并计算得到曲线下面积,AUCSUVmax为0.817,见图2。绘制ROC曲线后,当约登指数最大时,所对应的SUVmax值为3.1。
2.3 18F⁃FDG PET/CT对胰腺良恶性病变的诊断结果
分析所有病例,其中PET/CT正确诊断胰腺恶性病变66例,良性病变24例,14例良性病变及8例恶性病变诊断错误。PET/CT诊断胰腺良恶性病变的灵敏度、特异性、阳性预测值、阴性预测值以及诊断正确率分别为89.2%、63.2%、82.5%、75.0%和80.4%。

图2 SUVmax值绘制ROC曲线Fig.2 The ROC curve of SUV maxvalues plotted
2.4 18F⁃FDG PET/CT在胰腺良恶性病变的不同影像表现类型
以早期SUVmax为3.1做为PET诊断临界值,根据PET及CT不同表现分为4种类型,见表1。
2.5 胰腺良恶性病变早期SUVmax值与胰腺病变肿块大小的关系
胰腺病变肿块大小可测得共85例,胰腺病变大小平均值为(37.29±17.92)mm,早期SUVmax平均值为7.49±5.68。胰腺病变大小与早期SUVmax值两者采用Spearman相关性检验,Spearman相关系数为0.449,相关系数双侧检验P=0.000,说明该相关系数有统计学意义,即胰腺病变SUVmax值与胰腺肿块大小两者存在一定的相关性,见图3。
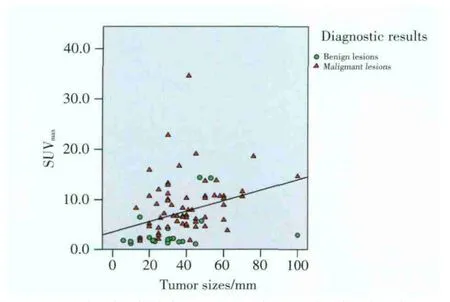
图3 胰腺良恶性病变SUVmax值与胰腺肿块大小相关性分析Fig.3 Correlation analysis of SUVmax and tumor size in the benignand malignant pancreatic lesions
2.6 PET/CT对胰腺病变肿块不同大小的诊断
胰腺病变大小测得共85例,A组(d≤2 cm)共14例,早期SUVmax值为4.72±4.32;B组(2 cm<d≤4 cm)共41例,早期SUVmax值为6.32±4.68;C组(d>4 cm)共30例,早期SUVmax值为10.36±6.36。通过单因素方差分析(F检验)对3组间早期SUVmax值比较结果显示:A组与B组间比较差异无统计学意义(P>0.05),A组与C组、B组与C组间比较差异有统计学意义(P<0.05)。
PET/CT对3组病变诊断的灵敏度、特异性、阳性预测值、阴性预测值和准确性分别为71.4%、85.7%、83.3% 、75.0% 和78.6%,93.1% 、91.7% 、96.4% 、84.6% 和92.7%,96% 、40%、88.9%、66.7%和86.7%。通过χ2检验对3组病变PET/CT诊断的比较结果显示:A组与B组比较差异无统计学意义(P>0.05),A组与C组、B组与C组比较差异有统计学意义(P<0.05,表2)。
2.7 胰腺良恶性病变早期与延迟显像SUVmax值比较
共有36例患者行延迟显像,胰腺良恶性病变早期SUVmax值及延迟SUVmax值差异均有统计学意义(P<0.05)。胰腺良性病变早期与延迟SUVmax值差异无统计学意义(P>0.05)。胰腺恶性病变早期与延迟SUVmax值差异有统计学意义(P<0.05),见表3。

表2 3组胰腺病早期SUVmax值及PET/CT诊断的比较Tab.2 Comparison of early SUVmax values and PET/CT diagnosis in the three groups of pancreatic lesions
2.8 胰腺良恶性病变FDG摄取样式的比较
共112例胰腺良恶性病变,分别对病变FDG摄取的轮廓、形态、分布及位置进行统计分析,见表4。统计结果表明胰腺良恶性病变FDG摄取的轮廓、形态、分布、位置的差异均有统计学意义(P<0.05)。

表3 胰腺良恶性病变早期及延迟SUVmax值比较Tab.3 Comparison of early and delayed SUVmaxvalue in benign and malignant pancreatic lesions

表4 胰腺良恶性病变FD G摄取样式比较Tab.4 Comparison of FDG uptake pattern in benign and malignant pancreatic lesions
3 讨论
胰腺癌是一种常见的腹部恶性肿瘤,也是目前临床诊治最为困难的肿瘤[1]。其发病率占全身肿瘤的1%~2%,占消化道系统恶性肿瘤的8%~10%,患者发病年龄以45~65岁最为多见,以男性较为多见且死亡率较高,近年其发病年龄逐渐年轻化,且发病率有明显上升趋势。
胰腺癌可以发生于胰腺的任何部位,一般胰腺头部多见,约占50%~70%,胰腺癌的大部分肿瘤细胞起源于腺管上皮细胞,占胰腺恶性肿瘤的75%~90%,其他特殊类型包括腺鳞癌、透明细胞癌、黏蛋白癌、未分化癌等。由于胰腺位于腹后壁,位置较深,前方有胃、横结肠和大网膜等遮盖,故早期胰腺病变体征不明显,起病隐蔽,早期诊断困难,且胰腺癌恶性程度高,发展较快,同时胰腺血管、淋巴管丰富,腺泡无包膜,易发生早期远处转移;因此绝大多数患者一经确诊已属晚期[2~4],可切除患者5年生存率不到5%。尽管如此,根治性手术切除仍然是治愈胰腺癌唯一有效的方法,但可以手术的患者仅占15%~29%,同时根治性手术存在创伤大、操作复杂、并发症多、死亡率高等特点。因此,要提高胰腺癌的诊治效果,关键在于早期发现。
18F⁃FDG PET/CT作为一种能实现代谢功能与解剖结果影像同机融合的先进影像诊断方法,在多种恶性肿瘤的诊断方面显示了巨大的优越性,在胰腺良恶性病变的诊断方面也显示出了优于其他检查的特征。恶性肿瘤生长活跃,糖酵解程度高,细胞表面的葡萄糖转运体及己糖激酶多呈高度表达,使大量18F⁃FDG进入细胞内,在己糖激酶的作用下转化为6⁃磷酸⁃18F⁃FDG,而滞留于细胞内[5],导致病变局部18F⁃FDG异常浓聚。Reske等[6]研究发现,与胰腺良性病变相比,胰腺恶性病变细胞表面具有更多的葡萄糖转运体,而葡萄糖转运体1的高度表达与癌细胞内增强的糖酵解有关,使胰腺癌细胞摄取18F⁃FDG能力增强,呈高摄取表现,其标准化摄取值(SUV值)可明显高于胰腺良性病变[7,8]。本研究结果显示胰腺良恶性病变早期SUVmax值之间差异有统计学意义(P<0.05),即胰腺恶性病变早期SUVmax值明显高于胰腺良性病变。有研究报道表明18F⁃FDG PET/CT对胰腺癌诊断的灵敏度和特异度可高达85%和84%。Friess等[9]研究认为以SUVmax值3.0作为胰腺病变良恶性的区分标准,18F⁃FDG PET/CT对胰腺癌的诊断灵敏度和特异性分别为94%和88%。而有些研究[10]则认为SUVmax值等于4.65应作为胰腺良恶性病变的诊断临界值。本研究通过全部病例的早期SUVmax值绘制ROC曲线并计算出诊断临界值,当早期SUVmax值为3.1时,PET/CT对胰腺恶性病变诊断的灵敏度和特异性之和最大,分别为90.1%和62.2%。但本研究特异性比文献报道较低,这可能与本次研究病例中入选的胰腺良性病变病例数较少有关,需在以后的研究中增加良性病变进一步分析。
本研究根据PET和CT不同典型影像表现共分4型,其中Ⅰ型(即PET、CT均为阳性)占胰腺恶性病变所有表现类型的77.0%,为胰腺恶性病变的典型影像表现,但有5例Ⅰ型(占全部Ⅰ型病变的8.2%)临床综合诊断为胰腺良性病变,分别为无功能胰岛细胞瘤、结核肉芽肿和胰腺炎性改变;其中Ⅲ型(即PET为阴性表现、CT为阳性表现)占胰腺良性病变所有表现类型的47.4%,为胰腺良性表现的典型表现,但有4例Ⅲ型(占全部Ⅲ型病变的18.2%)临床综合诊断为恶性病变。
但是因为巨噬细胞、白细胞、中性粒细胞等炎症细胞也可以使葡萄糖转运体和糖酵解酶的高度表达,18F⁃FDG在局部炎症组织细胞内聚集,因此胰腺病变可以因炎症、结核、自身免疫性疾病等影响而表现为高代谢病灶。有研究表明[11],在自身免疫性胰腺炎中,18F⁃FDG显像出现高摄取的几率可达100%,但是临床可以通过胰腺18F⁃FDG显像特点,如病变单发或多发、病变摄取18F⁃FDG是否均匀及位置、胰腺外其他组织的摄取情况、血清IgG或IgG4[12]等结果来区分胰腺病变的性质。本研究分析了胰腺病变FDG摄取的样式,发现胰腺良恶性病变FDG摄取的轮廓、形态、分布及位置的差异有统计学意义(P<0.05),即胰腺良性病变FDG摄取轮廓多不光滑,呈非结节状,分布不均且多发,而胰腺恶性病变FDG摄取轮廓多光滑,呈结节状,分布均匀,单发多见,与文献报道相似[13]。这样可以通过胰腺病变FDG摄取的不同样式来辅助鉴别诊断胰腺病变的良恶性。但部分肿块性胰腺炎FDG摄取表现跟胰腺癌FDG摄取表现相似,仍鉴别困难。其他胰腺良性病变也可以摄取18F⁃FDG,如胰腺导管内乳头状黏液性肿瘤可表现为局部高摄取表现[14]。在本研究中,有1例为胰头无功能胰岛细胞瘤,变现为胰头高摄取表现;有1例为胰腺尾部病变高代谢改变,左侧锁骨上及纵隔内淋巴结高代谢改变,后行淋巴结活检诊断为结核病变;有1例为胰腺弥漫性代谢增高,伴周围淋巴结代谢增高,后经临床系统治疗并长期随访转为正常,临床最终诊断为胰腺炎;有1例为胰头肿物,局灶性代谢增高,伴腹腔内及腹股沟多发淋巴结代谢增高,后经腹股沟淋巴结活检,病理为淋巴组织增生,临床最终诊断为自身免疫性胰腺炎。可见胰腺病变的FDG摄取可受到多种因素的影响,这使得胰腺良恶性病变鉴别产生了一定的困难,所以在诊断过程中需要结合临床多种检查方法及血清化验指标等手段综合分析,避免假阳性诊断。
延迟显像作为对恶性肿瘤鉴别的显像有着特殊的意义。Zhuang等[15]的研究表明在体内和体外随着时间延长恶性肿瘤细胞浓聚FDG增高,即SUV值随显像时间延长而升高,炎性病变延迟显像时SUV值降低或不变。本研究行延迟显像结果表明胰腺良恶性病变早期SUVmax值和延迟SUVmax值的差异有统计学意义(P<0.05),即不论早期还是延迟SUVmax值,胰腺恶性病变SUVmax值均高于胰腺良性病变。同时胰腺恶性病变延迟SUVmax值和早期SUVmax值的差异有统计学意义(P<0.05),但胰腺良性病变延迟SUVmax值和早期SUVmax值的差异无统计学意义(P>0.05),即胰腺恶性病变延迟显像SUVmax值明显升高,而胰腺良性病变延迟显像SUVmax值无明显变化,甚至降低。因此对于PET/CT检查后怀疑的胰腺高代谢病灶,可进一步行延迟显像加以鉴别,恶性病变大多延迟显像后代谢增高,而胰腺良性病变或生理性摄取延迟显像后通常会减低,所以可以根据延迟显像来辅助鉴别诊断胰腺良恶性病变,减少误诊,提高诊断准确率[16]。
但有些胰腺恶性病变的18F⁃FDG呈低水平摄取或等摄取改变,与周围正常胰腺组织18F⁃FDG摄取水平相近,这给18F⁃FDG PET/CT诊断胰腺癌带来了一定的困难。本研究中74例临床综合诊断为恶性病变中,有7例(约9.5%)胰腺恶性病变18F⁃FDG显像其早期SUVmax值<诊断临界值(3.1),而诊断为良性病变,其中2例肿块直径大小约为25 mm,2例肿块直径大小约为15 mm,另外3例CT平扫未见确切异常肿块影,可见较小病变的低FDG摄取在胰腺病变PET/CT诊断中较困难。但在有些研究中[17]表明PET检出<2 cm的胰腺恶性病变的灵敏度较高,且高于CT和MRI。本研究通过对早期SUVmax值与肿块大小行相关性分析,结果表明两者存在一定的相关性。但是有报道称病变SUV值与病变大小以及病变SUV值与肿瘤分化程度无统计学相关[18],这可能与病变大小测量标准和测量误差有关,则需要更多病例和统一病变大小测量方法或重复测量减少测量误差等进一步研究来解释。本研究结果还显示出不同大小胰腺病变早期SUVmax值及PET/CT对不同大小胰腺病变诊断的差异有统计学意义(P<0.05),再次表明胰腺病变大小对PET/CT诊断有一定程度的影响。本研究表明对于较小的胰腺病变,PET/CT诊断准确性低于较大的胰腺病变,与文献报道相近[19]。综上所述,胰腺病变的大小对18F⁃FDG PET/CT诊断结果的准确性有着重要影响,肿块较小、肿瘤细胞数量较少,葡萄糖转运体表达程度较低,使得18F⁃FDG摄取较低,同时因为PET空间对比度分辨率和CT平扫密度对比度分别率较低[20],使得较小的病变因容积效应等因素而遗漏可能为其原因,但这也需要进一步的研究来阐明。对于较小的胰腺恶性病变即早期胰腺癌,PET/CT检查时需参考其他影像手段,如增强CT或增强MRI,甚至可进行PET与增强CT或增强MRI等同机扫描来提高对小病变的诊断效能,更早发现病变,行早期临床手术根治性切除,提高患者的治愈率和生存率。
综上所述,PET/CT在胰腺良恶性病变的诊断与鉴别诊断中有着重要的作用。18F⁃FDG作为一种常用且成熟的显像剂,其灵敏度较高,但特异性较低。在胰腺病变诊断过程中,尤其对较小的胰腺病变,应当密切结合患者的病史、临床表现、体征、血清学检查和其他影像检查来提高疾病诊断的准确性,避免漏诊及误诊出现。同时还应探索多种特异性较高的显像剂如(11C⁃acetate等[21,22])在胰腺癌诊断中的应用,提高诊断效能,为临床提供更加全面和准确的信息。
[1]Vincent A,Herman J,Schulick R,et al.Pancreatic cancer[J].Lan⁃cet,2011,378(9791):607-620.
[2]Wang ZQ,Lu GM,Li JS,et al.The comparative study of tumor an⁃giogenesis and CT enhancement in pancreatic carcinoma[J].Eur J Radiology,2004,49(3):274-278.
[3]Jemal A,Siegel R,Ward E,et al.Cancer statieties,2009[J].CA Cancer J Clin,2009,59(4):225-249.
[4]Takhar AS,Palaniappan P,Dhingsa R,et al.Recent development in diagnosis of pancreatic cancer[J].BMJ.2004,329 (7467):668-673.
[5]Meller J,Sahimann CO,Guroeak O,et al.FDG⁃PET in patients with fever of unknown origin:the importance of diagnosing large vessel vasculitis[J].QJ Nucl Med Mol Imaging,2009,53(l):51-63.
[6]Reske SN,Grill enberer KG,Glatting G,et al.Overexpression of glu⁃cose transporter⁃1 and increased FDG uptake in pancreatic carcino⁃ma[J].J Nucl Med,1997,38(9):1344-1348.
[7]Takanami K,Hiraide T,Tsuda M,et al.Additional value of FDG PET/CT to contrast⁃enhanced CT in the differentiation between be⁃nign and malignant intraductal papillary mucinous neoplasms of the pancreas with mural nodules[J].Ann Nucl Med,2011,25(7):501-510.
[8]Fendrich V,Schneider R,Maitra A,et al.Detection of precursor le⁃sions of pancreatic adenocarcinoma in PET⁃CT in a genetically engi⁃neered mouse model of pancreatic cancer[J].Neoplasia,2011,13(2):180-186.
[9]Friess H,Langhans J,Ebert M,et al.Diagnosis of pancreatic cancer by 2[18F]⁃fluoro⁃2⁃deoxy⁃D⁃glucose positron emission tomography[J].Gut,1995,36(5):771-777.
[10]王大龙,于丽娟,王欣,等.胰腺癌18F⁃FDG PET/CT显像剂诊断方法[J].中国医学影像技术,2011,27(1):103-107.
[11]Ozaki Y,Oguehi K,Hamano H,et al.Differentiation of autoim⁃mune pancreatitis from suspected pancreatic cancer by fluorine⁃18 fluorodeoxyglucose positron emission tomography[J].J Gastroen⁃terol,2008,43(2):144-151.
[12]Xin L,Liao Z,Hu L H,et al.The sensitivity of combined IgG4 and IgG in autoimmune pancreatitis[J].Am J Gastroenterol,2010,105(8):1902.
[13]Lee TY,Kim MH,Park do H,et al.Utility of 18F⁃FDG PETCT for differentiation of autoimmune pancreatitis with atypical pancreatic imaging findings from pancreatic cancer[J].Am J Roentgenol,2009,193(2):343-348.
[14]Baioechi GL,Portolani N,Bertagna F,et al.Possible additional val⁃ue of18FDG⁃PET in managing pancreas intraductal papillary muci⁃nous neoplasms:Preliminary results[J].J Exp Clin Caneer Res,2008,10(27):10.
[15]Zhuang H,Pourdehnad M,et al.Dual time point18F⁃FDG PET im⁃aging for differentiating malignant from inflammatory processes[J].J Nucl Med,2001,42(9):1412-1417.
[16]Nishiyama Y,Yamamoto Y,Monden T,et al.Evaluation of delayed additional FDG PET imaging in patients with pancreatic tumor[J].Nucl Med Commun,2005,26(10):895-901.
[17]Okano K,Kakinoki K,Akamoto S,et al.18F⁃fluorodeoxyglucose positron emission tomography in the diagnosis of small pancreatic cancer[J].World J Gastroenterol,2011,17(2):231-235.
[18]Seo S,Hatano E.Fluorine⁃18fluorodeoxyglucose positron emission tomography predicts tumor differentiation,P⁃glycoprotein expres⁃sion,and outcome after resection in hepatocellular carcinoma[J].Clin Cancer Res,2007,13(2 Pt 1):427-433.
[19]Seo S,Doi R,Machimoto T,et al.Contribution of18F⁃fluorodeoxyglu⁃cose positron emixxion tomography to the diagnosis of early pancre⁃atic carcinoma[J].J Hepatobiliary Pancreat Surg,2008,15(6):634-639.
[20]Hoffman EJ,Huang SC,Phelps ME.Quantitation in positron emis⁃sion computed tomography:Effect of object size[J].J Comput As⁃sist Tomogr,1979,3(3):299-308.
[21]Kaji M,Nornori H,Watanabe K,et al.llC⁃acetate and18F⁃fluorode⁃oxyglucose positron emission tomography of pulmonary adenocarci⁃noma[J].Annthorac Surg,2007,83(1):312-314.
[22]Rasmussen I,Sorensen J,Langstrom B,et al.Is Positron emission tomography using18F⁃fluorodeoxyglucose and 11C⁃acetate valuable in diagnosing Indeterminate pancreatic masses?[J].Scand J Surg,2004,93(3):191-197.

